Реферат: Химия белка
Реферат: Химия белка
ХИМИЯ
БЕЛКА
Биохимия - это наука о
химических и физико-химических процессах, которые протекают в живых организмах
и лежат в основе всех проявлений жизнедеятельности. Биохимия возникла на стыке
органической химии и физиологии в конце прошлого века.
СТРОЕНИЕ И
СВОЙСТВА БЕЛКОВ
БЕЛКИ или ПРОТЕИНЫ - это
высокомолекулярные азотсодержащие органические вещества, линейные
гетерополимеры, структурным компонентом которых являются аминокислоты,
связанные пептидными связями.
Кроме понятия «белок», в
химии встречается термины «ПЕПТИД» и «ПОЛИПЕПТИД». Пептидом обычно называют
олигомер, состоящий не более чем из 10 аминокислот. Но встречаются и молекулы,
содержащие от 10 до 100 аминокислот – они относятся к группе небольших
ПОЛИПЕПТИДОВ, крупные же полипептиды могут содержать и более 100 аминокислот.
Столько же аминокислот могут содержать и некоторые небольшие белки. Поэтому
граница по количеству аминокислотных остатков, а, стало быть, и по молекулярной
массе, между белками и полипептидами, весьма условна.
В природе встречаются
десятки тысяч различных белков. И все они отличаются друг от друга по пяти
основным признаком.
Основные различия в
строении белковых молекул
По количеству аминокислот
По соотношению количества
различных аминокислот. Например, в белке соединительной ткани коллагене 33% от
общего количества аминокислот составляет глицин, а в молекуле белкового гормона
инсулина, вырабатываемого в поджелудочной железе, содержание глицина гораздо
меньше – всего 8%.
Различная
последовательность чередования аминокислот. Это означает, что даже при
одинаковом соотношении разных аминокислот в каких-нибудь двух белках порядок их
расположения этих аминокислот различен, то это будут разные белки.
Количество полипептидных
цепей в различных белках может варьировать от 1 до 12, но если больше единицы,
то обычно четное (2, 4, 6 и т.п.)
По наличию небелкового компонента,
который называется «ПРОСТЕТИЧЕСКАЯ ГРУППА». Если ее нет, то это – простой
белок, если есть – сложный белок
В природе встречается
около 150 аминокислот. Для построения белков используются только 20 из них,
хотя в метаболизме организма человека участвует большее количество аминокислот.
Эти 20 аминокислот имеют несколько общих признаков строения (общие
свойства аминокислот):
1. Все они являются
альфа-аминокислотами.
Аминогруппа общей части всех аминокислот присоединена к альфа-углеродному
атому.
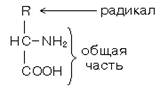
2. По стереохимической
конфигурации альфауглеродного атома все они принадлежат к L-ряду.
Следовательно, все эти 20
аминокислот имеют совершенно одинаковый фрагмент молекулы. Различаются они по
строению радикалов.
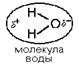
Молекула воды обладает
полярными свойствами.
Атом кислорода сильнее
притягивает электроны, чем атомы водорода, поэтому электронное облако смещено в
сторону кислорода. Степень полярности определяется величиной частичных зарядов
и расстоянием между центрами тяжести этих зарядов. Таким образом, молекула воды
является диполем.
 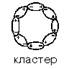
Молекулы воды структурированы
и образуют кластеры.
В эти кластерные
структуры хорошо встраиваются молекулы, которые сами являются полярными, потому
что полярные вещества хорошо растворимы в воде. Полярными являются все те
молекулы, которые содержат электроотрицательные атомы. В молекулах белков
электроотрицательными атомами являются O (кислород), N (азот) и S (сера).
Высокая полярность
обеспечивает остальные общие свойства аминокислот:
3. Хорошая
растворимость в воде
благодаря наличию общего фрагмента молекулы. Общий фрагмент обладает полярными
свойствами, потому что содержит карбоксильную группу –COOH (при физиологическом
значении pH эта группа заряжена отрицательно), и аминогруппы -NH2 (при
физиологическом значении pH заряжена положительно).
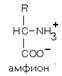
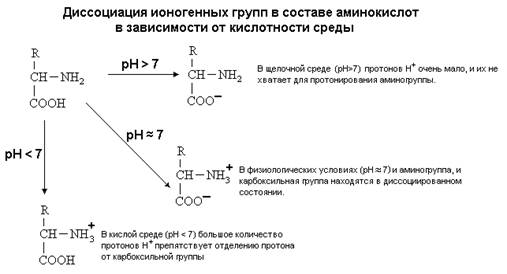
4. Способность к
электролитической диссоциации. Аминокислоты существуют в водном растворе в виде амфионов
(биполярных ионов). В целом такая молекула при нейтральном значении pH (при
pH=7) электронейтральна.
5. Наличие ИЗОЭЛЕКТРИЧЕСКОЙ
ТОЧКИ (ИЭТ, pI). (ИЭТ) - это значение pH среды, при котором молекула амфотерного
вещества (например, аминокислоты) находится в электронейтральном состоянии.
РАЗЛИЧИЯ В
СТРОЕНИИ АМИНОКИСЛОТ
Радикалы аминокислот
могут значительно отличаться друг от друга по строению.
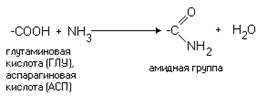
Если есть дополнительные
карбоксильные группы в радикале, то заряд молекулы в нейтральной среде
отрицателен, а ИЭТ такой молекулы находится в кислой среде.
Аминокислота, в
радикале которой есть дополнительная аминогруппа (NH2-группа), в
нейтральной среде заряжена положительно. ИЭТ такой аминокислоты находится в
щелочной среде (pI>7). К таким аминокислотам относятся лизин, аргинин и гистидин.
Аминокислота, в
радикале которой есть дополнительная карбоксильная группа (COOH-группа), в нейтральной
среде заряжена отрицательно. ИЭТ такой аминокислоты находится в кислой среде
(pI<7). К ним
относятся аспарагиновая кислота и глутаминовая кислота.
С помощью значения рН
внешней среды характеризуют соотношение -СООН и -NH2 групп. Это
относится и к пептидам, и к белкам.
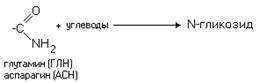
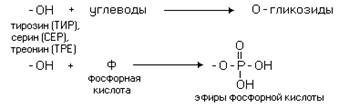
Различные функциональные
группы, содержащиеся в радикалах аминокислот, придают им способность к
взаимодействию с образованием разных типов соединений. Приведем примеры таких
взаимодействий.
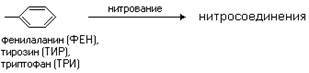
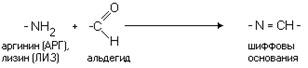
В связи с различиями в
строении радикалов различны и физико-химические свойства аминокислот.
КЛАССИФИКАЦИЯ
АМИНОКИСЛОТ
Существуют три типа
классификации:
ФИЗИКО-ХИМИЧЕСКАЯ – основана на различиях в
физико-химических свойствах аминокислот.
Гидрофобные
аминокислоты (неполярные). Компоненты радикалов содержат обычно углеводородные группы, где
равномерно распределена электронная плотность и нет никаких зарядов и полюсов.
В их составе могут присутствовать и электроотрицательные элементы, но все они
находятся в углеводородном окружении. Например, в радикале метионина сера
окружена углеводородными группировками, которые не позволяют этому элементу
проявлять своих электроотрицательных свойств: -(CH2)2-S-CH3.
Аналогичная ситуация наблюдается, например, и в отношении азота, находящегося в
составе радикала триптофана.
Гидрофильные
незаряженные (полярные) аминокислоты. Радикалы таких аминокислот содержат в своем составе
полярные группировки:

Эти группы
взаимодействуют с дипольными молекулами воды, которые ориентируются вокруг них.
Отрицательно
заряженные аминокислоты. Сюда относятся аспарагиновая и глутаминовая кислоты. Имеют
дополнительную СООН-группу в радикале - в нейтральной среде приобретают
отрицательный заряд.
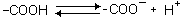
Все они гидрофильны.
Положительно заряженные
аминокислоты: аргинин, лизин и гистидин. Имеют дополнительную NH2-группу
(или имидазольное кольцо, как гистидин) в радикале - в нейтральной среде
приобретают положительный заряд.
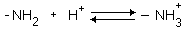
Все они также являются
гидрофильными.
Такие свойства характерны
для свободных аминокислот. В белке же ионогенные группы общей части аминокислот
участвуют в образовании пептидной связи, и все свойства белка определяются
только свойствами радикалов аминокислот.
Не все аминокислоты,
принимающие участие в построении белков человеческого тела, способны
синтезироваться в нашем организме. На этом основана еще одна классификация
аминокислот - биологическая.
II. Биологическая классификация.
а) Незаменимые
аминокислоты, их еще называют "эссенциальные". Они не могут
синтезироваться в организме человека и должны обязательно поступать с пищей. Их
8 и еще 2 аминокислоты относятся к частично незаменимым.
Незаменимые: метионин,
треонин, лизин, лейцин, изолейцин, валин, триптофан, фенилаланин.
Частично незаменимые:
аргинин, гистидин.
а) Заменимые
(могут синтезироваться в организме человека). Их 10: глутаминовая кислота,
глутамин, пролин, аланин, аспарагиновая кислота, аспарагин, тирозин, цистеин,
серин и глицин.
III. Химическая классификация
- в соответствии с химической структурой радикала аминокислоты (алифатические,
ароматические).
Белки синтезируются на
рибосомах, не из свободных аминокислот, а из их соединений с транспортными РНК
(т-РНК).
Этот комплекс называется
«аминоацил-т-РНК».
ТИПЫ
СВЯЗЕЙ МЕЖДУ АМИНОКИСЛОТАМИ В МОЛЕКУЛЕ БЕЛКА
2 группы:
1. КОВАЛЕНТНЫЕ СВЯЗИ -
обычные прочные химические связи.
а) пептидная связь
б) дисульфидная связь
2. НЕКОВАЛЕНТНЫЕ (СЛАБЫЕ)
ТИПЫ СВЯЗЕЙ - физико-химические взаимодействия родственных структур. В десятки
раз слабее обычной химической связи. Очень чувствительны к физико-химическим
условиям среды. Они неспецифичны, то есть соединяются друг с другом не строго
определенные химические группировки, а самые разнообразные химические группы,
но отвечающие определенным требованиям.
а) Водородная связь
б) Ионная связь
в) Гидрофобное
взаимодействие
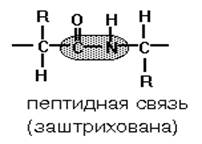
ПЕПТИДНАЯ СВЯЗЬ.
Формируется за счет COOH-группы
одной аминокислоты и NH2-группы соседней аминокислоты. В названии
пептида окончания названий всех аминокислот, кроме последней, находящейся на
«С»-конце молекулы меняются на «ил»
Тетрапептид:
валил-аспарагил-лизил-серин
ПЕПТИДНАЯ СВЯЗЬ
формируется ТОЛЬКО ЗА СЧЕТ АЛЬФА-АМИНОГРУППЫ И СОСЕДНЕЙ COOH-ГРУППЫ ОБЩЕГО ДЛЯ
ВСЕХ АМИНОКИСЛОТ ФРАГМЕНТА МОЛЕКУЛЫ!!! Если карбоксильные и аминогруппы входят
в состав радикала, то они никогда(!) не участвуют в формировании
пептидной связи в молекуле белка.
Любой белок - это длинная
неразветвленная полипептидная цепь, содержащая десятки, сотни, а иногда более
тысячи аминокислотных остатков. Но какой бы длины ни была полипептидная цепь,
всегда в основе ее - стержень молекулы, абсолютно одинаковый у всех белков.
Каждая полипептидная цепь имеет N-конец, на котором находится свободная
концевая аминогруппа и С-конец, образованный концевой свободной карбоксильной
группой. На этом стержне сидят как боковые веточки радикалы аминокислот.
Числом, соотношением и чередованием этих радикалов один белок отличается от
другого. Сама пептидная связь является частично двойной в силу лактим-лактамной
таутомерии. Поэтому вокруг нее невозможно вращение, а сама она по прочности в
полтора раза превосходит обычную ковалентную связь. На рисунке видно, что из
каждых трех ковалентных связей в стержне молекулы пептида или белка две
являются простыми и допускают вращение, поэтому стержень (вся полипептидная
цепь) может изгибаться в пространстве.
Хотя пептидная связь
довольно прочная, ее сравнительно легко можно разрушить химическим путем –
кипячением белка в крепком растворе кислоты или щелочи в течении 1-3 суток.
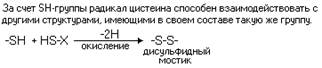
К ковалентным связям в
молекуле белка помимо пептидной, относится также ДИСУЛЬФИДНАЯ СВЯЗЬ.
Цистеин - аминокислота,
которая в радикале имеет SH-группу, за счет которой и образуются дисульфидные
связи.
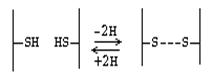
Дисульфидная связь - это
ковалентная связь. Однако биологически она гораздо менее устойчива, чем
пептидная связь. Это объясняется тем, что в организме интенсивно протекают
окислительно-восстановительные процессы. Дисульфидная связь может возникать
между разными участками одной и той же полипептидной цепи, тогда она удерживает
эту цепь в изогнутом состоянии. Если дисульфидная связь возникает между двумя
полипептидами, то она объединяет их в одну молекулу.
СЛАБЫЕ
ТИПЫ СВЯЗЕЙ
В десятки раз слабее
ковалентных связей. Это не определенные типы связей, а неспецифическое
взаимодействие, которое возникает между разными химическими группировками,
имеющими высокое сродство друг к другу (сродство – это способность к
взаимодействию). Например: противоположно заряженные радикалы.
Таким образом, слабые
типы связей - это физико-химические взаимодействия. Поэтому они очень
чувствительны к изменениям условий среды (температуры, pH среды, ионной силы
раствора и так далее).
ВОДОРОДНАЯ СВЯЗЬ - это связь, возникающая между двумя
электроотрицательными атомами за счет атома водорода, который соединен с одним
из электроотрицательных атомов ковалентно (см. рисунок).
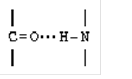
Водородная связь примерно
в 10 раз слабее, чем ковалентная. Если водородные связи повторяются
многократно, то они удерживают полипептидные цепочки с высокой прочностью. Водородные
связи очень чувствительны к условиям внешней среды и присутствию в ней веществ,
которые сами способны образовывать такие связи (например, мочевина).
ИОННАЯ СВЯЗЬ - возникает между положительно и
отрицательно заряженными группировками (дополнительные карбоксильные и аминогруппы),
которые встречаются в радикалах лизина, аргинина, гистидина, аспарагиновой и
глутаминовой кислот.
ГИДРОФОБНОЕ
ВЗАИМОДЕЙСТВИЕ -
неспецифическое притяжение, возникающее в молекуле белка между радикалами
гидрофобных аминокислот - вызывается силами Ван-дер-Ваальса и дополняется
выталкивающей силой воды. Гидрофобное взаимодействие ослабевает или разрывается
в присутствии различных органических растворителей и некоторых детергентов.
Например, некоторые последствия действия этилового спирта при проникновении его
внутрь организма обусловлены тем, что под его влиянием ослабляются гидрофобные
взаимодействия в молекулах белков.
ПРОСТРАНСТВЕННАЯ
ОРГАНИЗАЦИЯ БЕЛКОВОЙ МОЛЕКУЛЫ
В основе каждого белка
лежит полипептидная цепь. Она не просто вытянута в пространстве, а организована
в трехмерную структуру. Поэтому существует понятие о 4-х уровнях
пространственной организации белка, а именно - первичной, вторичной, третичной
и четвертичной структурах белковых молекул.
ПЕРВИЧНАЯ СТРУКТУРА
Первичная структура
белка -
последовательность аминокислотных фрагментов, прочно (и в течение всего периода
существования белка) соединенных пептидными связями. Существует период полужизни
белковых молекул - для большинства белков около 2-х недель. Если произошел
разрыв хотя бы одной пептидной связи, то образуется уже другой белок.
ВТОРИЧНАЯ СТРУКТУРА
Вторичная структура - это пространственная организация
стержня полипептидной цепи. Существуют 3 главнейших типа вторичной структуры:
1) Альфа-спираль
- имеет определенные характеристики: ширину, расстояние между двумя витками
спирали. Для белков характерна правозакрученная спираль. В этой спирали на 10
витков приходится 36 аминокислотных остатков. У всех пептидов, уложенных в
такую спираль, эта спираль абсолютно одинакова. Фиксируется альфа-спираль с помощью
водородных связей между NH-группами одного витка спирали и С=О группами
соседнего витка. Эти водородные связи расположены параллельно оси спирали и
многократно повторяются, поэтому прочно удерживают спиралеобразную структуру.
Более того, удерживают в несколько напряженном состоянии (как сжатую пружину).
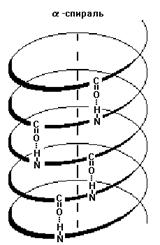
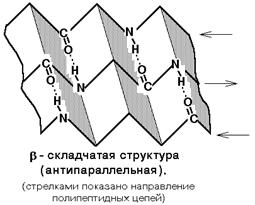
Бета-складчатая
структура -
или структура складчатого листа. Фиксируется также водородными связями между
С=О и NH-группами. Фиксирует два участка полипептидной цепи. Эти цепи могут
быть параллельны или антипараллельны. Если такие связи образуются в пределах
одного пептида, то они всегда антипараллельны, а если между разными
полипептидами, то параллельны.
3) Нерегулярная
структура - тип вторичной структуры, в котором расположение
различных участков полипептидной цепи относительно друг друга не имеет
регулярного (постоянного) характера, поэтому нерегулярные структуры могут иметь
различную конформацию.
ТРЕТИЧНАЯ СТРУКТУРА
Это трехмерная
архитектура полипептидной цепи – особое взаимное расположение в пространстве
спиралеобразных, складчатых и нерегулярных участков полипептидной цепи. У
разных белков третичной структуры различна. В формировании третичной структуры
участвуют дисульфидные связи и все слабые типы связей.
Выделяют два общих типа
третичной структуры:
1) В фибриллярных
белках (например, коллаген, эластин) молекулы которых имеют вытянутую
форму и обычно формируют волокнистые структуры тканей, третичная структура
представлена либо тройной альфа-спиралью (например, в коллагене), либо бета-складчатыми
структурами.
2) В глобулярных белках,
молекулы которых имеют форму шара или эллипса (латинское название: GLOBULA -
шар), встречается сочетание всех трех типов структур: всегда есть
нерегулярные участки, есть бета-складчатые структуры и альфа-спирали.
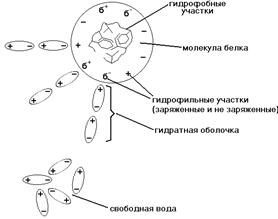
Обычно в глобулярных
белках гидрофобные участки молекулы находятся в глубине молекулы. Соединяясь
между собой, гидрофобные радикалы образуют гидрофобные кластеры
(центры). Формирование гидрофобного кластера вынуждает молекулу соответствующим
образом изгибаться в пространстве. Обычно в молекуле глобулярного белка бывает
несколько гидрофобных кластеров в глубине молекулы. Это является проявлением
двойственности свойств белковой молекулы: на поверхности молекулы -
гидрофильные группировки, поэтому молекула в целом - гидрофильная, а в глубине
молекулы - спрятаны гидрофобные радикалы.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА
Встречается не у всех
белков, а только у тех, которые состоят из двух или более полипептидных цепей.
Каждая такая цепь называется СУБЪЕДИНИЦЕЙ данной молекулы (или ПРОТОМЕРОМ).
Поэтому белки, обладающие четвертичной структурой, называют ОЛИГОМЕРНЫМИ
белками. В состав белковой молекулы могут входить одинаковые или разные
субъединицы. Например, молекула гемоглобина «А» состоит из двух субъединиц
одного типа и двух субъединиц другого типа, то есть является тетрамером.
Фиксируются четвертичные структуры белков всеми типами слабых связей, а иногда
еще и дисульфидными связями.
МЕТОДЫ
ОПРЕДЕЛЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКА
1)Деградация по Эдмону
К раствору белка добавляют
реактив Эдмона, содержащий фенилизотиоцианат.
Фенилизотиоцианат
взаимодействует с альфа-аминогруппой первой (N-концевой) аминокислоты, а затем
происходит ее отщепление от полипептидной цепи путем гидролиза:
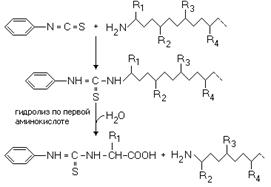
После этого
идентифицируют первую аминокислоту. Затем процесс повторяется.
В настоящее время процесс
автоматизирован.
2) Секвенирование ДНК
Первичная структура любой
белковой молекулы напрямую зависит от структуры ДНК-генома. Поэтому сначала
выделяют ген, в котором закодирована структура белка. Далее определяют
последовательность азотистых оснований в ДНК. Каждая аминокислота в белковой
молекуле закодирована сочетанием трех азотистых оснований - триплетом (кодоном)
в молекуле ДНК. Например, сочетание трех оснований аденина (ААА) кодирует
аминокислоту фенилаланин, а последовательность из трех оснований цитозина –
глицин. Это дает возможность получить информацию о первичной структуре белковой
молекуле, а, значит, прогнозировать строение всей молекулы в целом, поскольку
именно первичная структура определяет строение всех высших уровней организации
– и вторичной, и третичной, а, иногда и четвертичной структур.
Для проверки
предположений о строении высших структур используется еще один метод:
3) Рентгеноструктурный
анализ
Схема, поясняющая принцип
этого метода, представлена на рисунке:
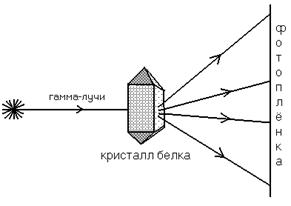
В результате облучения на
фотопленке фиксируется карта электронной плотности (похожа на географическую
карту). Далее производится компьютерный анализ полученного изображения, в
результате чего строится пространственная модель белковой молекулы.
Электронная
микроскопия
Может быть использована
для выяснения структуры белковых молекул с большой молекулярной массой – от
500.000 до 1.000.000 Да (дальтон). Дальтон (Да) и килодальтон (кДа)–
единицы измерения массы белков. 1кДа=103 Да. 1 дальтон равен 1/16
массы атома кислорода (кислородная единица массы).
КОНФИГУРАЦИЯ
И КОНФОРМАЦИЯ БЕЛКОВОЙ МОЛЕКУЛЫ
Из всего сказанного можно
заключить, что пространственная организация белков очень сложна. В химии
существует понятие - пространственная КОНФИГУРАЦИЯ - жестко
закрепленное ковалентными связями пространственное взаимное расположение частей
молекулы (например: принадлежность к L-ряду стереоизомеров или к D-ряду).
Для белков также
используется понятие КОНФОРМАЦИЯ белковой молекулы -
определенное, но не застывшее, не неизменное взаимное расположение частей молекулы.
Так как конформация белковой молекулы формируется при участии слабых типов
связей, то она является подвижной (способной к изменениям), и белок может
изменять свою структуру. В зависимости от условий внешней среды молекула может
существовать в разных конформационных состояниях, которые легко переходят друг
в друга. Энергетически выгодными для реальных условий являются только одно или
несколько конформационных состояний, между которыми существует равновесие.
Переходы из одного конформационного состояния в другое обеспечивают
функционирование белковой молекулы. Это обратимые конформационные изменения
(встречаются в организме, например, при проведении нервного импульса, при
переносе кислорода гемоглобином). При изменении конформации часть слабых связей
разрушается, и образуются новые связи слабого типа.
ЛИГАНДЫ
Взаимодействие белка с
каким-нибудь веществом иногда приводит к связыванию молекулы этого вещества
молекулой белка. Этот явление известно как «сорбция» (связывание).
Обратный же процесс - освобождение другой молекулы от белковой называется «десорбция».
Если для какой-нибудь
пары молекул процесс сорбции преобладает над десорбцией, то это уже специфическая
сорбция, а вещество, которое сорбируется, называется «лиганд».
Виды лигандов:
1) Лиганд белка-фермента
– субстрат.
2) Лиганд траспортного
белка – транспортируемое вещество.
3) Лиганд антитела
(иммуноглобулина) – антиген.
4) Лиганд рецептора
гормона или нейромедиатора – гормон или нейромедиатор.
Белок может изменять свою
конформацию не только при взаимодействии с лигандом, но и в результате любого
химического взаимодействия. Примером такого взаимодействия может служить
присоединение остатка фосфорной кислоты.
В природных условиях
белки имеют несколько термодинамически выгодных конформационных состояний. Это
нативные состояния (природные). Natura (лат.) – природа.
НАТИВНОСТЬ
БЕЛКОВОЙ МОЛЕКУЛЫ
НАТИВНОСТЬ - это уникальный комплекс
физических, физико-химических, химических и биологических свойств белковой
молекулы, который принадлежит ей, когда молекула белка находится в
естественном, природном (нативном) состоянии.
Например: белок
хрусталика глаза - кристаллин - обладает высокой прозрачностью только в
нативном состоянии).
ДЕНАТУРАЦИЯ
БЕЛКА
Для обозначения процесса,
при котором нативные свойства белка теряются, используют термин ДЕНАТУРАЦИЯ.
ДЕНАТУРАЦИЯ - это лишение белка его природных,
нативных свойств, сопровождающееся разрушением четвертичной (если она была),
третичной, а иногда и вторичной структуры белковой молекулы, которое возникает
при разрушении дисульфидных и слабых типов связей, участвующих в образовании
этих структур.
Первичная структура при этом сохраняется, потому что она сформирована прочными
ковалентными связями. Разрушение первичной структуры может произойти только в
результате гидролиза белковой молекулы длительным кипячением в растворе кислоты
или щелочи.
ФАКТОРЫ,
ВЫЗЫВАЮЩИЕ ДЕНАТУРАЦИЮ БЕЛКОВ
Факторы, которые вызывают
денатурацию белков, можно разделить на физические и химические.
Физические факторы
1. Высокие температуры.
Для разных белков характерна различная чувствительность к тепловому
воздействию. Часть белков подвергается денатурации уже при 40-500С.
Такие белки называют термолабильными. Другие белки денатурируют при
гораздо более высоких температурах, они являются термостабильными.
2. Ультрафиолетовое
облучение
3. Рентгеновское и
радиоактивное облучение
4. Ультразвук
5. Механическое
воздействие (например, вибрация).
Химические факторы
1. Концентрированные
кислоты и щелочи. Например, трихлоруксусная кислота (органическая), азотная
кислота (неорганическая).
2. Соли тяжелых металлов
(например, CuSO4).
3. Органические
растворители (этиловый спирт, ацетон)
4. Растительные
алкалоиды.
5. Мочевина в высоких
концентрациях
5. Другие вещества,
способные нарушать слабые типы связей в молекулах белков.
Воздействие факторами
денатурации применяют для стерилизации оборудования и инструментов, а также как
антисептики.
Обратимость денатурации
В пробирке (in vitro)
чаще всего это – необратимый процесс. Если же денатурированный белок поместить
в условия, близкие к нативным, то он может ренатурировать, но очень медленно, и
такое явление характерно не для всех белков.
In vivo, в организме,
возможна быстрая ренатурация. Это связано с выработкой в живом организме
специфических белков, которые «узнают» структуру денатурированного белка,
присоединяются к нему с помощью слабых типов связи и создают оптимальные
условия для ренатурации. Такие специфические белки известны как «белки
теплового шока» или «белки стресса».
Белки стресса
Существует несколько
семейств этих белков, они отличаются по молекулярной массе.
Например, известен белок
hsp 70 – heatshock protein массой 70 kDa.
Такие белки есть во всех
клетках организма. Они выполняют также функцию траспорта полипептидных цепей
через биологические мембраны и участвуют в формировании третичной и
четвертичной структур белковых молекул. Перечисленные функции белков стресса
называются шаперонными. При различных видах стресса происходит индукция
синтеза таких белков: при перегреве организма (40-440С), при
вирусных заболеваниях, отравлениях солями тяжелых металлов, этанолом и др.
В организме южных народов
установлено повышенное содержание белков стресса, по сравнению с северной
расой.
Молекула белка теплового
шока состоит из двух компактных глобул, соединенных свободной цепью:

Разные белки теплового
шока имеют общий план построения. Все они содержат контактные домены.
Разные белки с различными
функциями могут содержать одинаковые домены. Например, различные кальций-связывающие
белки имеют одинаковый для всех них домен, отвечающий за связывание Ca+2.
Роль доменной структуры
заключается в том, что она предоставляет белку большие возможности для
выполнения своей функции благодаря перемещениям одного домена по отношению к
другому. Участки соединения двух доменов – самое слабое в структурном отношении
место в молекуле таких белков. Именно здесь чаще всего происходит гидролиз
связей, и белок разрушается.
ФИЗИКО-ХИМИЧЕСКИЕ
СВОЙСТВА БЕЛКОВ. РАСТВОРИМОСТЬ БЕЛКОВ В ВОДЕ
Большинство белков
гидрофильны. Однако белковые молекулы имеют очень большие размеры, поэтому
белки не могут образовывать истинных растворов, а только коллоидные. Внешнее
проявление этого - это эффект Тиндаля (или конус Тиндаля). Эффект Тиндаля
вызывается рассеянием тонкого пучка света при прохождении через белковый
раствор. Несмотря на большую величину, многие белковые молекулы не осаждаются в
водных растворах. Осаждению белковых молекул препятствуют факторы
стабилизации белкового раствора.
ФАКТОРЫ
СТАБИЛИЗАЦИИ БЕЛКА В РАСТВОРЕ
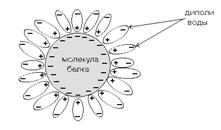
ГИДРАТНАЯ ОБОЛОЧКА - это слой молекул воды,
определенным образом ориентированных на поверхности белковой молекулы.
Поверхность большинства белковых молекул заряжена отрицательно, и диполи
молекул воды притягиваются к ней своими положительно заряженными полюсами
(смотрите рисунок).
Чем больше гидрофильных
свойств у белковой молекулы, чем больше в ее составе и на ее поверхности
аминокислот с полярными (гидрофильными) радикалами, тем сильнее выражена и прочнее
удерживается гидратная оболочка и тем больше в ней слоев. Вода гидратной оболочки
обладает особыми свойствами: она не является свободной, а связана с белковой
молекулой. Это - “связанная” вода. Она принадлежит белку, и поэтому имеет
особые свойства.
Свойства воды гидратной
оболочки
а) Температура кипения
выше 1000С.
б) Температура замерзания
ниже 0ОС.
в) В воде гидратной
оболочки не растворяются различные соли и другие гидрофильные вещества.
г) Окружая каждую
молекулу белка, гидратная оболочка не дает этим белковым молекулам сблизиться,
соединиться и выпасть в осадок.
2) ЗАРЯД БЕЛКОВОЙ
МОЛЕКУЛЫ.
Поверхность большинства белковых молекул заряжена потому, что в каждой молекуле
белка есть свободные заряженные СОО- и NH3+
группы. Изоэлектрическая точка (ИЭТ) большинства белков организма находится в
слабокислой среде. Это означает, что у таких белков количество кислотных (СООН)
групп больше количества основных групп (NH3). рН плазмы крови около
7,36 - это выше ИЭТ большинства белков, поэтому в плазме крови белки имеют
отрицательный заряд.
СПОСОБЫ
ОСАЖДЕНИЯ БЕЛКОВ
Делятся на две группы:
1) Способы осаждения
нативного белка
2) Способы осаждения
денатурированного белка
Чтобы осадить белок из
раствора, надо лишить его обоих факторов стабилизации: и заряда, и гидратной
оболочки.
ОСАЖДЕНИЕ
НАТИВНЫХ БЕЛКОВ
Чтобы сохранить
нативность белковой молекулы, ее заряд можно устранить только одним способом:
приблизить рН среды к изоэлектрической точке белка (ИЭТ), а для большинства
белков нашего организма ИЭТ находится в слабокислой среде. Другой фактор
стабилизации - гидратную оболочку можно устранить разными способами.
Наиболее типичным
примером осаждения нативного белка является ВЫСАЛИВАНИЕ.
а) ВЫСАЛИВАНИЕ - это осаждение белков высокими
концентрациями нейтральных солей щелочных и щелочноземельных металлов,
поскольку такие соли очень гидрофильны и обладают в высоких концентрациях
водоотнимающими свойствами. Чаще это NaCl, Na2SO4, (NH4)2SO4,
CaCl2. По мере добавления таких солей к раствору белка они сначала
растворяюся в свободной воде, а затем, при дальнейшем повышении концентрации
соли, конкурируют с белком за обладание водой, которая входит в состав
гидратных оболочек. Белки менее гидрофильные, которые плохо удерживают воду
гидратной оболочки, теряют ее раньше. Более гидрофильные белки требуют большей
концентрации соли для высаливания. Поэтому с помощью высаливания можно
разделить белки с разной степенью гидрофильности. Таким способом, например,
можно разделить альбумины и глобулины плазмы крови.
При высаливании
сохраняется нативность белковых молекул. Если осадить белки с помощью
высаливания, а затем уменьшить концентрацию солей, например, методом диализа,
то белок опять растворится.
Осаждения белков без
потери ими нативности можно достичь также с помощью водоотнимающих средств.
б) ПРИМЕНЕНИЕ
ВОДООТНИМАЮЩИХ СРЕДСТВ. Такими средствами являются растворители, которые смешиваются с водой в
любых соотношениях. Чаще всего это ацетон, этиловый спирт. Эти вещества
отнимают гидратные оболочки белков, и белки выпадают в осадок, если они лишены
заряда. Но, в отличие от высаливания, осадок сразу (немедленно!) должен быть
отделен от растворителя. Если растворитель и белок будут длительно находиться в
контакте, то могут произойти необратимые изменения структуры белковой молекулы
(денатурация).
ОСАЖДЕНИЕ
ДЕНАТУРИРОВАННЫХ БЕЛКОВ
а) ДЕЙСТВИЕ СОЛЕЙ
ТЯЖЕЛЫХ МЕТАЛЛОВ.
Образуют соединения с SH-группами белков. Ядовиты для человека и животных. В
медицинской практике применяются способы детоксикации при отравлениях тяжелыми
металлами. В этих случаях для обезвреживания этих металлов дают внутрь молоко
или другие белковые растворы.
б) КИПЯЧЕНИЕ (или просто нагревание до высоких
температур) - усиливается тепловое движение молекул, ослабляются слабые типы
связей, теряется нативность, белковая молекула “разворачивается”, гидрофобные
структуры выходят наружу. Это приводит к потере гидратной оболочки, молекулы
сближаются и взаимодействуют друг с другом. Это приводит к тому, что белок
выпадает в осадок. При охлаждении нативность не восстанавливается.
При кипячении белок не
всегда выпадает в осадок. Если нагревать белок в любой среде (сильно кислой,
сильно щелочной или нейтральной средах), то денатурация белка происходит
обязательно, белковые молекулы теряют гидратную оболочку. Но в сильно кислой
или в сильно щелочной средах молекулы белка в осадок не выпадают, потому что у
них остается один из факторов стабилизации - заряд. Сохранение заряда не
позволяет молекулам белка сблизиться друг с другом - агрегация полипептидных
цепей не происходит. Даже если раствор белка охладить - осадок все равно не
выпадает - это будет коллоидный раствор денатурированного белка. Если
приблизить затем рН среды к изоэлектрической точке белка (например, добавлением
кислоты или щелочи), то белок выпадет в осадок, потому что будет лишен обоих
факторов стабильности в растворе - и заряда, и гидратной оболочки.
|