Реферат: Влияние вида катализатора на параметры синтеза метанола
Реферат: Влияние вида катализатора на параметры синтеза метанола
Санкт-Петербургский
Государственный Технологический Институт
Кафедра: Технологии нефтехимических и углехимических
производств
Реферат
Тема: Влияние вида катализатора на параметры синтеза метанола
Выполнил:
Шеков А.П.
Проверил:
Сыроежко А.М.
С.-Петербург
2007
Введение
Метанол
известен очень давно, его обнаружили когда перегоняли древесину, примерно в 17
веке.
Именно
процесс сухой перегонки и оставался долгое время единственным способом его
получения.
В
20-х годах был разработан способ получения синтез-газа, а уже через три года
был получен первый промышленный метанол. Вначале он использовался как горючее
для двигателей внутреннего сгорания. Сейчас пути его применения значительно
расширились, как и объемы его производств. Метанол используют в качестве
химического сырья для получения: метилгалогенидов, формальдегидов, уксусной
кислоты, растворителей, этиленгликоля, уксусного ангидрида, низших олефинов,
бензинов и прочих.
Отличие
условий синтеза метанола от условий синтеза высших спиртов
В
1940г. Венцелем был разработан процесс каталитического гидрирования оксида
углерода (II) в стационарном слое плавленого
железного катализатора – синол-процесс. Синтез проводился при относительно
низких температурах: t=180-2000C и Р=0.5-2.5 МПа. В жидких продуктах
наблюдалось содержание первичных алифатических спиртов около 60-70%, а так же
некоторое количество других кислородсодержащих соединений.
Введение
церия или ванадия в железные катализаторы, осаждённые на носителях, повышало
выход высших спиртов. Это синтез был назван оксил-процессом. Условия его
проведения изначально на Fe, Fe-Cr, Zn-Cr катализаторах при t=180-2200C и давлении 1-3 МПа. Отличие
заключалось в применении синтез-газа, обогащённого водородом, - соотношение
СО:Н2 составило 1:(1.2-2). А при изменении этого соотношения
возрастал выход сложных высокомолекулярных эфиров – не нужных в данном
процессе. В скорее выяснилось, что модифицирование этих катализаторов – добавка
солей или оксидов щёлочных металлов приводит к образованию алифатических
спиртов. С того момента развитие синтеза из оксида углерода и водорода в
основном пошло по двум направлениям: синтез высших алифатических спиртов и
синтез метанола.
Процессы
получения высших спиртов можно разбить на три группы: 1) синтез на
катализаторах, аналогичных применяемым в синтезе Фишера – Тропша; 2) синтез на
модифицированных катализаторах синтеза метанола; 3) синтез из оксида углерода,
водорода и олефинов (оксосинтез).
Стадии
процесса и их тепловой эффект
В
настоящее время процесс синтеза метанола из оксида углерода и водорода на
медь-цинк-алюминиевых катализаторах можно записать следующим образом:
СО+2Н2
→ СН3ОН ∆Н0298= -90.3 кДж
СО2+3Н2
→ СН3ОН+Н2О ∆Н0298=
-49.4 кДж
Кроме
этих реакций, протекает и обратимая эндотермическая реакция диоксида углерода и
водорода:
СО2+Н2
↔ СО+Н2О ∆Н0298 = 41,0 кДж
Однако,
на основании исследований, был экспериментально доказан новый механизм,
согласно которому, метанол образовывался из СО2, который есть в исходной смеси
или образуется в реакции: СО+Н2О → СО2+Н2.
Нужно
отметить, что выход метанола при атмосферном давлении очень мал, примерно 2%.
Но его выход можно значительно увеличить, комбинируя давление, температуру и
катализаторы, которые увеличивают селективность процесса.
С
термодинамической точки зрения, образование метанола из синтез-газа является
экзотермической реакцией(110,8 кДж/моль), следовательно, с повышением
температуры константа её равновесия падает. А с увеличением давления
равновесная степень превращения растет, поэтому процесс получения метилового
спирта необходимо вести при низких температурах и высоких давлениях. При 6,8
МПа и 300 С (теоретический) выход составляет 100%.
При
синтезе метанола наряду с основными реакциями протекают и побочные:
(1)
СО+3Н2 ↔ СН4+Н2О
(2)
СО2+4Н2 ↔ СН4+ 2Н2О
(3) nCO+(2n+1)H2 ↔ CnH2n+2+nH2O
(4) nCO+2nH2 ↔ CnH2n+1OH+(n-1)H2O
(5) 2CO+4H2 ↔ CH3-O-CH3+H2O
(6)
С+СО2 ↔ 2СО
Чтобы
избавиться от образования побочных продуктов необходимо подобрать
высокоэффективные и селективные катализаторы, однако это не приведёт к полному
устранению этих реакций. Реакции (1) – (3) можно свести к минимуму если мы
исключим из состава катализаторов Fe,Ni и Co.Из-за наличия в составе катализатора оксида алюминия
протекает реакция с образованием диметилового эфира (5), однако она подавляется
вследствие того что синтез протекает при невысоких температурах. Также
подавляется реакция образования высших углеводородов. Присутствие в
катализаторе щелочноземельных и щелочных металлов ведет к образованию высших
спиртов,(4).Также протекает реакция Будуара (6), но только до тех пор, пока не
достигнута определенная температура.
Влияние вида катализатора на параметры, скорость и глубину
процесса
Синтез
метанола на цинк-хромовом катализаторе
В
1923 г. фирмой BASF было
предложено проводить синтез метанола на цинк-хромовом катализаторе. На этом
катализаторе процесс осуществляется при температуре 360 – 380 С, давлении 25 –
32 МПа, и скорости циркулирующего газа равной 10 000 – 60 000 ч-1.
Активность цинк – хромового катализатора зависит от способа его приготовления,
соотношения Zn:Cr, а также от размера зерен. Чаще всего применяют цилиндрики
или кольца с диаметром 10 мм и высотой 10 мм. Однако при соблюдении некоторых
условий производительности катализатора можно значительно увеличить с помощью
уменьшения размера зерна.
На
производительность катализатора влияет объемная скорость подачи газа и
концентрация оксида углерода в нем. Производительность растет с повышением СО и
увеличением скорости, но после прохождения максимума падает. Благодаря
содержанию оксида хрома препятствуется спекание оксида цинка, что благоприятно
сказывается на “жизнь” катализатора. Влияние температуры хорошо заметно при
давлении 10 – 30 МПа. Также на процесс хорошо влияет присутствие инертных газов
(азот, аргон), которые снижают эффективное давление реагирующих компонентов, но
не влияет на выход продукта. Срок службы катализатора в среднем составляет
около двух лет. Было также предложено большое число оксидных цинк-хромовых
катализаторов с добавками оксида меди, однако применения в синтезе при высоких
давлениях они не нашли.
Синтез
метанола на цинк-медном катализаторе
Цинк-медные
катализаторы были представлены фирмами Lurgi и ICI,
они позволяют проводить процесс в более мягких условиях по сравнению с
цинк-хромовыми катализаторами. Медьсодержащие катализаторы более активные, чем
цинк-хромовые. Однако оксидные цинк-хромовые более устойчивы к действию серы, и
пока не появились новые процессы очистки газа от сероводорода о использовании
медьсодержащих катализаторов можно было забыть. К счастью такие процессы
существуют, например Rectisol, благодаря этому, срок службы катализатора составляет три и более лет.
Другой минус, это дезактивация медных катализаторов при высоких температурах,
вследствие её рекристаллизации. Температура процесса не должна превышать 2700С.
Фирмами
Lurgi и ICI были успешно применены цинк-медные катализаторы для
промышленного получения метанола из синтез-газа. Данный катализатор
приготавливают совместным осаждением компонентов из более или менее
разбавленных растворов солей. После чего осадок фильтруют и отделяют. Очень
важно поддерживать при осаждении температуру и pH. Затем осадок высушивают и прокаливают, а после чего из
полученной массы формируют таблетки нужной величины. Перед тем как начать
эксплуатацию катализатора его необходимо восстановить, чтобы перевести оксид
меди в активную форму. Однако в процессе восстановления выделяется большое
количество тепла, и для предотвращения перегрева восстановление ведут в токе
инертных газов при небольших концентрациях водорода.
Для
синтеза метанола предложены также промотированные цинком медные катализаторы
Ренея, которые получают выщелачиванием алюминий-медь-цинковых сплавов. Эти
катализаторы имеют высокую активность и селективность, приводят к образованию
диметилового эфира, что может оказаться благоприятным, если смесь метанола и
диметилового эфира используется, например, в производстве бензина по способу «Mobil»
Схемы синтеза метанола
Рассмотрим
схему синтеза метанола фирмы ICI
(рис. 1).
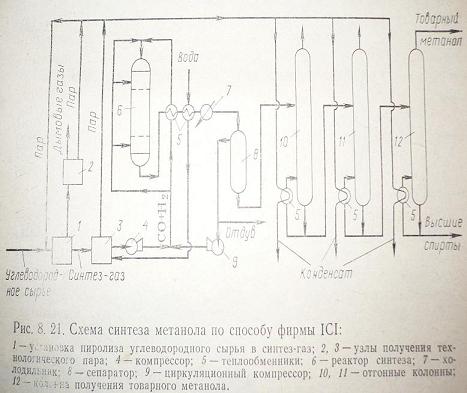
Рис.
1
Жидкое
сырье предварительно очищенное от сернистых примесей смешивают с водяным паром
при температуре 800 – 850 С.Превращение сырья в синтез-газ осуществляется в
присутствии никелевого катализатора. Тепло выделившееся в процессе используют
для получения технологического пара. После охлаждения полученный синтез-газ
сжимают до 5 – 10 МПа и направляют в реактор. Также можно использовать
синтез-газ, полученный неполным окислением угля или нефтяных остатков в
присутствии пара. Синтез на цинк-медном катализаторе ведут при 200–3000С
и 5–10 МПа. В реакторе катализатор расположен слоями. Выходящие из реактора
газы (6) проходят ряд теплообменников и поступают в сепаратор. Конденсат
метанола подвергают испарению и направляют на ректификацию. Данный процесс
характеризуется высокой производительностью и эффективной утилизацией тепла.
Рассмотрим
синтез метанола по способу фирмы Lurgi.
Метанол
получают при 5 МПа, используя для получения синтез-газа метана и тяжелые
нефтяные остатки и уголь. Окисление исходного сырья ведут при температуре
1400–14500С, и 5,5 МПа в присутствии водяного пара. Полученную смесь
водорода и оксида углерода предварительно очищенную от сажи и сернистых
соединений подогревают и под давлением 5–5,5 МПа вводят в реактор. Синтез
метанола ведут при температуре 250–2600С. Полученную газовую смесь
охлаждают и конденсируют.
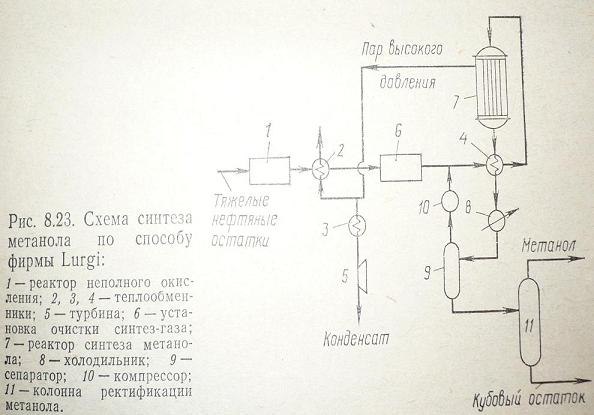
Рис.
2
Метанол-сырец
отделяют в сепараторе, а не прореагировавший синтез-газ снова направляют в
реактор синтеза.
Заключение
В
настоящее время больше половины всей энергии вырабатывается из нефти. Но рано
или поздно мы исчерпаем данный ресурс нашей планеты, поэтому просто необходимо
разрабатывать всё более современные методы получения топлив из всевозможных
продуктов. Метанол является хорошей заменой для топлив и сырьем для получения
множества продуктов, таких как высокооктановый бензин, метиламин,
метилметакрилат, этанол, уксусная кислота и др. А, следовательно, и его
получение из синтез газа в обход нефтепродуктов является хорошей технологией.
Метанол также можно использовать в качестве добавок к топливу. Он увеличивает
октановое число и уменьшает вредные выбросы в атмосферу, что благоприятно
сказывается на экологии.
Кроме
прямого использования метанола как топлива всё больший интерес приобретает
метанол как сырье для получения антидетонаторов трет-бутилметилового и
метил-трет-пентилового эфиров. Добавление 5-15% этих эфиров дает возможность
отказаться от применения в качестве присадок алкилата, ароматических
углеводородов и тетраэтилсвинца, который, как известно, очень вреден.
Список литературы
1.
Химическая
технология ТГИ / Под ред. Г.Н. Макарова, Г.Д. Харламповича-М.: Химия 1986-496 с.
2.
Печуро Н.С.,
Капкин В.Д., Песин О.Ю. Химия и технология синтетического жидкого топлива и
газа. М.: Химия, 1986-352 с.
3.
Синтезы на основе
оксида углерода и водорода. Метод. Указ./сост. Розенталь Д.А.: ЛТИ на
Ленсовета.-Л., 1988-14 с.
|