Реферат: Принципи одержання та використання алкінів
Реферат: Принципи одержання та використання алкінів
Принципи
одержання та використання алкінів
НОМЕНКЛАТУРА
Відповідно до вимог ІUPAC назви алкінів утворюють шляхом
замінення суфіксів -ан у назвах алканів на -ін (чи -ин) із зазначенням номера
атома карбону, з якого починається потрійний зв¢язок. Деякі алкіни частіше називають за
тривіальною номенклатурою, наприклад:
СНºСН
Етин (ацетилен)
СНºС-СН3
Пропін (алілен)
СН3-СºС-СН3
Бутин-2 (кротонілен)
ЕЛЕКТРОННА БУДОВА
Обидва атоми карбону при потрійному зв¢язку перебувають у
стані sp-гібридизації, внаслідок якої утворюються по дві гібридизовані
орбіталі, напрямлені під валентним кутом 1800. Перекривання гібридизованих
орбіталей забезпечує лінійну будову фрагмента -СºС-. Негібридизовані ру- і рz- орбіталі кожного
атома С перекриваються на взаємно перпендикулярних площинах, утворюючи два p-зв¢язки (рис.2).
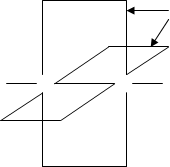
p Площини
p-зв¢язків
С s С
p
p
Рисунок 2 – Схема будови потрійного зв¢язку в молекулі
ацетилену
У молекулах гомологів ацетилену інші атоми карбону, які
не беруть участі в утворенні потрійного зв’язку, перебувають у стані
sp3-гібридизації.
Відмінною рисою потрійного зв¢язку є висока електронна густина у між¢ядерному просторі, що
призводить до стягування позитивно заряджених ядер і зближення атомів карбону.
Тому довжина потрійного зв¢язку
дорівнює 0,120нм, тобто вона набагато менша, ніж довжина подвійного (0,133нм) і
одинарного (0,154нм) зв¢язків.
А енергія потрійного зв¢язку
(828кДж/моль), навпаки, більша, ніж енергія подвійного (606кДж/моль) і
одинарного (347 кДж/моль) зв¢язків.
ІЗОМЕРІЯ
Для алкенів характерна структурна ізомерія, зумовлена
такими чинниками:
-різним положенням подвійного зв¢язку, наприклад:
СН3-СºС-СН3
Бутин-2
СНºС-СН2-СН3
Бутин-1
-будовою вуглецевого скелета (нормальна чи розгалужена),
наприклад:
  СНºС-СН-СН2-СН3 СНºС-СН2-СН-СН3 СНºС-СН-СН2-СН3 СНºС-СН2-СН-СН3
СН3 СН3
3-Метилпентин-1 4-Метилпентин-1
Крім того, ацетиленові вуглеводні виявляють ще міжкласову
ізомерію – метамерію:
-з алкадієнами:
С4Н6: СНºС-СН2-СН3
Бутин-1
СН2=СН-СН=СН2 Бутадієн-1,3
-з циклоалкенами:
 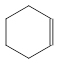 СН3 СН3
 С6Н10: СНºС–СН2-С-СН3 С6Н10: СНºС–СН2-С-СН3
СН3
4,4-Диметилбутин-1 Циклогексен
Алкіни за кількістю ізомерів займають проміжне положення
серед алканів і алкенів (табл. 1).
Таблиця 1 – Порівняння кількості ізомерів для алканів,
алкенів і алкінів
| Кількість атомів карбону в молекулі
вуглеводню |
Кількість ізомерів |
| Алкани СnH2n+2 |
Алкени CnH2n |
Алкіни CnH2n-2 |
| 1 |
1 |
- |
- |
| 2 |
1 |
1 |
1 |
| 3 |
1 |
1 |
1 |
| 4 |
2 |
3 |
3 |
| 5 |
3 |
5 |
3 |
| 6 |
5 |
13 |
7 |
| 7 |
9 |
27 |
14 |
| 8 |
18 |
66 |
32 |
ФІЗИЧНІ ВЛАСТИВОСТІ
За звичайних умов перші члени гомологічного ряду алкінів
(С2-С4) – гази, далі ідуть рідини, а починаючи з С9 – тверді речовини.
Найважливіший із алкінів – ацетилен – безбарвний газ,
погано розчинний у воді (при 200С в 1л води розчиняється 1,21г С2Н2), але добре
розчинний в ацетоні (в 1л ацетону розчиняється 350л С2Н2 за н.у.) – ця
властивість використовується за необхідності збереження та транспортування
ацетилену (перевезення ацетилену в газоподібному стані потребує дуже великих
ємностей, а під тиском – зовсім неможливе, оскільки при стисканні С2Н2 розкладається
на сажу і водень). З повітрям ацетилен утворює самовибухові суміші, при 3350С
він самозаймається.
Ацетилен і пропін мають слабкі естерні запахи, що
зумовлює їх наркотичну і анестезуючу дію.
ХІМІЧНІ ВЛАСТИВОСТІ
Хімічна поведінка алкінів зумовлюється наявністю в
молекулах потрійного зв¢язку,
який за реакційною здатністю подібний до подвійного, але не перевершує його за
активністю. З цієї причини алкіни взаємодіють за місцем потрійного зв¢язку повільніше. Крім того,
p-електронна густина
потрійного зв¢язку
розміщена більш компактно, ніж в алкенах, тому менш доступна до дії реагентів.
І Реакції електрофільного приєднання АЕ
Реакції за цим типом проходять у дві стадії: спочатку
руйнується один p-зв¢язок і утворюються
похідні алкенів (як правило, транс-ізомери), а при розриві другого p-зв¢язку – похідні алканів.
1 Галогенування проходить повільніше, ніж у алкенів.
Подібно до олефінів ацетиленові вуглеводні знебарвлюють бромну воду (якісна
реакція на потрійний зв¢язок):
  -20оC H
H Br2 -20оC H
H Br2
  СНºСН + Br2 ------ à C=C ------à CHBr2-CHBr2. СНºСН + Br2 ------ à C=C ------à CHBr2-CHBr2.
CCl4
Br H
Ацетилен Транс-1,2-диброметан – 1,1,2,2-Тетрабром– етан
Аналогічно проходить і хлорування алкінів.
Зважаючи на те, що потрійний зв¢язок має меншу реакційну здатність
порівняно із подвійним, при обмеженій кількості галогену за певних умов стає
можливим селективне приєднання Hal2 саме до подвійного зв¢язку при одночасній
наявності в молекулі і потрійного зв¢язку, наприклад:
СНºС-СН=СН2 + Br2 ------à
CHºC-CHBr-CH2Br.
Бутен-1-ін-3 3,4-Дибромбутин-1
(вінілацетилен)
2 Гідрогалогенування. Галогеноводні приєднуються до алкінів за стадіями за
правилом Марковникова з утворенням спочатку моногалогенопохідних алкенів, а при
надлишку реагенту – гемінальних дигалогеналканів (в яких атоми галогену
сполучені з одним атомом карбону). Іноді для прискорювання взаємодії до
реакційної суміші додають каталізатори – HgCl2 чи CuCl2.
Особливо велике значення має гідрохлорування ацетилену з
утворенням вінілхлориду, при полімеризації якого добувають поліхлорвініл.
140-200оC
CHºCH + HCl -----------------à
CH2=CH-Cl.
Ацетилен CuCl2 Хлорвініл
Слід зазначити, що приєднання HBr до несиметричних
алкінів проходить за механізхмом АЕ відповідно до правила Марковникова, а за
наявності пероксидних сполук (Н2О2 та ін.) проходить за механізмом АR не за
правилом Марковникова, оскільки при цьому виявляється пероксидний ефект
Харраша:
CH3-CºCH + 2HBr -----------à CH3-CH2-CHBr2.
Пропін H2O2 1,1-Дибромпропан
3 Гідратація – реакція
Кучерова. Приєднання води до потрійного зв¢язку проходить за
правилом Марковникова при нагріванні (900С) за наявності солей ртуті (ІІ) і
сильних кислот. При цьому спочатку як проміжний продукт утворюється вініловий
спирт (чи його похідне), який піддається практично миттєвій ізомеризації.
Сполуки, в яких один і той самий атом карбону при
подвійному зв¢язку
одночасно сполучений з гідроксильною групою, називаються енолами (загальна
структура >C=CH-OH).
Ізомеризація енолів відбувається за правилом Ельтекова:
Еноли у момент утворення піддаються кетоенольному
перегрупуванню у карбонільні сполуки: первинні вінілові спирти ізомеризуються в
альдегіди, а вторинні – у кетони:
 O O
 R-CH=CH-OH ß–––––à
R-CH2-C R-CH=CH-OH ß–––––à
R-CH2-C
Енол Альдегід H
(первинний)
   R-C=CH2 ß––––à
R-C-CH3. R-C=CH2 ß––––à
R-C-CH3.
OH Енол О Кетон
(вторинний)
Реакції нуклеофільного приєднання
Термінальні ацетиленові вуглеводні, що містять потрійний зв’язок
у крайньому положенні, здатні виконувати роль нуклеофільної частинки в реакціях
з оксигенвмісними сполуками, тобто вступати у реакції нуклеофільного приєднання
AN. Така властивість зумовлюється підвищеною електронною густиною потрійного
зв’язку і помітною поляризацією зв’язку С-Н.
1 Етинілювання – взаємодія термінальних алкінів з карбонільними
сполуками (альдегідами і кетонами) за наявності ацетиленідів важких металів
(наприклад, CuC2) чи солей купруму(І) за умов: Т=90-120оС, Р=0,5мПа. Реакції
цього типу часто об’єднують однією назвою «синтези Реппе». Внаслідок них
утворюються α-ненасичені спирти, що містять у головному ланцюгу потрійний
зв¢язок у
α-положенні відносно гідроксильної групи. Причому у реакціях із
формальдегідом добувають первинні спирти, з іншими альдегідами – вторинні, а з
кетонами – третинні:
 O O
 R-CºCH + H-C –––––––à R-CºC-CH2-OH, R-CºCH + H-C –––––––à R-CºC-CH2-OH,
H Cu2Cl2
Алкін Метаналь Первинний спирт
 О О
  R-CºCH +
R¢-C –––––––à R-CºC-CH-R¢ , R-CºCH +
R¢-C –––––––à R-CºC-CH-R¢ ,
H Cu2Cl2 OH
Алкін Альдегід Вторинний спирт
 R’ R’
  R-CºCH +
R¢-C-R¢¢ ––––à
R-CºC-C-R¢¢. R-CºCH +
R¢-C-R¢¢ ––––à
R-CºC-C-R¢¢.
О Cu2Cl2 ОН
Алкін Кетон Третинний спирт
Реакції етинілювання проходять за механізмом нуклеофільного
приєднання АN, причому нуклеофілом виступає алкін,
оскільки саме він є атакуючою частинкою, тобто реагентом, а субстратом –
карбонільна сполука.
2 Вінілювання – реакції приєднання до потрійного зв¢язку певних реагентів,
які містять рухливий атом Н. Наприклад, при взаємодії із спиртами добувають
вінільні похідні, які на відміну від вінілового спирту (СН2=СН-ОН) не піддаються
кетоенольному перегрупуванню, оскільки не містять гідроксильної групи при
подвійному зв¢язку.
Реакція вінілювання із спиртами і фенолами проходить за механізмом АN на
твердому КОН під тиском.
Отже, до реакцій вінілювання належать такі процеси:
-взаємодія із спиртами:
 R-CºCH + R¢-OH à R-C=CH2. R-CºCH + R¢-OH à R-C=CH2.
OR¢
Алкін Спирт Простий етер
Наприклад, одержання бутилвінілового етеру, з якого при подальшій
полімеризації добувають полімер вінілін – бальзам Шостаковського (паста для загоювання
ран і опіків):
P
CHºCH + CH3-(CH2)2-CH2-OH
–––––––à CH2=CH-O-C4H9;
Ацетилен Бутанол-1 КОН(т) Бутилвініловий
етер
За допомогою окремої групи синтезів Реппе при каталізуючій
дії солей ртуті(ІІ) чи купруму(І) одержують ненасичені карбонові кислоти та їх
похідні (естери, нітрили тощо);
-взаємодія із карбоновими кислотами:
  O 170-200оC O O 170-200оC O
  CHºCH + CH3-C
–––––––––––à
CH3-C CHºCH + CH3-C
–––––––––––à
CH3-C
OH Cu2Cl2 O-CH=CH2
Оцтова кислота Вінілацетат
-взаємодія з синільною кислотою
80-90оC
CHºCH + HCN ––––––––––à CH2=CH-CN;
Cu2Cl2 Акрилонітрил
-взаємодія з синтез-газом (суміш СО і Н2)
– реакція карбонілювання, яку найчастіше застосовують
для одержання із ацетилену акролеїну і акрилової кислоти за схемою
 P O [O] P O [O]
 СHºCH + CO + H2 ––––––––à CH2=CH-C –––à CH2=C-COOH СHºCH + CO + H2 ––––––––à CH2=CH-C –––à CH2=C-COOH
[Ni(CO)4] Акролеїн H Акрилова кислота
Вінілацетат, акрилова кислота, акрилонітрил та їх похідні
використовуються як мономери при добуванні відповідних полімерних матеріалів.
КИСЛОТНІ ВЛАСТИВОСТІ
Термінальні алкіни здатні відщеплювати атом гідрогену при
потрійному зв¢язку
і виявляти слабкі кислотні властивості за рахунок помітної поляризації зв¢язку С-Н. Це зумовлюється,
по-перше, виникненням часткового негативного заряду на атомі карбону завдяки підвищеній
електронній густині потрійного зв¢язку, а по-друге – sp-гібридизованим
станом атома С, який збільшує його відносну електронегативність (порівняно із sp2- i sp3- гібридизованими атомами карбону).
Все це зумовлює можливість заміщення атома гідрогену при
потрійному зв¢язку
на метал при дії відповідних реагентів, наприклад:
CHºCH + 2NaNH2 ––––––––––à NaCºCNa¯ + 2NH3,
Амід натрію NH3(рідкий) Ацетиленід натрію
CHºCH + Cu2Cl2 ––à
CuCºCCu ¯
+ 2HCl,
NH4OH Ацетиленід купруму(І) (червоно-бурий
осад)
CHºCH + Ag2O –––––––––à
AgCºCAg ¯
+ H2O.
NH4OH Ацетиленід аргентуму(I) (білий
осад)
Реакції утворення алкінідів купруму(І) і аргентуму використовують для ідентифікації алкінів з потрійним
зв¢язком у крайньому
положенні.
Алкініди металів – це вибухонебезпечні
речовини. Їх можна вважати солями слабкої кислоти, оскільки вони дуже легко піддаються повному гідролізу з утворенням
алкіну і відповідної основи, наприклад:
NaCºCNa + 2H2O à
CHºCH + 2NaOH.
РЕАКЦІЇ ОЛІГОМЕРИЗАЦІЇ
Олігомеризація – це реакція сполучення
двох чи декількох молекул алкіну (мономеру), внаслідок чого утворюється ненасичений олігомер – продукт нормальної чи циклічної будови.
1Лінійна димеризація:
CHºCH + CHºCH
–––––––––à CH2=CH-CºCH
CuCl/NH4Cl Вінілацетилен
Внаслідок приєднання HCl до потрійного
зв¢язку вінілацетилену
одержують хлоропрен, при полімеризації якого добувають хлоропреновий
каучук.
2Циклічна тримеризація – реакція Зелінського-Казанського:
600оС
 3CHºCH ––––––––à . 3CHºCH ––––––––à .
Сакт. Бензен
Гомологи ацетилену за наявності металоорганічних сполук
хрому, нікелю і кобальту перетворюються у похідні бензену:
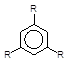
3 R-CºCH
–––––––à
Kat
3 Циклічна тетрамеризація
 60о, Р. 60о, Р.
4CHºCH
–––––––––à
Циклооктатетраєн-1,3,5,7
Реакції відновлення і окиснення
1. Відновлення алкінів (каталітичне гідрування) проходить
у дві стадії: спочатку утворюються алкени, а потім – алкани.
Алкіни гідруються значно повільніше, ніж алкени. Однак
якщо в реакційній суміші одночасно наявні різні види ненасичених вуглеводнів,
то спочатку піддаються гідруванню саме алкіни, оскільки вони легше і швидше
адсорбуються на поверхні каталізатора й не допускають до нього молекули
алкенів.
Залежно від природи каталізатора на першій стадії можуть
утворюватися різні просторові ізомери алкенів: при використанні паладієвого
каталізатора – цис-ізомери, а відновлення алкінів літієм чи натрієм у рідкому
амоніаку (Li + NH3 à
LiNH2 + H) приводить до транс-ізомерів.
2. Окиснення. Завдяки великій ненасиченості ацетиленові вуглеводні
легко піддаються окисненню: навіть дуже розведений водний розчин KMnO4 руйнує
потрійний зв¢язок.
При цьому утворюються a-дикетони,
якщо потрійний зв¢язок
знаходиться всередині ланцюга, чи a-кетонокислоти, якщо потрійний зв¢язок займає крайнє положення:
[O]
    R-CºC-R¢ ––––––––––––à R-C---C-R¢, R-CºC-R¢ ––––––––––––à R-C---C-R¢,
KМnO4(розв.);
Н2О О О
Алкін a-Дикетон
[O]
  R-CºCH––––––––––––––––––à R-C–COOH. R-CºCH––––––––––––––––––à R-C–COOH.
KМnO4(розв.);
Н2О О
a-Кетонокислота
Ацетилен у цьому випадку дає щавлеву кислоту:
 [O] О О [O] О О
НCºCН–––––––––––––––––à C---C
(чи
КООС-СООК).
KМnO4(розв.);
Н2О НО ОН
Етандіова
(щавлева) кислота
Сильні концентровані окисники призводять до повного
розщеплення потрійного зв¢язку
і утворення суміші карбонових кислот; якщо потрійний зв¢язок знаходиться у крайньому положенні,
то виділяється вуглекислий газ
[O]
R-CºC-R¢ ––––––––––––––à RCООН + R¢СООН,
Алкін KМnO4; Н2SО4 Суміш кислот
[O]
R-CºCН
–––––––––––––––à
R-CООН + СО2.
Алкін KМnO4; Н2SO4 Кислота
Ацетилен при пропусканні через підкислений розчин
перманганату калію піддається повному окисненню:
[O]
CНºCН–––––––––––––à
2CО2 .
KМnO4; Н2SO4
Повне окиснення спостерігається і при згорянні алкінів, яке супроводжується виділенням великої кількості теплоти. Наприклад, при спалюванні ацетилену досягається температура
35000С, що застосовується при зварюванні та різанні металів.
CnH2n-2 + (1,5n – 0,5) O2 à
nCO2 + (n – 1) H2O + Q.
C2H2 + 2,5 O2 à
2CO2 + H2O + 3200 кДж/моль.
РЕАКЦІЇ ІЗОМЕРИЗАЦІЇ
Під впливом різних каталізаторів потрійний зв¢язок може переходитися
із крайнього положення всередину ланцюга і навпаки, наприклад:
[Na]
R-CºC-СН3
––––––––à
R-CH2---CºCH.
ß––––––––
[C2H5ONa]
За наявності спеціальних каталізаторів
(KOH, 170oC) потрійний зв¢язок
ізомеризується у два подвійних:
kat
СН3-CН2-СºCН –––––––à CH2=CH–CH=CH2. Бутин-1 Бутадієн-1,3
ОДЕРЖАННЯ АЛКІНІВ
Найбільше промислове значення має ацетилен, його щорічне світове виробництво перебільшує 5 млн т. У зв¢язку із цим розроблені специфічні способи
добування С2Н2 та його гомологів.
1Гідроліз карбідів кальцію і магнію
дає ацетилен і
пропін відповідно:
СаС2 + 2Н2О à Ca(OH)2 + CHºCH,
Mg2C3 + 4H2O à
2Mg(OH)2 + CHºC-CH3.
2 Піроліз вуглеводнів
Ацетилен одержують при швидкому пропусканні (тривалість
реакції 0,01-0,1с) метану між електродами під час електричного розряду:
1500оC
2СН4 –––––––––––à CHºCH
+ H2
Ел. розряд
або через полум¢я пальника у суміші з киснем (окиснювальний піроліз).
tоC
4СН4 +2O2
–––––––à CHºCH + 6H2 + H2O + CO + CO2.
Іноді піролізу піддають етан чи етилен.
3 Елімінування дигалогенопохідних, в молекулах яких атоми галогенів містяться біля двох сусідніх
атомів карбону (віцинальні дигалогенпохідні) чи біля одного атома карбону (гемінальні
дигалогенопохідні) – при дії на них спиртовим розчином лугу:
CH2Cl-CH2Cl + 2KOH ––––––––à CHºCH + 2KCl + 2H2O,
1,2-Дихлоретан Спирт. р-н
CH3-CHCl2 + 2KOH ––––––––––à CHºCH + 2KCl + 2H2O.
1,1-Дихлоретан Спирт. р-н
При елімінуванні несиметричних галогенопохідних виконується
правило Зайцева:
CH3
–CH2-CCl2-CH3 + 2KOH ––––––à CH3-CºC-CH3 + 2KCl + 2H2O.
2,2-Дихлорбутан Спирт. р-н Бутин-2
4 Дегалогенування віцинальних тетрагалогенпохідних цинковим
пилом чи магнієм
CH3 –CBr2-CBr2-CH3 + 2Zn ––––à
CH3-CºC-CH3 + 2ZnBr2.
2,2,3,3-Тетрабромбутан Бутин-2
5 Із напівацетиленідів при їх взаємодії
з галогеналканами отримують алкіни з кінцевим потрійним зв¢язком:
HCºCNa + CH3(CH2)2Br à
CH3-CH2-CH2-CºCH + NaBr.
Цим самим способом можна одержувати алкіни, які містять
потрійний зв¢язок
усередині ланцюга:
CH3-CºCNa + CH3-Br à
CH3-CºC–СH3 + NaBr.
Пропінід натрію Бутин-2
ВИКОРИСТАННЯ АЛКІНІВ
Ацетилен використовується у великих кількостях для зварювання
і різання металів, оскільки при його згорянні виділяється
багато теплоти. Крім того, він є
вихідним продуктом для промислового виробництва численних сполук: ацетальдегіду, оцтової кислоти, етилену, хлороцтової та трихлороцтової
кислот, поліхлорвінілу, трихлоретилену, тетрахлоретану, гліцерину, полімерів і каучуків, розчинників, пластмас.
Із інших алкінів найважливішим є вінілацетилен – для одержання хлоропренового каучуку.
|