Реферат: Окисление парафиновых углеводородов
Реферат: Окисление парафиновых углеводородов
Окисление
парафиновых углеводородов
Ряд процессов
жидкофазного окисления углеводородов в настоящее время реализованы как крупнотоннажный
производства, например СЖК [2], высших жирных спиртов и др. [3].
Изучения жидкофазного
окисление насыщенных углеводородов оказалось весьма плодотворным для
установления общих закономерностей процесса окисления. На примере окисления
индивидуальных углеводородов и их смесей получены фундаментальные знания о
механизме радикальных реакций [3,4-7].
Некоторые особенности
процесса жидкофазного окисления парафиновых углеводородов.
Окисления парафиновых
углеводородов хорошо изученный процесс [7,8,10-12].
Известно, что окисление
парафиновых углеводородов молекулярным кислородом приводит к образованию
большого число промежуточных и конечных кислородсодержащих продуктов:
перекисей, спиртов, карбонильных соединений, кислот, эфиров, а также
бифункциональных соединений.
Найден ряд катализаторов
процесса окисления углеводородов, таких как, растворимые комплексы титана [9],
хлорид платины [14], комплексы ванадия (5V) [15], Pd, Pt, Co, Fe нанесенные на
носитель, например, на цеолита [16], система на основе Ti, Zr, V, Cr, Mo, W, Mn, Fe и имида [19],
система из растворимых соединений кобальта и хрома [21], мультиоксиды металлов
[23], алкилперокси- комплексы трехвалентного кобальта [25], смесь азотной
кислоты и уксусного ангидрида [26], комплексы марганца и органических кислот
содержащих ароматических фрагментов [29], комплексы металлов [30], SiO2 , AI2O3 , ZrO и
другие на носителе [31] комплексы металлов, содержащую имидную группировку
[32], система на основе Bi, V, Mo, Ag [33], Мn содержащий катализатор, нанесенный
на молекулярный сита [34]. Известны каталитические системы ведущие процесс
окислению углеводородов селективно [13,18,22,24,28].
К настоящему времени
считается доказанным, что в случае окисления предельных углеводородов
гидроперекиси единственные первичные промежуточные продукты.
Изучения строения
образующихся при окислении гидроперекисей показало, что строение
углеводородного радикала R в
гидроперекиси R'OOH сохраняется таким же, как и в исходном углеводороде RH [3].
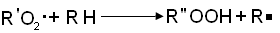
Образующиеся при
окислении радикалы R'02
взаимодействует с молекулой исходного углеводорода, отрывая атом водорода и
образуя гидроперекиси по реакции
При окислении
разветвленных парафинов с двумя третичными связями С - Н в большом количестве
были обнаружены дигидроперекиси. Окисление проводили при 115 — 120°С до глубины
5 -8 % (мол.) [3]. В начальный период окисления свободные радикалы образуются
при взаимодействии исходного углеводорода с растворенным в нем кислородом
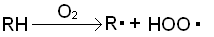
Радикал R* присоединят к себе молекулу
кислорода и превращается в перекисный радикал RO2•, который далее отрывает атом водорода от молекулы
углеводорода и образует гидроперекись и свободный радикал R•, продолжающий цепь. В
процессе окисления накапливается гидроперекись, молекулы который сравнительно
медленно распадаются на радикалы, например по реакции
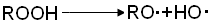
Это приводит к увеличению
скорости образования свободных радикалов. Процесс распада промежуточных
гидроперекисей на радикалы представляет собой реакцию вырожденного разветвления
цепей [3].
В целом механизм цепного
окисления углеводородов может быть представлен следующим образом [41]:
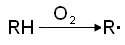






Имеющийся в настоящее
время экспериментальный материал подтверждает цепную схему окисления
углеводородов.
Чем выше скорость
образования свободных радикалов, тем выше их концентрация, тем чаще происходит
встреча и рекомбинация (или диспропорционирование) двух свободных радикалов и
тем короче цепь обрыв цепей может происходит при взаимодействии свободного
радикала со стенкой реактора (обрыв на стенке), а также по бимолекулярной реакции
между двумя свободными радикалами (квадратичный обрыв). В жидкой фазе диффузия
свободных радикалов у стенке весьма затруднена из - за высокой вязкости среды.
По этому в цепных жидкофазных реакциях осуществляется квадратичный обрыв цепей
по реакциям:



где: МП - молекулярные
продукты.
Эти реакции протекают с
малой энергией активации, в 4,1 - 8,4 кДж/моль.
Реакции между двумя
вторичными перекисными радикалами приводит к образованию спирта и кетона.
Происходящее в процессе
окисления превращение молекулы углеводорода последовательно в гидроперекись,
спирт и кетон сохраняет исходный углеводородный скелет молекулы.
В процессе окисление
кислоты декарбоксилируются сравнительно медленно, и их состав практически не
меняется в ходе окисления. Среди кислот, образующихся при окислении н- декана
обнаружены окси- и кетокислоты (15- 18% от общего число кислот). Однако эти
кислоты образуются не из жирных кислот, а параллельно с ними.
Скорость образования
уксусной кислоты составляет только 30% от скорости окисления кетона.
Следовательно, механизм разрыва а - С - С- связи в окисляющихся парафинах не
единственный, и по этому направлению образуются меньше половины низших кислот
при окислении парафинов.
При большой скорости
растворения кислорода его концентрация в окисляющемся веществе близка к насыщению;
процесс протекает в кинетической области, т.е. не зависит от скорости
растворения и диффузии кислорода в жидкой фазе. При очень быстром окислении
диффузия кислорода в жидкость может оказаться лимитирующий стадией процесса
окисления. В этом случае реакция будет протекать в диффузионной области.
Поэтому, при изучении закономерности реакции окисления протекает в кинетической
области [3].
Так как для подавляющего
большинство органических соединений, окисляющихся в жидкой фазе, энергия
разрыва связи С - Н меньше 377 кДж/моль, то в жидкой фазе зарождение цепей
должно происходить преимущественно по тримолекулярной реакции, что доказано
Е.Т. Денисовым [7].
Перекисные радикалы в
среде окисляющегося углеводорода могут не только взаимодействовать с
компонентами реагирующей смеси (например, с исходным углеводородом), образуя
гидроперекиси, но и подвергаться распаду с образованием стабильного продукта и
нового свободного радикала, как это наблюдается при окислении углеводородов в
газовой фазе[3].
Н.С.Ениколопяном
показано, что в сложных цепных реакциях, протекающих с образованием ряда
стабильных промежуточных продуктов, длина цепи может меняться по ходу реакции,
что в свою очередь приведет к изменению скорости реакции, остановка окисления
углеводородов задолго до полного расходования исходных веществ, постоянная
скорость протекания реакции до очень больших глубин превращения (наблюдаемая
для метана, бензола и др.) , несовпадение порядка реакции, определённого по
ходу процесса, с определённым по начальной концентрации исходного углеводорода,
автокатализ промежуточными и конечными продуктами, катализирующее и
ингибирующее действие одних и тех же веществ в различных реакциях могут
получить удовлетворительное объяснение в рамках представлений о том, что если в
результате реакции стабильных промежуточных продуктов реакции с радикалом
образуется радикал, более активный, чем исходный, то имеет место удлинение
цепи. В противном случае по мере накопления стабильных промежуточных продуктов
длина цепи уменьшается [39] .
В условиях окисления
гидроперекиси могут расходоваться не только при взаимодействии со свободными
радикалами и по реакции разветвления, обычно протекающей медленно, но и другими
путями, которые для общности называют не цепным расходованием. В некоторых
реакциях окисления такой не цепной путь распада оказывается доминирующим. Так,
при окислении альдегидов образующаяся над кислота реагирует с исходным
альдегидом с образованием кислоты.
В присутствии кислот
гидроперекиси подвергаются гетеролитическому расщеплению, что приводит к
автоторможению в реакции окисления.
Работами Н.М.Эмануэля [3]
показано, что ряд реакций окисления углеводородов прекращаются задолго до
полного израсходования исходного вещества.
Вопросы автоторможения
реакций окисления подробно изучены Е.Т.Денисовым [40]. Было показано, что в
начальный период окисление углеводорода осуществляется за счет взаимодействия RH с перекисными радикалами:

И скорость реакции
определяется концентрацией перекисных радикалов. По мере накопления продуктов
окисления - гидроперекисей, спиртов, кетонов, кислот - перекисные радикалы
вступают в реакцию взаимодействия с этими продуктами.
При цепном распаде вторичной
гидроперекиси радикал R02•
заменяется на свободный гидроксил: Реакция RO2• со спиртом приводит к образованию оксигидроперекисного
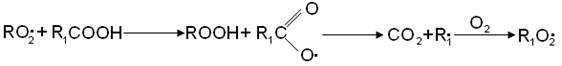
радикала: Реакция с кислотами приводит к выделению СО2 и другому R1O2• радикалу:
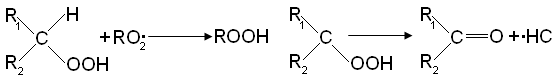
Реакция RO2• со спиртом приводит к образованию
оксигидроперекисного радикала:
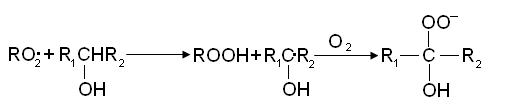
Реакции с кислотами
приводит к выделению СО2 и другому R1O2• радикалу:
В развившейся реакции
исходный углеводород может взаимодействовать с различными свободными
радикалами, и скорость его окисления зависит не только от общей концентрации
радикалов, но и от их состава. В реальных процессах окисления скорость реакции
по ходу изменяется не только в зависимости от скорости вырожденного
разветвления цепей , но и в зависимости от состава радикалов.
Специальными
исследованиями и кинетическими расчетами было установлена [38], что в сложных цепных
реакциях, протекающих с образованием молекулярных промежуточных продуктов,
состав радикалов неизбежно меняется в ходе реакции вследствие изменения состава
продуктов. Изменяющийся состав радикалов воздействует не только на суммарную
активность радикалов, но и на их общую концентрацию путем изменения скорости
квадратного обрыва цепей. Таким образом, механизм воздействия состава радикалов
на скорость сложной цепной реакции таков, что ускорения реакции всегда
ограничено, а её замедления может быть сколь угодно сильным. Это обстоятельство
и является фундаментальной причиной широко распространенного явления
самоторможения реакций окисления.
Продукты распада радикала
R02 были обнаружены при
жидкофазном окислении н. бутана, изопропилбензола и циклогексана в
металлических реакторах.
Интересным представляется
наблюдение [3]. О том, что в металлических реакторах продукты, образующейся с
разрывом углеродного скелета в случае окисления бутана, составляют около 10-12%
от прореагировавшего бутана, тогда как при окислении н. декане было обнаружено
ни карбонильных соединений, ни спиртов, содержащих в своей молекуле меньшее
число атомов углерода, чем исходный декан.
Это на первый взгляд
кажется удивительным, поскольку оба углеводорода принадлежат к одному и тому же
классу- к парафинам нормального строения. В действительности никакого различия
механизмом окисления н. декана и н. бутана не существует, а наблюдаемое расхождение
в составе продуктов этих реакций объясняется, влиянием нержавеющей стали на
распад радикала R-2 при проведении процесса в
металлических реакторах.
Под влиянием металла
происходит также уменьшения периода индукции и увеличение суммарной скорости
окисления, определяемой по скорости расходования бутана. При этом скорости
накопления продуктов распада увеличиваются в несколько раз больше, чем скорости
накопления продуктов гидроперекисного направления. Ускорение реакции связано,
по-видимому, с увеличением скорости разветвления цепи за счет увеличения
скорости распада гидроперекиси под действием металлической поверхности.
Реакция распада радикала RO2• предшествует его изомеризация с переходом свободной
валентности от атома кислорода к одному из соседних атомов в радикале.
Изомеризация перекисного радикала происходит наиболее легко в случае, когда в
третичные атомы углерода находятся в β - положении относительно друг -
друга.
При этом если свободная
валентность, переходить к атому углерода, то вслед за изомеризацией радикала
происходит разрыв связи С-С. Состав продуктов окисления сжиженного бутана при
температуре 145°С и давлении 50 атм. В реакторе из нержавеющей стали отличается
от состава продуктов окисления н. бутана в стеклянном реакторе. Наряду с
соединениями, образующимися из гидроперекиси (метил этил кетон, вторичный
бутиловый спирт, уксусная кислота), обнаруживается существенным количества
веществ, содержащих меньшее число атомов углерода, чем исходный бутан
(ацетальдегид, ацетон, метиловый и этиловый спирт и другие). Показано, что эти
соединения не является продуктами дальнейшего превращения гидроперекиси, так
как при термическом разложении гидроперекиси в атмосфере азота в тех же
условиях, в которых проводится процесс окисления бутана, образуются только
бутиловый спирт и метил этил кетон.
Если изомеризация
радикала 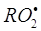 сопровождается
переходом свободной валентности к атому водорода, а не к углеводородному атому,
то распад радикала происходит с разрывом связи С – Н . так как в этом случае
углеродный скелет не разрушается, то образуются продукты, практически
неотличимы от соединений, получающихся в результате превращений гидроперекиси. сопровождается
переходом свободной валентности к атому водорода, а не к углеводородному атому,
то распад радикала происходит с разрывом связи С – Н . так как в этом случае
углеродный скелет не разрушается, то образуются продукты, практически
неотличимы от соединений, получающихся в результате превращений гидроперекиси.
В реакциях окисления
углеводородов гидроперекиси очень часто главные, но не единственные первичные
молекулярные продукты окисления. Во многих случаях параллельно с
гидроперекисями образуются циклические и полимерные перекиси, окиси и другие
продукты окисления.
Таким образом, из
литературы известно, что металлы, контактирующие с окисляющимся углеводородом
не всегда инертны к процессу окисления.
Катализ процесса
окисления солями металлов переменной валентности.
При окислении
углеводородов в качестве катализаторов обычно применяют органические соли
кобальта, марганца, железа, меди, хрома, свинца, никеля. Перманганат калия,
например, служит катализатором окисления парафина кислородом воздуха в
производстве жирных кислот [2]. Катализаторы позволяют, проводит окисления при
более низкой температуре, т.е. в более мягких условиях и таким образом
уменьшают количество нежелательных продуктов глубокого окисления [3].
В реакциях окисления
углеводородов механизм соленого катализа очень сложный. Ускоряя реакцию
окисления, катализатор испытывает обратное воздействие продуктов окисления, что
приводит к протеканию процесса в несколько последовательных стадиях.
Каталитические действие
соединений металлов переменной валентности указывает на цепной характер
окисления.
Изучение особенностей
жидкофазного окисления углеводородов инициированного солями металлов,
проведенное В.Г.Фрейдиным [80],показало, что период индукции при использовании
двухвалентных металлов (Мn) значительно
длиннее, чем при применении трехвалентных (Сr); период индукции увеличивается (в изученных пределах) с
повышением содержания двухвалентного металла; спектры поглощения образующихся в
индукционном периоде соединений металлов в высшем валентном состоянии
соответствуют спектрами поглощения известных комплексных органических солей
этих металлов; анализ стеарата кобальта, изменившегося и индукционном периоде
окисления керосина; дает возможность приписать ему строение частично
гидролизованного многоядерного комплексного соединения, присутствие спиртов
ускоряет переход металлов в высшее валентное состояние [85]. Известно, что в
зависимости от валентного состояния, ионы металлов переменной валентности могут
присоединять или отдавать один электрон какой-либо валентно насыщенной
молекуле. Это неизбежно приводит к образованию свободных радикалов, ускоряющих
цепной процесс окисления.


Ион трех валентного
металла в среде реакционной массы образует многоядерный катион:

Реакция с участием
многоядерного катиона ускоряют реакцию и приводят к образованию продуктов
окисления:


где: Ас- -
анион кислоты (продукта окисления).
Таким образом, в начале
процесса окисления с участием двухвалентных ионов металлов переменной
валентности замедление реакции объясняется обязательной последовательностью
процессов:
первичного инициирования,
необходимая продолжительность которого увеличивается в результате большой
потребности в первичных продуктов окисления (гидроперекисей), участвующих в
образовании комплекса;
реакции
образования комплекса;
процесса разрушения
комплекса с образованием ионов и радикалов осколков комплекса, инициирующих
развитую реакцию [31].
Было показано [4], что
под действием кислорода эполеты металлов разлагаются, образуя две молекулы
кислоты. Для практического использования катализатора большое значение имеет
вопрос о стабильности жирных кислот в условиях технологического режима
окисления. Тем не менее роль катализатора в процессе окисления
высокомолекулярных жирных кислот выяснена недостаточно. Была изучена
окисляемость фракций синтетических жирных кислот Сю -Ci3 и Си - С20. при переменном температурном режиме и в
присутствии 0,2% КМпОд кислоты Сю - Сю окисляются незначительно, а кислоты Сю -
Сго с большими скоростями. Кислотное число водорастворимых кислот по мере
протекания каталитического окисления непрерывно повышается. Это свидетельствует
о том, что кислоты обогащаются низкомолекулярными веществами. Наиболее
эффективно процесс окисления ускоряется некоторой оптимальной концентрацией Мn, ровной -0,1%. Избыток КМnО4 по сравнению с
оптимальной концентрацией или увеличение доли щелочного металла в составе
катализатора приводят к разному уменьшению скорости процесса, в то время как
один марганец влияет на скорость окисления гораздо слабее, чем в смеси с
калием. Таким образом, основные ингибирующие функции в данном случае
принадлежат, по-видимому, соединением щелочного металла [3].
Воздействие катализатора
на реакцию окисления проявляется тем отчетливее, чем ниже температура
окисления. При невысокой температуре катализированной окисления намного быстрее
некатализированного. С повышением температуры различие в скоростях уменьшается.
Это связано с тем, что предостаточно высокой температуре цепной процесс
окисления способен к быстрому развитию в отсутствие катализатора, а солей
катализатора выпадает в осадок на сравнительно неглубоких стадиях процесса
вследствие накопления кислот и почти не участвует в реакции [4].
В промышленном
производстве синтетических жирных кислот окисляют смесь (1:2) исходного парафина
с возвратным, т.е. полученным после отделения продуктов реакции. Необходимая
условия нормального протекания процесса присутствие катализатора. Обычно
используют окиси марганца, содержащие щелочь или перманганат калия в количестве
0,08-0,1% от веса загрузки, считая на марганец. Реакция проходит при переменном
температурном режиме 125-105°С. Постепенное снижение температуры по мере
накопления продуктов окисления предотвращает обогащение жирных кислот побочными
веществами, уменьшает концентрацию полифункциональных соединений окси кислот и
т.п. Опытным путем было установлена, что окисление при более высокой постоянной
температуре (125°С), хотя и значительно сокращает время реакции, но
отрицательно сказывается на качестве синтетических жирных кислот. Процесс
окисления прерывается при достижении кислотного число 70 [1].
Практическое
осуществление окисления парафинов связано с использованием в этой реакции
перманганата калия в качестве катализатора. Изучение непосредственного взаимодействия
КМnO4 и MnO2 с парафином
затрудняется тем, что эти катализаторы на начальных стадиях реакции находятся в
гетерогенном состоянии.
Экспериментальное
изучения поведения KMnO4 и MnO2 в среде расплавленного парафина показало, что ни то,
ни другое соединение без кислорода не взаимодействует с углеводородами [3].
Это свидетельствует о
том, что реакция взаимодействий Мn+2 с радикалами RO2• конкурирует с реакцией продолжения цепи таким
образом, что при уменьшении концентрации углеводорода до определенного значения
наблюдается полное прекращение процесса окисления.
Введение солей калия
стабилизирует марганцовый катализатор и предотвращает выпадение осадка. Более
того, добавление стеарата калия к осадку соединений марганца вызывает
растворение последнего. Одновременно с этим изменяется и кинетика окисления,
увеличивается скорость образования свободных кислот, снижается содержание
карбонильных соединений в оксидате [32].
В результате анализа
литературы видно, что процессы окисления углеводородов проводятся с участием
солей металлов переменной валентности, которые улучшает условия образования
кислот.
Литературы
1.Каримов И.А., Мировой финансово – экономический кризис,
пути и меры его преодолению в условиях Узбекистана / И.А.Каримов Т.: 2009.- 56
с.
2. Регламент производство синтетических жирных кислот /
Волгаградский НПЗ. Волгоград, 1982 – 120с.
3. Эммануэль Н.И. Цепные реакции окисления углеводородов в
жидкой фазе / Н.И. Эммануэль – М.: Наука, 1965 – 362 с.
4. Юкельсон И.И., Технология основного органического синтеза
/ И.И. Юкельсон. М.: Химия, 1968. – 672 с.
5.Эвери Г. Основы кинетики и механизма химической ркакций/
Г.Эвери; пер.с анг. В.В.Смирного – М.: Мир 1978 – 216 с.
6. Денисов Е.Т. Химическая кинетика / О.М. Саркисов, Г.И.
Лихтенштейн . – М.: Химия 2000 – 568с.
7. Шипаева Т.А. Синтез и изучение свойств многофункциональных
добавок на основе хлорпарафинов: дис.канд.хим.наук/ Шипаева Татьяна
Александроовна. – Волгоград – 1998.-120 с.
8. Теоритическое изучение механизма окисления углеводородров
молекуляном кислородом / Е.В. Николаева, А.Г. Шамов, Г.М. Хропковский и др.//
Нефтехимия – 99; тез. докл V конф. по
интенсификации нефтехимических процессов – Нижнекамск – 1999. – с. 103- 105.
9.Общая органическая химия : в 8 т. Т.1 / Д.Бартон, У.Д.
Оллис; пер. с англ. С.В. Яроцкого; под ред. Н.К.Когеткова, А.И. Усова – М.:
Химия 1982 – 856 с.
10. Oxidation of alkanes b TBHR in the presence of soluble
titanum complexes / Fujewata Mashario, Xu Qiang, Souma Yoshie etc.//
J.Hol.Catal. – 1999, - №1- P.77-84.
11. Meunier B.S.Oxidation catalysis: Pap. first
international conference on porphyrins and phthalocyanines (ICPP-1)/ B.S.
Meunier// Porphyrins and phthalocyanines -2000. -№4-P. 353
12. Пат.
6037507 США, МПК С 07 С 29/50. Oxidation process of branched
aliphatic hydrocarbons and process for producing the oxide / Nakano Tatsuya,
Isliii Yasutalca; заявитель и патентообладатель Daicel Chemical Ind.
-№09/037703; заявл. 10.03.98; опубл. 14.03.00. ~3с.
13. Selective oxidation of n-butane on a
V-P-O-catalyst: Improvement of the catalytic performance under fuel- rich
condition by doping / S.Mota, J.C.Volla, G.Vorbeck. etc. //J.Chem. Soc- 2000.-
№2.-P.319-329.
14. Catalytic Shilov chemistri: Plaiimnn chloride-
catalyzed oxidation of terminal mctihyl groups by dioxigen /Lin Minren, Slien
Chengyu, Garsia- Zayas Eduardo A. etc. // J. Amer.Chem, Soc.-2001. -№5. –P.
1000 -100L.
15. Laszio, J. Csanyl. Investigation of the catalytic
behavior of ion-pair complexes of vanadium (5+) in the liquid- phase oxidation
of hydrocarbons with molecular Oi / Csanyl Laszio J.Jaky Katoly, Galkaes Gabor
// J.Mol. Catal. -2000, -№1-2. –P. 109-124.
16. Артемов, А.В. Новые высокоэффективные катализаторы
жидкофазных окислительных процесс >> / А.В. Артемов // Катализ и
промышленност. -2000.-№2.–С.18-23.
17. Заявка 19924533 Германия, МПК С 07С 57/07. Verfagen zur Marstcllung von Acrykaurc / Sclnfider Jiirdc, Ncstlcr Gerhard, Miiller- Enge J Klaus Joachim; заявитель и патентообладатель BASF AG.- №19924533.9; заявл. 28. 05. 99; Опубл. 30,11 02.-2с.
18. Заявка 19941315 Германия, МПК С 07 С 407/00. Selective oxidation von
kohlenwasscretoffen / Langer Rein hard, Fengler Gerd; заявитель и иатентообладатель BASF AG.- №19941315.0, заявл. 31.08.99; опубл.
01.03.01. -3с.
19. Пат. 5981420 США, МПК В 01 J 31/00. Oxidation catalytic system and oxidation process / Nakano T. Isitt Y; заявитель и потентообладатель Daicel Chemical Ind. Ltd.; Yasutaka Isitt.-№09/024514; заявл. 17.02.98; опубл. 09.11.99.-с.
20. Заявка 19823088 Германия, МПК С 07 С 51/21. Verfahren zur HcistcUung Von Sauren / Riidinger Ch, Eberle H,-J., Bogner R., Kohlmarm W.; заявитель Consortium fur elektrocliemische Industrie GmbH.-№19823088.5; заявл. 22.05.98; опубл. 25.11.99.-4c.
21. Заявка 981066/04 Россия, МТЖ С07 В 41/08. Способ
окисления углеводородов, спиртов и /или кетонов / Константины Мишель, Фаш Эрик,
Родья Фибер Э.; заявитель Резон Эяермедиа, -№98106628/04; заявл. 09.04.98;
опубл. 27.01.00.-6c.
22. Пат. 5914013 США, МПК С 07 В 33/00. Selective Thermal and fotooxidatkm of hydrocarbons in zeolites by oxygen / Frei Hein?., Blatter Fritz, Sun Hai; заявитель и
патентообладатель. The Regents of the University of Colifomia.-№08/874,679; заявл. 13.06.97; опубл, 22.06.98.-fic.
23. Заявка 19746667 Германия, МПК С 07 С57/05. Verfahren den heterogen
katalysierten Gasphascnoxidation von Propan zu Acrolein nnd/ odcr Acriylsaure /
Jachow II , Tsnten A, Univerricht S, Arnold A; заявитель BASF AG.-№19746667.2, заявл. 23.01.99.-7c.
24. Kiyoshi, Otsuka. Селективное окисление с участием оксидов
азота/ Otsuka Kiyoshi, Yamanaka
Ichiro Shokubai // Catalysis and Catalysis,-1999,-№8. –P.606-612.
25. Farinas, E.T. Pliotoinduced oxidation of
hydrocarbons with cobalt (111)- alkylperoxy completes / E.T. Farinas, C.V.
Nguyen, F.K. Mascherak // Inorg. Chin. Actc. -1997.-Vol.263, 1-2,P. 17-21.
26. Светланов, КВ, Окисление алканов до карбоновых кислот /
Н.В, Светланов, Е.А Николаева //Научная сессия : аннотац. сообщ./
1СГТУ.-Казань, 2003.-с.34.
27. Пат, 6340420 США, МГЖ В 01 D 61/44. Methods of treating the oxidation mixture of hydrocarbons to respective dibasic acids / Dassel Mark W, Vassiliou Euslathics; заявитель и патентообладатель
№09/3458S0; заявл. 30.06.99; опубл. 22.01
т.-Лс.
28. Шт. 6515146 США, МШС С 07 D 307/60, C 07 C 51/16. Process for catalytic selective
oxidation of hydrocarbon substrate / Perrcgaard Jens Santamaria Jesus, Menendes
Miguel etc; заявитель и патентообладатель Mai dor Topsoe A/S,
University of Zaraoza, Du Pout Iberia S.A.-fe 09/654299; заявл. 01.09.00", опубл. 04.02.03.-бс.
29. Заявка
282S194 Франция, МПК С 07 С 51/13, Procede d'oxydation
d'hydrocarbures en acides / Bonnet Didicr, Fache Brie, Simotiato Jean Pierre; заявитель P.Jiodia Polyamide Intermediates
SAS.-N 0110427; заявл. 03.08.01; опубл. 07.02.03.-4с.
30. Shulpin, G.B. Melall- catalysed hydrocarbon
oxygenations in solution: The dramatic role of additives: A review / G.B.
Shulpin // J.Mol Calal.A, -2002,-№1.-P.39-66.
31. Заявка 10201241 Германия, МПК В 01 J 31/02. Katalysator / Weisbeck Markus,
Mcincii Maric- Therese, Schmirt Jurg etc.; заявитель Bayer AG. -№ 10201241.5; заявл. 15.01.02; опубл. 24.07.D3.-6c.
32. Заявка 2824322 Франция, МГЖ С 07 С 037/00. Precede d'oxydation
d'hydrocarbures / Fache Eric, Simonato Jean Prierre (RHODIA SERVICES ); зритель RHODIA POLYAMIDE INTERMEDIATES SAS.-
№0106016; заявл. 04.05.01; опубл. 08.11.02.-6с.
33. Заявка 200110090/04 Россия, МПК С 07 С 51/43. Способ
выделения и очистки карбоновой кислоты, образующиеся при реакции прямого
окисления углеводородов / Константин и Мишель, Фаш Эрик, Маремм Шильбстр;
заявитель Родиа Полиамид Интермедиа. – № 200110090/04; заявл.14.04. 99, опубл.
20.01.03.- 4 с.
34. Заявка 19622331 Германия, МПК С 07 С 47/22. Verfahren der Heterogen
katalisierten Gaspasenoxidation von Propan zu Acrolein / Tenten A., Proll Th.,
Schildberg M.-P.; заявитель BASF AG. -№ 19622331.8; заявл. 04.06.96; опубл. 11.12.97.- 4 с.
35. Пат. 5536875 США, МПК С 07 С 51/16. Enhanced oxidation of
organic chemicals / Roby Anne K., Kingsley Jeffrey P.; заявитель и пантенто- обладатель Praxair Technology Inc.; заявл. 22.05.95; опубл.
16.07.96.- 3с.
36. Заявка
2732678 Франция, МКИ С 07 С 55/14, С 07 С 51/215. Procede d’oxydation d’hydrocarbures, d’alcogols ou
de cetones par catalyse heterogene / Custantini M., Fashe E., Gilbert L.; заявитель Rhone-Paulene Chimie. - №9504428; заявл. 07.04.95; опубл. 11.10.96. – 3 с.
|