Реферат: Классификация химических реакций
Реферат: Классификация химических реакций
Содержание
Введение
1. Общее понятие о химической реакции
2. Классификация химических реакций
Заключение
Список используемой литературы
Введение
Самое интересное в окружающем мире состоит в том, что
он постоянно изменяется.
Понятие «химическая
реакция» - второе главное понятие химии. Каждую секунду
в мире происходит неисчислимое множество реакций, в результате которых одни
вещества превращаются в другие. Некоторые реакции мы можем наблюдать
непосредственно, например ржавление железных предметов, свертывание крови,
сгорание автомобильного топлива.
В то же время, подавляющее большинство реакций
остаются невидимыми, но именно они определяют свойства окружающего нас мира.
Для того, чтобы осознать свое место в мире и научиться
им управлять, человек должен глубоко понять природу этих реакций и те законы,
которым они подчиняются. Задача современной химии состоит в изучении функций
веществ в сложных химических и биологических системах, анализе связи структуры
вещества с его функциями и синтезе веществ с заданными функциями.
Итак, химических реакций протекающих вокруг человека
очень много, они протекают постоянно. Что же необходимо сделать, чтобы не
запутаться во всём многообразии химических реакций? Научиться их
классифицировать и выявлять существенные признаки классов.
Цель данной работы: рассмотреть понятие «химическая
реакция» и систематизировать и обобщить знания о классификации химических
реакций.
Работа состоит из введения, двух глав,
заключения и списка литературы. Общий объем работы 14 страниц.
1. Общее
понятие о химической реакции
Химическая реакция - это
превращение одних веществ в другие. Однако, такое определение нуждается в
существенном дополнении.
Так, например, в ядерном
реакторе или в ускорителе тоже одни вещества превращаются в другие, но такие
превращения химическими не называют. В чем же здесь дело? В ядерном реакторе
происходят ядерные реакции. Они заключаются в том, что ядра элементов при
столкновении с частицами высокой энергии (ими могут быть нейтроны, протоны и
ядра иных элементов) - разбиваются на осколки, представляющие собой ядра других
элементов. Возможно и слияние ядер между собой. Эти новые ядра затем получают
электроны из окружающей среды и, таким образом, завершается образование двух
или нескольких новых веществ. Все эти вещества являются какими-либо элементами
Периодической системы. В отличие от ядерных реакций, в химических реакциях не
затрагиваются ядра атомов. Все изменения происходят только во внешних
электронных оболочках. Разрываются одни химические связи и образуются другие.
Таким образом, химическими
реакциями называются явления, при которых одни вещества, обладающие
определенным составом и свойствами, превращаются в другие вещества - с другим
составом и другими свойствами. При этом в составе атомных ядер изменений не
происходит.
Выделим признаки и
условия химических реакций (рис.1, 2).
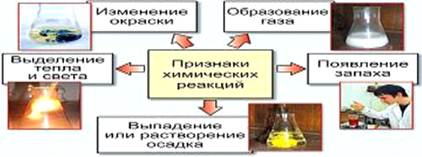
Рисунок 1 – Признаки
химических реакций
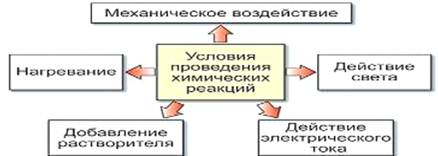
Рисунок 2 – Условия
проведения химических реакций
Рассмотрим типичную
химическую реакцию: сгорание природного газа (метана) в кислороде воздуха
(данную реакцию можно наблюдать дома, у кого есть газовая плита) на рисунке 3.
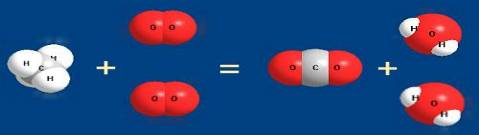
Рисунок 3 - Сгорание
природного газа (метана) в кислороде воздуха
Метан СН4 и
кислород О2 реагируют между собой с образованием диоксида углерода
СО2 и воды Н2О. При этом разрываются связи между атомами
С и Н в молекуле метана и между атомами кислорода в молекуле О2. На
их месте возникают новые связи между атомами С и О, Н и О.
На рисунке 3 хорошо
видно, что для успешного осуществления реакции на одну молекулу метана
надо взять две молекулы кислорода. Однако записывать химическую реакцию
с помощью рисунков молекул не слишком удобно, поэтому для записи химических
реакций используют сокращенные формулы веществ - такая запись называется уравнением
химической реакции.
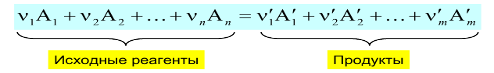
Рисунок 4 – Уравнение
реакции
Уравнение химической
реакции показанной на рисунке 3 выглядит следующим образом
CH4 +2O2
= CO2 + 2H2O
Количество атомов разных
элементов в левой и правой частях уравнения одинаково. В левой части один
атом углерода в составе молекулы метана (СН4), и в правой - тот
же атом углерода мы находим в составе молекулы СО2. все
четыре водородных атома из левой части уравнения мы обязательно найдем и в
правой - в составе молекул воды.
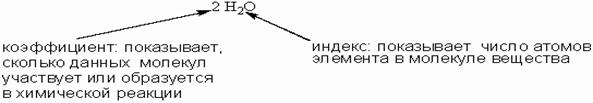
В уравнении химической
реакции для выравнивания количества одинаковых атомов в разных частях уравнения
используются коэффициенты, которые записываются перед формулами
веществ.
Рассмотрим другую реакцию
- превращение оксида кальция СаО (негашеной извести) в гидроксид кальция Са(ОН)2
(гашеную известь) под действием воды (рис.5).
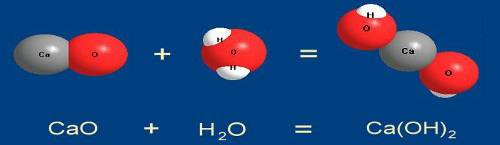
Рисунок 5 - Оксид кальция
СаО присоединяет молекулу воды Н2О
с образованием гидроксида
кальция Са(ОН)2
В отличие от
математических уравнений, в уравнениях химических реакций нельзя переставлять
левую и правую части. Вещества в левой части уравнения химической реакции
называются реагентами, а в правой - продуктами реакции.
Если сделать перестановку
левой и правой части в уравнении из рисунка 5, то получим уравнение совсем
другой химической реакции
Ca(OH)2 =
CaO + H2O
Если реакция между СаО и
Н2О (рис. 4) начинается самопроизвольно и идет с выделением большого
количества теплоты, то для проведения последней реакции, где реагентом служит
Са(ОН)2, требуется сильное нагревание. Добавим также, что реагентами
и продуктами могут быть не обязательно молекулы, но и атомы - если в реакции
участвует какой-нибудь элемент или элементы в чистом виде, например
H2 + CuO =
Cu + H2O
Таким образом, мы подошли
к классификации химических реакций, которую рассмотрим в следующей главе.
2. Классификация химических реакций
В процессе изучения химии
приходится встречаться с классификациями химических реакций по различным
признакам (табл.1).
Таблица 1 - Классификация
химических реакций
|
По
тепловому эффекту
|
Экзотермические – протекают с выделением энергии
4Р + 5О2 = 2Р2О5
+ Q; CH4 + 2О2 → СО2 +
2H2O + Q
|
|
Эндотермические – протекают с поглощением энергии
Cu(OH)2  CuO + H2O –
Q; C8H18 CuO + H2O –
Q; C8H18  C8H16
+ H2 – Q C8H16
+ H2 – Q
|
|
По
числу и составу исходных и
образовавшихся веществ
|
Реакции разложения – из одного сложного вещества
образуется несколько более простых:
СаСО3 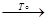 СаО + СО2
C2H5OH → C2H4 + H2O СаО + СО2
C2H5OH → C2H4 + H2O
|
|
Реакции соединения – из нескольких простых или
сложных веществ образуется одно сложное: 2H2 + О2 → 2H2O C2H4 + H2 → C2H6
|
|
Реакции замещения – атомы простого вещества замещают
атомы одного из элементов в сложном веществе:
Zn + 2HCl
= ZnCl2 + H2↑ CH4 + Cl2 → CH3Cl + HCl
|
|
Реакции обмена – два сложных вещества
обмениваются составными частями: AgNO3 + HCl = AgCl↓ + HNO3
HCOOH + CH3OH → HCOOCH3 + H2O
|
|
По
агрегатному состоянию реагирующих
веществ
|
Гетерогенные – исходные вещества и продукты
реакции находятся в разных агрегатных состояниях:
Fe(т) + CuCl2(р-р) → Cu(т) + FeCl2(р-р)
2Na(т) + 2C2H5OH(ж) → 2C2H5ONa(р-р) + H2(г) ↑
|
|
Гомогенные – исходные вещества и продукты
реакции находятся в одном агрегатном состоянии: H2(г) + Cl2(г) = 2HCl(г)
C2H5OH(ж) + CH3COOH(ж) → CH3COOC2H5(ж) + H2O(ж)
|
|
По
наличию катализатора
|
Каталитические 2H2O2 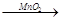 2H2O + О2↑ C2H4 + H2 2H2O + О2↑ C2H4 + H2 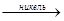 C2H4 C2H4
|
|
Некаталитические S + О2 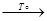 SO2 C2H2 + 2Cl2 → C2H2 Cl4 SO2 C2H2 + 2Cl2 → C2H2 Cl4
|
|
По
направлению
|
Необратимые – протекают в данных условиях
только в одном направлении: H2SO4 + BaCl2 → BaSO4+ 2HCl
CH4 + 2О2 → СО2 +
2H2O
|
|
Обратимые – протекают в данных условиях
одновременно в двух противоположных направлениях:
3H2 + N2 ↔ 2NH3
; C2H4 + H2 ↔ C2H6
|
|
По
изменению степени окисления атомов
элементов
|
Окислительно-восстановительные – реакции, идущие с изменением
степени окисления: Fe0 + 2H+1Cl-1 → Fe2+Cl2-1 + H20
H+1C0O-2 H+1 + H2 → C-2 H3+1 O-2 H+1
|
|
Неокислительно-восстановительные – реакции, идущие без изменения
степени окисления: S+4O4-2 + H2O → H2+ S+4O4-2
CH3NH2 + HCl →
(CH3NH3)Cl
|
Как видим, существует различные
способы классификации химических реакций, из которых более подробно мы
рассмотрим следующие.
По признаку изменения
числа исходных и конечных веществ. Здесь можно найти 4 типа химических
реакций (рис.6): реакции соединения, реакции разложения, реакции обмена,
реакции замещения.
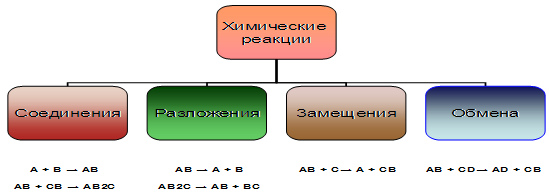
Рисунок 6 – Классификация
химических реакций по признаку изменения числа исходных и конечных веществ
Приведем примеры таких
реакций. Для этого воспользуемся уравнением получения гашеной извести и
уравнению получения негашеной извести
СаО + Н2О =
Са(ОН)2
Са(ОН)2 =
СаО + Н2О
Эти реакции относятся к
разным типам химических реакций.
Первая реакция является
типичной реакцией соединения, поскольку при ее протекании две молекулы
реагентов СаО и Н2О соединяются в одну, более сложную молекулу
Са(ОН)2.
Вторая реакция Са(ОН)2
= СаО + Н2О является типичной реакцией разложения: здесь
реагент Ca(OH)2 разлагается с образованием двух других, более
простых веществ (продуктов реакции).
В реакциях обмена
количество реагентов и продуктов обычно одинаково. В таких реакциях исходные
вещества обмениваются между собой атомами и даже целыми составными частями
своих молекул. Например, при сливании раствора CaBr2 с раствором HF
выпадает осадок. Происходит реакция, в которой ионы кальция и водорода
обмениваются между собой ионами брома и фтора
CaBr2 + 2HF
= CaF2¯ + 2HBr
При сливании растворов
CaCl2 и Na2CO3 тоже выпадает осадок, потому
что ионы кальция и натрия обмениваются между собой частицами CO32-
и Cl–
CaCl2 + Na2CO3
= CaCO3¯ + 2NaCl
Стрелка рядом с продуктом
реакции показывает, что это соединение нерастворимо и выпадает в осадок. Таким
образом, стрелку можно использовать и для обозначения удаления какого-нибудь продукта
из химической реакции в виде осадка (¯ ) или газа ( ), например:
Zn + 2HCl = H2 +
ZnCl2
Последняя реакция
относится к еще одному типу химических реакций - реакциям замещения.
Цинк заместил водород в его соединении с хлором - в HCl. Водород при этом
выделяется в виде газа.
Реакции замещения внешне
могут быть похожи на реакции обмена. Отличие заключается в том, что в реакциях
замещения обязательно участвуют атомы какого-нибудь простого вещества,
которые замещают атомы одного из элементов в сложном веществе, например
2NaBr + Cl2
= 2NaCl + Br2 – это реакция замещения;
в левой части уравнения
есть простое вещество-молекула хлора Cl2, и в правой части есть
простое вещество – молекула брома Br2.
В реакциях обмена
- и реагенты и продукты являются сложными веществами, например
CaCl2 + Na2CO3
= CaCO3¯ + 2NaCl – это реакция обмена;
в этом уравнении реагенты
и продукты - сложные вещества.
Деление всех химических
реакций на реакции соединения, разложения, замещения и обмена - не
единственное.
Рассмотрим способ
классификации по признаку изменения (или отсутствия изменения) степеней
окисления у реагентов и продуктов. По этому признаку все реакции делятся на
окислительно-восстановительные реакции и все прочие (т.е. не
окислительно-восстановительные).

Рисунок 7 – Реакции с
изменением степени окисления элементов
Так, рассмотренная выше реакция
между Zn и HCl является не только реакцией замещения, но и окислительно-восстановительной
реакцией, потому что в ней изменяются степени окисления реагирующих веществ
Zn0
+ 2H+1Cl = H20 + Zn+2Cl2
это реакция замещения и
одновременно окислительно-восстановительная реакция.
Окислительно-восстановительными
являются также:
- реакции метана с
кислородом (рис. 1):
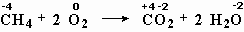
меняют степень окисления
углерод и кислород;
- реакция оксида меди с
водородом:
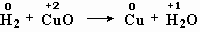
меняют степень окисления
водород и медь;
- реакция бромида натрия
с хлором:
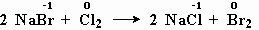
меняют степень окисления
бром и хлор.
Важно также
отметить, что по разным признакам одна и та же реакция может быть отнесена
одновременно к нескольким типам, например
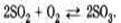
- эта реакция
относится к реакциям: соединения, экзотермическим, окислительно-восстановительным,
каталитическим и обратимым.
К
окислительно-восстановительным в неорганической химии относятся все реакции
замещения и те реакции разложения и соединения, в которых участвует хотя бы
одно простое вещество.
В более
обобщенном варианте (уже с учетом и органической химии): все реакции с участием
простых веществ, и наоборот, к реакциям, идущим без изменения степеней
окисления элементов, образующих реагенты и продукты реакции, относятся все
реакции обмена.
К
окислительно-восстановительным относятся подавляющее большинство химических
реакций, они играют исключительно важную роль.
Классификация
окислительно-восстановительных реакций
Межмолекулярные
(окислитель и восстановитель - разные вещества):
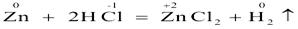
Внутримолекулярные
(окислитель и восстановитель входят в состав одного и того же вещества):
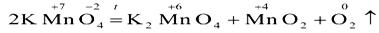
Диспропорционирование
[дисмутация] (степень окисления одного и того же элемента и повышается и
понижается):
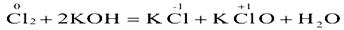
Контрпропорционирование
[конмутация] (взаимодействие окислителя и восстановителя, в состав которых
входит один и тот же элемент в разных степенях окисления):
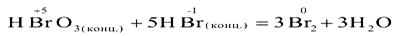
Продуктом
является вещество с элементом в промежуточной степени окисления.
Таким образом,
мы узнали, что такое химическая реакция, выявили признаки химических реакций,
сформировали представления о причинах и условия протекания химических реакций и
систематизировали и обобщили представление о классификации химических реакций.
Заключение
Завершая
работу, кратко отметим следующее.
Вещества,
взаимодействуя друг с другом, подвергаются различным изменениям и превращениям.
Химическая
реакция — это превращение
одного или нескольких исходных веществ (реагентов) в отличающиеся от них по
химическому составу или строению вещества (продукты реакции).
В отличие от
ядерных реакций, при химических реакциях ядра атомов не меняются, в частности
не изменяется их общее число, изотопный состав химических элементов, при этом
происходит перераспределение электронов и ядер и образуются новые химические
вещества.
Химические реакции могут
сопровождаться выделением тепла, испусканием света, изменением агрегатного
состояния веществ, появлением запаха, образованием газа и т.п.
Для описания химических
реакций используют химические уравнения, в левой части которых
указывают исходные вещества, в правой - продукты.
Обе части уравнения
соединены знаком равенства (в этом случае кол-во атомов хим. элементов справа и
слева должно быть уравнено с помощью стехиометрического коэффициента, стрелкой
(в случае необратимых хим. превращений) или прямой и обратной стрелками (для
обратимых реакций).
Химические реакции
могут осуществляться
как один элементарный акт (стадия) (простые реакции) или через
последовательность отдельных стадий (сложные реакции), составляющих
в совокупности механизм реакции.
Существуют
различные системы классификации химических реакций.
Наиболее
широко используют следующую классификацию:
а) по числу и
составу исходных веществ и продуктов, которые подразделяют на:
- реакции соединения - реакции, при
которых из двух или нескольких веществ образуется одно новое вещество:
- реакции разложения - реакции, в
результате которых из одного вещества образуется несколько новых веществ:
- реакции замещения - реакции, в
результате которых атомы простого вещества замещают в молекулах других веществ:
- реакции обмена - реакции, в
результате которых два вещества обмениваются атомами или группировками атомов,
образуя два новых вещества:
б) выделение
или поглощение теплоты: подразделяются на экзотермические и эндотермические.
Выделение или поглощение энергии может быть обозначено в уравнении реакции
соответственно знаком +Q или -Q.
Реакции
разложения обычно протекают с поглощением энергии, а присоединения — с
выделением энергии.
в) изменение
степени окисления химических элементов: реакции, в результате которых некоторые
элементы, входящие в состав исходных веществ и продуктов, меняют свои степени
окисления.
г) наличие
или отсутствие катализатора. Реакции, идущие с участием катализаторов,
называются каталитическими. Не все реакции нуждаются в катализаторах, но многие
без катализаторов практически идти не могут.
д)
обратимость реакций: делят на обратимые и необратимые.
-
реакции,
протекающие в двух противоположных направлениях, называются обратимыми,
-
реакции, протекающие
только в одном направлении - необратимыми.
Признаками
необратимости реакций в растворах является образование малодиссоциирующего
вещества (осадка, газа или воды).
Кроме того, одна
и та же реакция по разным признакам может быть отнесена одновременно к
нескольким типам.
Список используемой литературы
1.
Габриелян О.С.
Химия. 11 класс: Учебник для общеобразовательных учреждений / О.С.Габриелян. -
М.: Дрофа.- 304 с.
2.
Иванова Р.Г.
Химия. Учебник для 10 кл. общеобразовательных учреждений / Р.Г.Иванова,
А.А.Каверина. – М.: Просвещение, 2001. – 287 с.
3.
Кузнецова Н.Е.
Химия. Учебник. 8 класс / Н.Е.Кузнецова, И.М.Титова, Н.Н.Гара,
А.Ю.Жегин М.: Вентана-Граф, 2005. – 224 с.
4.
Мануйлов А.В. Основы
химии. Электронный учебник / А.В.Мануйлов, В.И.Родионов. [Электронный ресурс].
Режим доступа: http://www.hemi.nsu.ru/
5.
Химия. 8-9 класс:
Поурочные планы / Авт. сост. С.Ю.Дибленко, Е.А.Смирнова, С.М.Колмыкова. –
Волгоград: Учитель, 2005. – 169 с.
|