Реферат: Электродные процессы в разбавленных хромсодержащих растворах и пути повышения эффективности электрохимической очистки
Реферат: Электродные процессы в разбавленных хромсодержащих растворах и пути повышения эффективности электрохимической очистки
На правах рукописи
ШИШОВА
Марина Александровна
ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ В РАЗБАВЛЕННЫХ
ХРОМСОДЕРЖАЩИХ РАСТВОРАХ И ПУТИ ПОВЫШЕНИЯ
ЭФФЕКТИВНОСТИ ЭЛЕКТРОХИМИЧЕСКОЙ ОЧИСТКИ
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата технических наук
2005
Общая характеристика работы
Актуальность проблемы.
Гальваническое производство является одним из самых
водопотребляемых. Его сточные и промывные воды содержат ценные и токсичные
соединения тяжелых металлов: Сr (VI), Ш, Си и др. Уменьшение
расхода воды, извлечение из нее ценных материалов, снижение токсичности
являются важнейшими задачами, направленными на повышение экономичности и
экологичности производства. При решении данных задач большое внимание уделяется
выбору эффективного способа удаления загрязняющих компонентов из промывной и
сточной воды. Выбор способа очистки зависит от состава и режима поступления
промывных и сточных вод, концентрации загрязнений, возможности повторного
использования очищенной воды. Среди различных способов очистки загрязненных вод
освоение и внедрение электрохимических технологий является в настоящее время
прогрессивным направлением, позволяющим не только очистить воду и вернуть ее в
технологический цикл, но и утилизировать твердые отходы. Качество очистки
зависит от выбора электродных пар и режима электролиза. При этом основное
внимание уделяется материалу катода и процессам, протекающим на нем. Влияние
материала анода и скорости анодных процессов на степень удаления загрязняющих
компонентов не было принято во внимание при оптимизации технологических
параметров электрохимической очистки. Поэтому комплексное изучение катодных и
анодных процессов является актуальным в научном и в прикладном планах.
Диссертация выполнена в рамках плановых научных исследований
кафедры "Технология электрохимических производств" в соответствии с
планом важнейших НИР СГТУ по основному научному направлению "Разработка
теоретических основ электрохимических технологий и материалов для химических
источников тока" (№ государственной регистрации 01200205598).
Цель работы состояла в обосновании выбора материала анода,
катода и соответствующих им технологических параметров электрохимического
способа очистки хромсодержащих промывных вод, обеспечивающих оптимизацию
процесса.
Для достижения поставленной цели необходимо было решить
следующие задачи:
изучить кинетику анодного поведения металлов и графитовых
материалов в слабокислых окислительных средах, выявить области потенциалов (и
соответствующие им плотности тока поляризации), обеспечивающие работу
электродных материалов как нерастворимых анодов;
установить оптимальные технологические параметры анодного
растворения железного электрода применительно к электрокоагуляционной очистке;
изучить катодное восстановление Сr (VI)
из разбавленных растворов на графитовых и металлических электродах;
разработать технологические рекомендации для
электрохимического способа очистки хромсодержащих промывных вод с
нерастворимыми анодами, обеспечивающего требования по ПДК (Сг (VI)) в очищенной
воде.
Научная новизна работы.
Впервые показано значение адсорбционных процессов на границе
раздела электрод (металлический, графитовый) - разбавленный хромсодержащий
электролит, моделирующий сточные и промывные воды гальванических производств
для обоснования выбора электродных материалов. Установлено, что пленка,
пассивирующая поверхности, как катода, так и анода, содержит в своем составе
соединения хрома, оксидные формы металлов. Рассчитаны величины адсорбции
реагентов и образующихся продуктов реакции в процессе электровосстановления и
электроокисления на различных электродных материалах в разбавленных
хромсодержащих электролитах. Показано, что кислород, выделяющийся на аноде,
влияет на скорость катодных реакций и соответственно на качество
электрохимической очистки.
Практическая значимость результатов работы. Разработаны
технологические рекомендации по оптимальному режиму использования стальных
электродов в электрокоагуляционной очистке хромсодержащих промывных и сточных
вод гальванических производств. Предложены электродные материалы и
технологические параметры (плотность тока, расстояние между электродами,
температура раствора) для электрохимического удаления Сг (VI) из промывных вод
путем электролиза с нерастворимыми анодами. Результаты работы апробированы на
ОАО "Электроисточник", г. Саратов.
Апробация результатов работы. Основные результаты
диссертационной работы доложены на III Всероссийской конференции молодых ученых
(Саратов, 2001г), Международной конференции "Композит-2001" (Саратов,
2001 г), Всероссийской конференции СЭХТ-2002 (Саратов, 2002 г), Всероссийской
научно-практической конференции (Пенза, 2004 г), III Международной
научно-технической конференции "Экология 2004 - море и человек" (Таганрог,
2004 г).
Публикации. По теме диссертации опубликовано 8 работ, из них
2 статьи в центральной печати, 5 в реферируемых сборниках научных трудов и 1
депонирована в ВИНИТИ.
Структура и объем работы. Диссертация состоит из введения, 5
глав, выводов, списка используемой литературы из 196 наименований и приложений.
На защиту выносятся следующие основные положения:
1. Кинетические закономерности поведения анодных и катодных
материалов в разбавленных хромсодержащих модельных электролитах.
2. Обоснование выбора электродных материалов, используемых в
электрохимической очистке в хромсодержащих промывных водах.
3. Разработка технологических параметров процесса
электрохимической очистки с растворимыми и нерастворимыми анодами в
разбавленных хромсодержащих растворах.
Основное содержание работы
Во введении дано обоснование актуальности темы, рассмотрены
цель и задачи исследования, научная новизна и практическая значимость работы.
Глава 1. Литературный обзор
Проанализированы литературные данные по кинетике и механизму
анодного растворения металлов в различных средах. Рассмотрены механизмы
образования пассивных пленок на электродных материалах и их влияние на скорость
анодного процесса. Установлено, что, несмотря на большой интерес к проблеме
анодного растворения металлов, данные по анодному поведению материалов в
разбавленных слабокислых окислительных растворах отсутствуют. Исходя из
актуальности проблемы повышения экологичности и экономичности производства дана
сравнительная характеристика различных способов удаления ионов Сг (VI) из
промывных и сточных вод. Показана перспективность использования
электрохимических способов. Сделан вывод о целесообразности изучения анодных процессов
в разбавленных хромсодержащих электролитах, с целью повышения качества
электрохимической очистки загрязненных вод.
Глава 2. Методика эксперимента.
Объектами исследования явились электроды из стали (08кп),
алюминиевого сплава АМ-6, титана (В), свинца (СО), графитовой фольги "Графлекс"
ТУ 5728-00117172478-97 и спектрального графита, модельные электролиты,
содержащие 3,4Т и промывные воды гальванических производств ОАО "Электроисточник",
г. Саратов, завода им. Урицкого, г. Энгельс. Растворы готовились на основе
дистиллированной воды и реактивов марки "х. ч. ". Электрохимические
исследования проводили на потенциостате П-5848 с помощью методов
вольтамперометрии, хроноамперометрии, хронопотенциометрии. Потенциалы
регистрировали относительно 1н хлорсеребряного электрода сравнения. рН
модельных хромсодержащих растворов определяли с помощью милливольтметра рН-150М
Измерение рН приэлекгродного слоя (pH) проводилось с помощью микросурьмяного
электрода (МСЭ). Состав пассивной пленки, полученной в процессе электролиза на
различных электродных материалах, определяли методом вторично-ионной
масс-спектрометрии (ВИМС). Состояние поверхности оценивалось с помощью
микроскопа CAPS ZELSS JENA (IP-20) при увеличении в 500 раз. Воспроизводимость
полученных экспериментальных результатов оценивалась с помощью критерия Кохрена.
Электролиз в разбавленных хромсодержащих электролитах проводился при
использовании в качестве катода - графитового материала, стали 08кп, в качестве
растворимого анода - стали (08), нерастворимого анода - свинца, титана,
графитовых материалов, при плотности тока iK=iA=2 А/дм2, температуре процесса (20±5)
°С, расстояния между электродами не более 5 см. Объем электролита на единицу
поверхности составил 0,4 л/дм2.
Глава 3. Результаты эксперимента анодное поведение
электродных материалов в разбавленных электролитах, содержащих сг (vi).
3.1 Потенциометрическое исследование поведения электродных материалов
в разбавленных водных растворах к2сг207.
Потенциал, возникающий на электроде в момент его погружения
в исследуемый хромсодержащий электролит, зависит от концентрации Сг (VI) и
материала электрода. В наиболее концентрированном растворе бихромата калия (3,4'10"3М)
на металлических электродах в первую секунду устанавливается отрицательный потенциал:
на Fe - (-0,3В), на РЬ - (-0,51В), на Ti - (-0,28 В). С разбавлением
электролита потенциал электродов меняется различно. Так, на свинцовом электроде
потенциал погружения становится более положительным (в 0,017-10"3М ЕР = - 0,377
В), на титановом электроде - смещается в сторону более отрицательных значений (в
0, О17КГМ Ел = - 0,545 В). Изменение потенциала погружения с разбавлением
раствора может быть следствием протекания нескольких процессов: уменьшения
адсорбции СГ2О72", увеличения взаимодействия молекул воды с поверхностью
электрода и снижения подтравливания электрода, т.к рН растворов с разбавлением
электролита возрастает с 4,73 (3,4-10"3М) до 6,16 (0,017-10%). Следует
учитывать, что адсорбция ионов на отрицательно заряженных в водных растворах
поверхностях металлов происходит путем ориентации положительно заряженного иона
Сг6+ к поверхности электрода. При этом усиливается отрицательный заряд. В этом
также может состоять причина более отрицательного электродного потенциала на изучаемых
металлических электродах в более концентрированных растворах.
Стационарное значение потенциала на исследуемых электродных
материалах вследствие конкурирующей адсорбции бихроматионов, молекул воды и
воздействия рН среды устанавливается в течение 1,5-5 минут (рис.1). Наиболее
быстро этот процесс протекает на углеродных материалах, что может быть связано
с высокоразвитой поверхностью материала, обладающей хорошими адсорбционными свойствами.
При этом кислородсодержащий анион хрома ориентирован таким образом, что катион
хрома обращен в сторону раствора. Подтверждением адсорбционных процессов на
границе графитовый электрод-электролит является то, что в присутствии К2Сr207 электрод приобретает более положительное значение
потенциала, по сравнению с водой, имеющей рН, равный рН модельного электролита
К2Сг207-
Изменение стационарного потенциала от логарифма концентрации
(lgC) (для изучаемого диапазона концентраций К2Сг207) подчиняется линейному
закону: E=A+BlgC к2Сг2о7, где константы А и В определяются материалом электрода.
Так, для титанового электрода А = 0,04В, В = 0,11В; для электрода, выполненного
из фольги "Графлекс", А = 0,62В, В = 0,07В.
3.2 Потенциодинамическое (ПД) исследование анодного
поведения исследуемых электродов в разбавленных растворах бихромата калия.
От потенциала начала поляризации (-0,5 В отн. х. сэ. с) вплоть
до потенциалов интенсивного выделения кислорода скорости анодных процессов
невелики (рис.2 - 4). Поведение металлических электродов индивидуально: зависит
от скорости развертки потенциала, концентрации электролита, температуры
раствора. При малых значениях анодного потенциала молекулы воды взаимодействуют
с поверхностью металла аналогично гидратации и стимулируют растворение металла.
Некоторая часть молекул воды диссоциирует в ходе адсорбции, и ионы кислорода,
порвав связь с протонами, прочно блокируют самые активные центры поверхности. Тормозящее
действие на растворение металла оказывают и кислородсодержащие ионы хрома,
способные адсорбироваться на поверхности электрода Пленка, пассивирующая
поверхность электродного материала, может являться продуктом нескольких
процессов, протекающих на поверхности. Так, на стальном электроде, по мере
смещения потенциала в область положительных значений, растворение железа
протекает с образованием ионов Fe2+, его оксидных и гидроксидных форм (до потенциалов
0,6 Вотн), сопровождается образованием гидратированных ионов Fe: FeOH*2/Fe (OH)
2 (в области потенциалов до 1,1 В) и оксидов Fe042", которые
взаимодействуют с анионами Сr (VI) с образованием
малорастворимых соединений. Рост анодного тока в области потенциалов более 1,2
В обусловлен не только выделением кислорода, но и растворением металла,
происходящим через образованный пассивирующий слой. Пассивирующее влияние
кислородсодержащих ионов Сr (VI) уменьшается с разбавлением
раствора, соответственно, возрастает плотность тока. Однако, начиная с
концентрации 0,34-10"3 М удаление образующихся оксидных соединений железа
с поверхности электрода затрудняется за счет уменьшения их растворимости при
повышении рН до 5,25 и более.
Анализ ПД кривых анодного поведения железа позволил выявить
области электродных потенциалов и соответствующие им плотности тока, для
которых растворение железа сопровождается образованием Fe (П) и протекает с
достаточно высокой скоростью. Эта область представляет интерес для
электрокоагуляционной очистки. Ей соответствуют плотности тока от 3,0 до 20
А/дм2 и концентрация загрязняющего компонента, не превышающая 0,85-10"3 М.
Анодное растворение свинцового электрода сопровождается
образованием ионов РЬ, взаимодействующих с кислородом и Сг2072"-ионами. При
потенциалах более 1,45 В наблюдается интенсивное выделение кислорода на свинце,
что приводит к окислению РЬ2+ до РЬ4+ с образованием РЬ02 (Е ~ 1,9 - 2,0 В). Скорость
анодного растворения алюминия увеличивается при росте потенциала, температуры,
концентрации К2Сr207. Пассивация титана обусловлена
образованием его оксидных соединений, на поверхности электрода,
взаимодействующих с бихроматионами и молекулами воды.
Известно, что пассивирующий оксид ТЮ2, образующийся в
диапазоне потенциалов от - ОД до +1,3 В, является беспористым. Однако
присутствие в электролите бихромат-ионов приводит к нарушению оксидного слоя. Рост
тока при потенциалах более 1,4 В вызван экспериментально наблюдаемым
интенсивным выделением кислорода и дальнейшим растворением титана через
пассивирующую пленку с образованием оксидов высшей валентности за счет диффузии
атомов металла в твердой фазе (рис.3). Скорость анодных процессов в области
потенциалов от 0 до 1,0 В возрастает в ряду Ti - Fe - фольга "Графлекс"
- спектральный графит и составляет 0,23 - 0,3 - 0,34 - 0,38 мА/см2,
соответственно. Помимо окисления металлов и поверхностных слоев графитовых
материалов происходят окислительно-восстановительные процессы в хромихроматной
пленке, присутствующей на поверхности электрода. Так, бихромат-ионы,
адсорбированные на поверхности графитового материала, способны частично
восстанавливаться до Сг (III):
ЗС + 2Сг2О72+10Н+4Сг3+ + ЗСОз2 + 5Н2О (1)
При смещении потенциала в область положительных значений происходит
окисление Сг3+ до Сг6+, что проявляется в появлении максимума плотности тока
или перегиба на i, Е - кривых. Скорость данного процесса зависит от p,
концентрации раствора (рис.3,4). Были проведены потенциодинамические измерения
на изучаемых электродных материалах в промывной воде, взятой из первой ванны
непроточной промывки после процесса хромирования, содержащей помимо ионов Сг (VI)
(472 мг/л) ионы S042" (рН = 2,5). Установлено, что скорость анодных
реакций на металлических электродах возрастает примерно в 4 раза. При
соизмеримых концентрациях Сг (VI) в промывной воде и модельных электролитах это
увеличение скорости процесса может быть объяснено влиянием рН раствора на
растворение пассивирующей пленки, образующейся на поверхности металлических
электродов. На графитовых электродах изменение скорости анодного процесса
незначительно. Вероятно, скорость адсорбционных процессов и соответствующая ей
пассивация поверхности графитового электрода мало зависят от рН среды. Наибольший
интерес из рассмотренных материалов представляют: титан, свинец, фольга "Графлекс",
на которых снижены скорости анодных процессов. Указанные электроды были
использованы для потенциостатического, гальваностатического исследования, для
проведения электролиза в разбавленных хромсодержащих растворах с целью удаления
из них Cr (VI).
3.3 Исследование кинетики анодного поведения титанового,
стального и графитового электродов в разбавленном растворе К2Сг207.
Потенциостатические исследования кинетики анодных процессов
на титановом, стальном и на электроде, выполненном из фольги "Графлекс",
были проведены при потенциалах, предшествующих потенциалам преимущественного
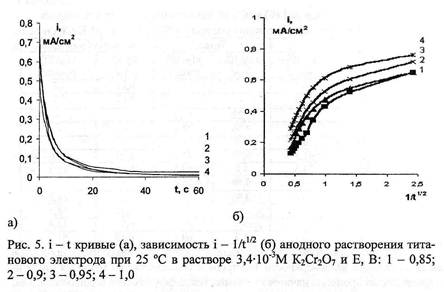
выделения кислорода (рис.5).
Характер i - 1 - кривых позволяет проанализировать начальные
участки спада тока в координатах i - 1/V7, с целью выяснения лимитирующей
стадии процесса. То, что в начальный момент поляризации (1 - 1,5 с) зависимости
i - 1/V7 не идут в начало координат, свидетельствует о протекании на границе
раздела фаз электрод - раствор К2Сг207 гетерогенной химической реакции. Такой
реакцией может быть конкурирующая адсорбция бихромат-ионов, молекул воды и
продуктов взаимодействия бихромат-ионов с поверхностью электрода. На
поверхности стального электрода в области потенциалов от 0,2 В до 0,75 В
возможно протекание реакций, связанных с переходом железа в оксидное и
гидроксидное состояния.
Оксиды и гидроксиды железа (П) взаимодействуют с
адсорбированными бихромат-ионами, происходит восстановление Сг (VI) до Сг (III)
с потреблением образующихся в реакциях, о чем свидетельствует подщелачивание
приэлектродного слоя при изменении потенциалов стального электрода от 0,1 до
1,0 В (pH составляет 5,5-7,1).
На титановом электроде в интервале потенциалов от 0,9 до
1,55 В (до потенциалов выделения кислорода) возможно протекание двух процессов:
образование кислородных соединений титана (IV), а также
окислительно-восстановительные реакции, происходящие в хроми-хроматной
адсорбированной пленке. Исходя из представлений об адсорбции перечисленных частиц
на поверхности электрода, был произведен расчет величины адсорбции (ПГ) по
уравнению;
Величина адсорбции (пГ) растет с увеличением электродного
потенциала. Максимально наблюдаемые величины ПГЕ на стальном и титановом
электродах в области потенциалов от 0,65 до 1,2 В могут быть связаны с большей
гидрофильностью указанных электродных материалов по сравнению с фольгой "Графлекс".
Данные результаты указывают на значительное участие молекул воды в анодных
процессах на поверхностях исследуемых электродов.
С увеличением времени поляризации происходит накопление
продуктов анодных реакций на поверхности электрода и соответственно меняется
лимитирующая стадия процесса: начинают сказываться диффузионные ограничения. Так,
анализ потенциостатических кривых в координатах i~t (рис.5, б) на отрезке
времени от 1 до 5 с показал, что на титановом и стальном электродах наблюдается
замедленность стадии твердофазной диффузии. Согласно представлениям, развиваемым
в работах Алексеева, Колотыркина, Попова, анодное растворение металлов
протекает за счет диффузии ионов металлов и диффузии ионов кислорода в
пассивной пленке, образованной на поверхности электрода Преобладание одного из
механизмов диффузии зависит от свойств и состава образующейся пленки. Учитывая,
что раствор К2Сг207 разбавлен, и в начальный момент поляризации (1,5 - 5 с) Сг
(Ш) присутствует в адсорбционной пленке в малых количествах, можно
предположить, что диффузионные процессы связаны с переносом ионов титана в
твердой фазе, о чем свидетельствует расчетная величина ZCQ^D, лежащая в
пределах (8 - 17) - 10с. При электродном потенциале более (1,2 - 1,55) В (для
различных электродных материалов) происходит преимущественное выделение
кислорода, сопровождающееся повышением кислотности приэлектродного слоя. Одновременно
усиливается окисление поверхности анода. Электрод, выполненный из фольги "Графлекс",
обладает меньшей гидрофильностью, чем исследуемые металлические электроды,
поэтому диффузионные ограничения скорости анодных процессов на графите в первую
очередь связаны с окислительно-восстановительными реакциями, протекающими между
анионами Сг (VT) и кислородными соединениями Сг (Ш), адсорбированными на
поверхности электрода. Замедленный отвод продуктов реакций приводит к
уменьшению количества бихроматионов, способных адсорбироваться на электродах. В
результате снижается скорость процесса.
Анализ начальных участков гальваностатических кривых
позволил рассчитать величину поляризационной емкости (Спол) анодного процесса
на различных электродных материалах согласно уравнению.
Величина С лежит в пределах от 0,3 до 2,7 мФ/см2 и зависит
от концентрации электролита, материала анода, плотности поляризующего тока и
связана с изменением адсорбции на поверхности электрода под действием указанных
факторов. Уменьшение плотности поляризующего тока приводит к снижению поляризационной
емкости, что может служить косвенным подтверждением электрохимического
механизма адсорбционных процессов на границе раздела фаз.
3.4 Влияние природы раствора и плотности тока на состояние
поверхности изучаемых анодных материалов.
Изучение анодного поведения исследуемых материалов показало
наличие на их поверхности пассивирующих пленок, которые были проанализированы с
помощью микроструктурного анализа и методом вторично-ионной масс-спектрометрии
(ВИМС). Согласно полученным микрофотографиям, состояние пассивирующей пленки
зависит от материала электрода, плотности тока поляризации, концентрации
электролита и наличия в электролите посторонних анионов (промывная вода,
содержащая ионы).
Методом ВИМС показано наличие в составе поверхностной
пассивирующей пленки соединений хрома различной валентности и оксидов металлов.
Наибольшее содержание соединений хрома сосредоточено на поверхности электрода. По
мере продвижения в глубь пленки количество соединений хрома уменьшается и к
толщине пленки примерно 0,5 мкм достигает постоянного значения. При анодной
поляризации электрода в промывной воде в пассивной пленке, образующейся на
поверхности, наблюдается увеличение количества хрома по мере продвижения в глубь
пленки. Это может быть связано с разрыхлением пассивного слоя за счет высокой
растворяющей способности кислого электролита, которым является промывная вода.
Глава 4. Катодное поведение металлов и графита в
разбавленных Cr-содержащих растворах.
Повышение эффективности электрохимического способа очистки
промывных и сточных вод от ионов Сг (VI) предусматривает изучение как анодных,
так и катодных процессов в разбавленных хромсодержащих электролитах.Т. к. электровосстановление
Сг (VI) на графитовом материале протекает легко, то его использование в
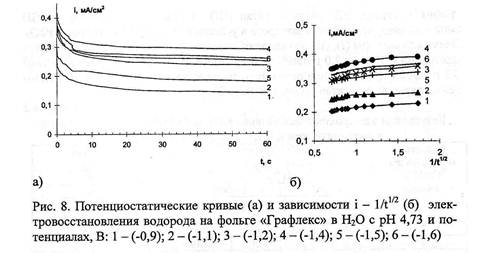
качестве катода наиболее целесообразно. Изучались кинетические закономерности
электровосстановления Сг (VI) на фольге "Графлекс" в разбавленных
растворах К - Характер i, t - кривых парциального выделения водорода и
электровосстановления Сг (VI) позволил проанализировать начальные участки потенциостатических
кривых в координатах i - 1/л и сделать предположение о протекании химической
реакции. Применительно к электровосстановлению водорода и анионов хрома это
может быть адсорбция соответствующих ионов. В соответствии с уравнением (8) был
произведен расчет величин адсорбции реагентов (ПГЕ). Адсорбция ионов водорода и
атомарного водорода на поверхности графитового катода зависит от электродного
потенциала и лежит в пределах (1,0 - 10,6) - 10"8 г-экв/см2. При наиболее
отрицательном потенциале наблюдается тенденция к уменьшению, что, вероятно,
связано с проникновением разрядившихся ионов водорода в глубь материала,
насыщением поверхностных слоев, и как, следствие, уменьшением (ПГЕ) и скорости
процесса выделения водорода. Величины (ПГЕ) ДЛЯ процесса неполного
восстановления Сr (VI) на фольге "Графлекс" составляют
(1,1 - 10,6) - 10"8 г-экв/см2. Они сопоставимы с результатами адсорбции СrО) 2' (17,76-10"7 г-экв/см2).
Накопление продуктов катодной реакции на поверхности фольги
"Графлекс": хромихроматная пленка, водород, продукты окисления
графита должно привести с течением времени к уменьшению скорости процесса. Схему
катодного процесса в хромовокислом электролите можно представить совокупностью
реакций:
Н20 + е - Надс + ОН
Сг3+ + ЗОН - Сг (ОН) 3
Об участии адсорбционного атомарного водорода в
восстановлении Сг (VI), присутствующего на поверхности электрода в составе
адсорбционной пленки, свидетельствует малое изменение рН вблизи электрода,
отсутствие интенсивного выделения газа, т.е. избыток ОН'-групп, образующийся
при разложении воды, связывается в Сг (ОН) 3.
Глава 5. Влияние материала электродных пар.
и режима процесса на качество электрохимической очистки разбавленных
хромсодержащих электролитов. Эффективность электрохимической очистки
определяется рядом факторов: материалом электродных пар, составом и концентрацией
промывной воды, плотностью тока поляризации, расстоянием между электродами,
температурой раствора, перемешиванием и др. Среди указанных факторов важнейшее
значение имеет выбор электродной пары. При этом могут быть использованы
нерастворимые и растворимые аноды.
При выборе электродного материала катода и анода необходимо
учитывать перенапряжение выделения водорода и кислорода, адсорбционную
способность электродов, их пассивируемость. Согласно данным, полученным ранее
на кафедре ТЭП ТИ СГТУ, и приведенным в настоящей работе, результаты по
удалению электрохимическим способом загрязняющего компонента зависят от
расстояния между электродами - 1. При увеличении расстояния более 5 см качество
очистки снижается: оптимальным является 1, равное 1-2 см (таблицы 2,3). Метод
потенциодинамических кривых при изучении катодных и анодных процессов в
слабокислых разбавленных хромсодержащих электролитах позволил рекомендовать в
качестве катода стальной и графитовый электроды (фольга "Графлекс", электроугольный
графит). В качестве анодного материала представляло интерес опробовать графит,
титан, свинец.
Изучение влияния материала анода, катода и комбинации
электродных пар, а также рН раствора, плотности тока на катоде и аноде,
температуры электролита на качество очистки промывной воды и разбавленных
растворов электролитов от ионов Cr (VI) с нерастворимыми анодами позволило выделить
как наиболее перспективные пары: сталь - свинец (I).
Влияние материала электродных пар проявляется в различной
скорости электровосстановления Cr (VI) на железе и графите и в воздействии
выделяющегося кислорода на поверхность катода и, соответственно, на скорость
перехода Cr (VI) в соединения низшей валентности. Можно предположить, что
выделяющийся кислород в небольшом электродном пространстве легко достигает поверхности
катода, взаимодействует с ней, образуя оксиды и анионы НО, которые свою
очередь, участвуют в восстановлении Cr (VI) до Сr (Ш). Кроме
того, согласно литературным данным, кислород является стимулятором процесса
электровосстановления водорода и наводороживания материала. Накопление адсорбированного
водорода на поверхности катода также способствует ускорению разряда Cr (VI) до
СП). Рассматривая с данных позиций влияние материала анода на качество очистки
хромсодержащих растворов, можно сказать следующее: наибольшие токи, связанные с
выделением кислорода, наблюдаются на свинцовом электроде в растворе бихромата
калия изучаемых концентраций. И именно для электродной пары, где анодом
является свинец, получены лучшие результаты электрохимической очистки промывных
вод и модельных растворов. Повышение скорости выделения кислорода на титановом
электроде в 3,4-1М K2Gr207 также приводит к повышению качества электрохимической
очистки. Следует отметить, что повышение температуры не оказывает значительного
влияния на качество очистки (таблица 3). Данное явление можно объяснить тем,
что повышение температуры, с одной стороны, увеличивает доставку реагирующих
частиц к поверхности электрода и отвод продуктов реакции, с другой стороны,
уменьшается адсорбция водорода, снижается выделение кислорода. Следовательно,
увеличение температуры нецелесообразно.
Проведение электролиза с нерастворимыми анодами позволило
рекомендовать в качестве катодов сталь или электрод, изготовленный из фольги
"Графит", в качестве анода - свинец, титан. При этом очистка
загрязненных вод может быть проведена до ПДК (Cr (VI) = 0,05 мг/л), или до
концентраций Cr (VI), которое не ухудшает качество промывки деталей при
замкнутом обороте воды.
Использование растворимых анодов в процессе
электрохимической очистки позволяет получить хорошие результаты при содержании
загрязняющего компонента - 0,1 г-ион/л (таблица 4,5). Однако значительный расход
анодов и, как следствие, шламообразование, а также большое солесодержание
ограничивают применение электролиза с растворимыми анодами (электрокоагуляция).
Основные выводы:
1. Установлено, что на поверхности металлических (сталь,
титан, свинец) и графитовых электродов в условиях катодной и анодной
поляризации и без тока протекают адсорбционные процессы, образующие величину
стационарного потенциала электрода. Сформированные адсорбционные слои
определяют скорость электродных процессов. Величина ГЕ зависит от материала
электрода, электродного потенциала, определяется конкурирующей адсорбцией
бихромат-ионов, молекул воды, выделяющегося кислорода и составляет для
катодного процесса (1,1 - 10,6) экв/см, для анодного процесса (0,9 - 96).
2. Изучена кинетика анодного растворения стального,
титанового, свинцового и графитовых материалов в разбавленных хромсодержащих
электролитах, выявлены области потенциалов и соответствующие им токи, представляющие
интерес для использования указанных электродов в процессе электрохимической
очистки:
для проведения электролиза с нерастворимыми анодами
рекомендуется использовать свинцовый и титановый электроды, работающие при плотностях
тока не менее (3,0 - 6,0) А/дм2, обеспечивающих интенсивное выделение кислорода;
установлено, что для проведения электрокоагуляционной
очистки хромсодержащих промывных вод концентрация Сг (VI) не должна превышать
0,85-10 М, плотность поляризующего тока изменяется от 3,0 до 20 А/дм2. Для
интенсификации процесса можно использовать повышение температуры раствора до 50
°С.
3. Методом ВИМС и микроструктурным анализом поверхности
подтверждено наличие пассивирующих пленок на поверхности анода, содержащих в
своем составе оксидные соединения хрома различной валентности и оксидов
металлов.
4. Установлено, что для повышения качества электрохимической
очистки необходимо подбирать оптимальные пары электродных материалов,
обеспечивающих интенсивное выделение водорода и кислорода.
5. Разработаны технологические параметры для проведения электрохимической
очистки хромсодержащих промывных вод с нерастворимыми анодами:
катод - графит (электроугольный графит, фольга "Графлекс");
анод - свинец или титан;
катод - сталь, анод - свинец.
Режим электролиза: iK=iA= 2 А/дм2; t=20 - 25 °С; t=50 мин; расстояние
между электродами 2-5 см.
Список публикаций по теме диссертации
1. Шишова М.А. Изучение анодного
растворения сплава Fe-Ni методом хронопотенциометрии / Н.Д. Соловьева, В.Н. Целуйкин,
М.А. Шишова // Современные проблемы теоретической и экспериментальной химии: Материалы
докладов III Всерос. конф. молодых ученых/СГТУ. Саратов, 2001. С.262-263.
2. Шишова М.А. Хроноамперометрическое
исследование анодного растворения сплавов Fe-Ni / Н.Д. Соловьева, В.Н. Целуйкин,
М.А. Шишова // Перспективные полимерные композиционные материалы. Альтернативные
технологии, переработка: Доклады Междунар. конф. "Композит - 2001"/СГТУ
Саратов, 2001. С.273-276.
3. Шишова М.А. Влияние природы
материала анода на эффективность электрохимической очистки сточных вод от
катионов тяжелых металлов / Н.Д. Соловьева, М.А. Шишова // Современные
электрохимические технологии: Сб. статей по материалам Всерос. конф. / СГТУ. Саратов,
2002. С.224-228.
|