Реферат: Алифатические нитросоединения
Реферат: Алифатические нитросоединения
Алифатические
нитросоединения
Нитроалканы имеют общую
формулу CnH2n+1NO2 или R-NO2. Они также изомерны
алкилнитритам (эфирам азотистой кислоты) с общей формулой R-ONO.
Изомерия нитроалканов
связана с изомерией углеродного скелета. Различают первичные RCH2NO2, вторичные R2CHNO2 и третичные R3CNO2 нитроалканы. Нитроалканы
называют по углеводороду с приставкой нитро-. По систематической
номенклатуре положение нитрогруппы обозначается цифрой.
Способы получения
нитроалканов
1. Нитрование алканов
(Коновалов, Хэсс).
Алканы окисляются
концентрированной азотной кислотой или смесью азотной и серной кислот.
Нитрование протекает только под действием разбавленной азотной кислоты пр
нагревании (М.И. Коновалов, 1888 г.):
R-H + HO-NO2
® R-NO2 + H2O
Скорость реакции невелика
и выходы низкие. Лучшие результаты получаются с алканами, содержащими третичные
углеродные атомы. Реакция сопровождается образованием полинитросоединений и
окислительными процессами.
практическое значение
получили следующие методы нитрования алканов: 1) в газовой фазе при 350-400 оС
с помощью 40-70%- ной HNO3 (нитрование по Хэссу, 1936 г.); 2) в жидкой фазе при 100-200оС с 50-70%- ной HNO3; 3)в жидкой или газовой
фазе тетраоксидом или диоксидом азота. В промышленности получило применение
нитрование парами азотной кислоты при 250-500оС - парофазное
нитрование. Выбор температуры процесса зависит от дины углеродной цепи
и строения углеводорода: изобутан реагирует уже при 150оС, тогда как
метан - при 370. Реакция сопровождается крекингом углеводорода, в результате
чего образуются мононитроалканы с углеродной цепью различной длины (деструктивное
нитрование).
На реакцию нитрования
расходуется около 40% азотной кислоты, остальная ее часть действует как
окислитель. Поэтому наряду с нитросоединениями образуются также спирты, кетоны
и кислоты. Кроме того, образуются и непредельные углеводороды.
Реакция нитрования -
радикальный процесс.
Звено цепи:
RH + NO2
® ·R
·R+ NO2 ® R NO2
RH + ·Cl ® ·R
·R+ NO ® R NO
2. Реакция Мейера.
CH3Br
+ AgNO2 ® CH3NO2
+ AgBr реакция Мейера
CH3CH2Br
+ NaNO2 ® CH3CH2NO2
+ NaBr реакция Корнблюма
Реакция протекает по
механизму SN2. В качестве побочных продуктов образуются эфиры
азотистой кислоты (механизм SN1).
3. Окисление аминов.
Ниросоединения также
могут быть получены окислением аминов:
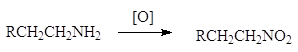
Нитросоединениям может
быть придана следующая октетная формула:
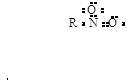
или
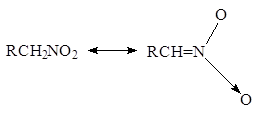 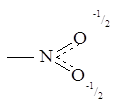
Химические свойства
1.
Образование
солей.
Первичные и вторичные
нитросоединения растворимы в щелочах с образованием солей. Это объясняется тем,
что водородные атомы пр углероде, связанном непосредственно с нитрогруппой, под
влиянием последней активируются, и в щелочной среде нитросоединения
перегруппировываются в аци-нитро-форму (кислотную):
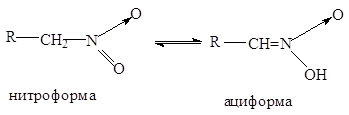
Таким образом,
нитроалканы являются таутомерными веществами, существующими в нитро- и аци-нитро-формах.
Если щелочные растворы
нитросоединений обработать минеральной кислотой, то происходит медленный
обратный сдвиг равновесия:
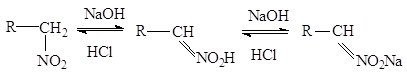
Поэтому нитросоединения
относят к псевдокислотам. Для псевдокислот характерно, что сами
они нейтральны, не обладают электропроводностью, но образуют нейтральные соли
щелочных металлов. «Нейтрализация» нитросоединений основаниями (образование
нейтральных солей) происходит медленно, а истинных кислот - мгновенно.
2. Образование аминов
(восстановление) - см. Лекцию №32.
3. Реакции с азотистой
кислотой.
Активность водородных
атомов у углерода, непосредственно связанного с нитрогруппой, проявляется и в
ряде других реакций, например, в реакциях с азотистой кислотой. Первичные и
вторичные нитросоединения реагируют с азотистой кислотой, а третичные не
реагируют:
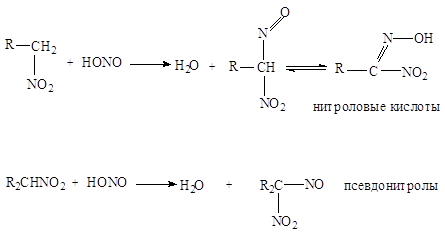
Щелочные соли нитроловых
кислот в растворе имеют красный цвет. Псевдонитролы в растворах и расплавах
окрашены в синий или зеленовато-синий цвет.
4. Конденсация с альдегидами.
Первичные и вторичные
нитросоединения конденсируются с альдегидами, образуя нитроспирты:
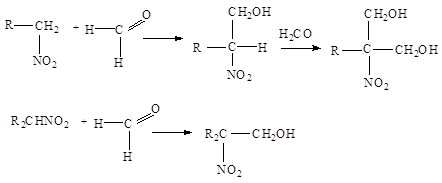
Нитрометан с
формальдегидом дает триметилолнитрометан NO2-C(CH2OH)3. При восстановлении
последнего получается аминоспирт NH2-C(CH2OH)3, используемый в производстве
моющих средств и эмульгаторов. Азотнокислые эфиры нитроспиртов, например, NO2-C(CH2ONO2)3, являются ценными
взрывчатыми веществами.
5. Образование альдегидов и
кетонов.
Аци-формы первичных и
вторичных спиртов нитросоединений в водных растворах при действии минеральных
кислот образуют альдегиды или кетоны:
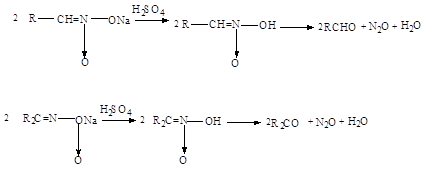
6. Образование карбоновых
кислот.
Первичные нитросоединения
при нагревании 85%-ной серной кислоты переходят в карбоновые кислоты с
отщеплением гидроксиламина. Реакция может служить промышленным способом
получения гидроксиламина:
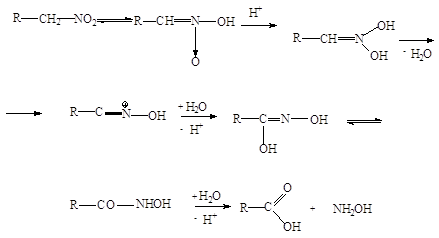
Нитропарафины используют в технике как
растворители, для производства альдегидов, кислот, взрывчатых веществ, в
реактивной технике, резиновой промышленности (вулканизаторы), при изготовлении
пластмасс и др.
Ароматические
нитросоединения
Получение ароматических
нитросоединений
1.
Нитросоединения
с нитрогруппой в ядре получают нитрованием ароматических углеводородов смесью азотной и
серной кислот (нитрующая смесь):
C6H6 + HONO2 ® C6H5NO2 + H2O
При нитровании бензола
вторая нитрогруппа вступает в м-положение. Введение ее достигается
применением более жестких условий нитрования - более высокая температура,
концентрированные кислоты. Третья группа вводится с еще большим трудом в м-положение:
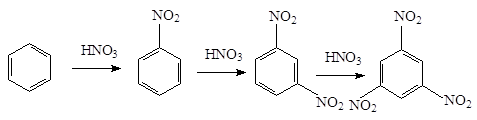
При наличии в ядре
заместителей электронодонорных заместителей, удается ввести три нитрогруппы в
обычных условиях. Так, толуол нитруется по следующей схеме:

При нитровании гомологов
бензола, содержащих два заместителя, сказывается стерический эффект. Если эти
заместители находятся в п-положении, то нитрогруппа становится рядом с
меньшим заместителем:
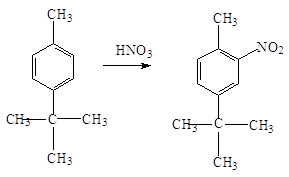
Скорость реакции
нитрования зависит от субстрата и состава нитрующей смеси; для каждого
соединения существует оптимальный состав. Так, при нитровании нитробензола
оптимальный результат достигается при использовании 90%- ной серной кислоты.
Снижение ее концентрации до 80% уменьшает скорость реакции в 3000 раз.
В настоящее время
установлено, что в растворе азотной кислоты в серной имеет место равновесие:
2 H2SO4
+ HNO3 « NO+2
+ H3O+ + 2 HSO-4
Чистая азотная кислота в
условиях нитрования диссоциирует по схеме:
2 HONO2 « NO+2 + NO-3 + H2O
Сам процесс нитрования с
участием нитроний-катиона NO+2 представляет собой замещение водорода:
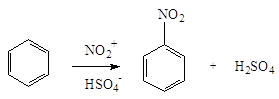
2. Нитросоединения с
нитрогруппой в боковой цепи получают теми же методами, что и
нитросоединения алифатического ряда:
1. Нитрование гомологов
бензола разбавленной азотной кислотой (реакция Коновалова).
Ar-CH3 + HONO2 ® Ar-CH2NO2 + H2O
Реакция
галогенпроизводных с галогеном в боковой цепи с нитритом серебра (реакция
Мейра)
C6H5-CH2Cl
+ AgNO2 ® C6H5-CH2NO2
+ AgCl
Химические свойства
Химические
свойства нитросоединений ароматического ряда обусловлены присутствием в
молекулах нитрогруппы и ароматического ядра и их взаимного влияния.
1. Восстановление.
Впервые нитробензол был
восстановлен в анилин с помощью сернистого аммония в 1842 г. Н.Н. Зининым. Это открытие сыграло важнейшую роль в развитии химической технологии, особенно
в области химии красителей, медикаментов и фотохимикатов. Ароматические
нитросоединения в зависимости от условий восстановления дают различные
продукты. Ароматические амины являются конечными продуктами восстановления.
Обычно их получают в кислой среде.
В нейтральной, щелочной и
слабокислой средах можно получить различные промежуточные продукты
восстановления. Ниже приведена схема восстановления нитросоединений:
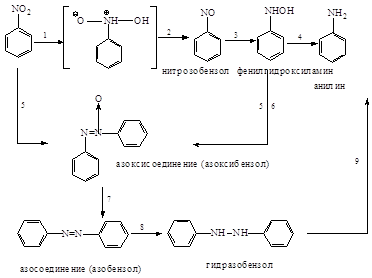
В нейтральной и кислой
средах идут реакции 1-4, причем в кислой среде не удается выделить
промежуточные продукты. В нейтральной среде можно выделить нитрозобензол и
фенилгидроксиламин. В щелочной среде нитро- и нитрозобензолы конденсируются с
фенилгидразином и идут реакции 5-9. Различные продукты восстановления можно
получать, пользуясь методом электролитического восстановления. В зависимости от
потенциала на электродах можно получать различные вещества.
2. Реакции замещения.
Нитрогруппа в реакциях
электрофильного замещения направляет заместитель в мета-положение причем
реакционная способность бензольного кольца уменьшается:
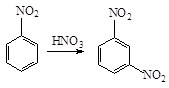
В реакциях нуклеофильного
замещения нитрогруппа направляет заместители в орто- и пара-положения.
Так, при нагревании нитробензола с порошкообразным KOH получается смесь о-
и п-нитрофенолятов:
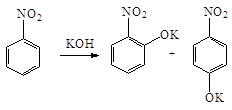
Благодаря сильно выраженному
электроноакцепторному характеру нитрогруппа оказывает значительное влияние на
атомы и группы, находящиеся по отношению к ней в о- и п-положениях.
Так, в случае о- и п-нитрохлорбензолов галоген под влиянием
нитрогруппы приобретает высокую подвижность, и легко замещается на гидроксил,
алкоксил или аминогруппу:
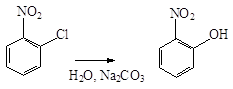
|