Курсовая работа: Цинк и его свойства
Курсовая работа: Цинк и его свойства
Химический элемент № 30
4.Электронное строение атома.
4.2. Дайте объяснение
физического смысла всех индексов у данного химического элемента в системе Д.И. Менделеева (порядковый номер, номер периода, номер
группы, принадлежность к группе «А» или «Б»). Определите возможность «Эффекта
провала электрона».
Решение.
Порядковый номер химического
элемента в периодический системе – 30. молярная масса элемента равна 65.39
г/моль.
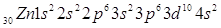 . Это значит, что в нейтральном атоме
цинка содержится 30 электронов, заряд ядра атома цинка также равен 30. Цинк расположен
в четвертом периоде системы. Это значит, что в атоме цинка есть четыре электронных
слоя, на которых расположены электроны. Цинк расположен во второй группе периодической
системы. В атоме цинка полностью заполняется 3d-подуровень на котором теперь находится
10 электронов. Цинк принадлежит к побочной подгруппе, или группе «Б». . Это значит, что в нейтральном атоме
цинка содержится 30 электронов, заряд ядра атома цинка также равен 30. Цинк расположен
в четвертом периоде системы. Это значит, что в атоме цинка есть четыре электронных
слоя, на которых расположены электроны. Цинк расположен во второй группе периодической
системы. В атоме цинка полностью заполняется 3d-подуровень на котором теперь находится
10 электронов. Цинк принадлежит к побочной подгруппе, или группе «Б».
Провал или проскок электрона
для цинка невозможен, поскольку у него полностью заполнен 3d-подуровень. Провал
электрона характерен для меди, серебра, у них количество d-электронов также равно
10, но s-электрон только один. Это можно объяснить повышенной энергетической стойкостью
электронных структур, отвечающих полностью заполненным энергетическим подуровням.
Переход электрона в атоме меди с 4s на 3d-подуровень приводит к образованию полностью
заполненного 3d-подуровня и это энергетически выгодно. У цинка 3d – под уровень
заполнен и электрону некуда переходить.
4.3. Выделите валентные подуровни в электронной формуле атома
химического элемента, определите принадлежность
химического элемента к типу s-, p-, d-, f-элементов.
Решение.
Покажем расположение валентных
электронов в атоме цинка. Как видно из электронной формулы цинк относится к d-элементам,
поскольку у него заполняется 3d-подуровень.
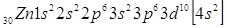
На приведенном рисунке эллипсом
выделено расположение валентных электронов.
4.4. Напишите наборы квантовых чисел для
всех валентных электронов.
Решение.
У атома цинка будет два валентных
электрона. Запишем наборы квантовых чисел для этих электронов. Главное
квантовое число равно 4 и химический элемент находится в 4 периоде периодической
системы химических элементов. Поскольку в цинка валентные электроны расположены
только на s-подуровне то его орбитальное квантовое
число имеет значение равное 0. Поскольку этих электронов будет 2 то они имеют противоположные
спины ms = ±1/2. Поскольку ml = 0 то у элемента
не будет других подуровней кроме s-подуровня.
Наборы квантовых чисел будут
иметь вид:
n = 5; l = 0;
ml = 0; ms = +1/2.
n = 5; l = 0;
ml = 0; ms = -1/2.
4.5. Определите принадлежность химического
элемента к металлам или неметаллам, спрогнозируйте величины степени окисления.
Решение.
Поскольку цинк расположен
во второй группе периодической системы, то он относится к металлам. В химических
реакциях он будет проявлять металлические свойства. для металлов более приемлема
отдача электронов. Поэтому цинк может отдавать два электрона с 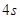 - подуровня. Поэтому цинк будет
проявлять степень окисления +2. В связи с экранированием 3d – подуровня и его заполненостью, электроны
с него не будут брать участие в химических процессах и поэтому цинк будет проявлять
только степень окисления равную +2. - подуровня. Поэтому цинк будет
проявлять степень окисления +2. В связи с экранированием 3d – подуровня и его заполненостью, электроны
с него не будут брать участие в химических процессах и поэтому цинк будет проявлять
только степень окисления равную +2.
4.6. Распределите
валентные электроны атома химического элемента по энергетическим ячейкам в соответствии
с принципом наименьшей энергии и правилом Гунда.
Решение.
В соответствии с принципом
наименьшей энергии два валентных электрона атома цинка расположатся на 4s-подуровне, поскольку он располагает меньшей
энергией чем любой другой подуровень. Правило Хунда гласит, что устойчивому состоянию
атома отвечает такое расположение электронов в пределах энергетического подуровня,
при котором абсолютное значение суммарного спина атома максимально. Поэтому мы моглы
бы считать. Что в одной ячейке будут электроны с одинаково направлеными спинами.
Но это противоречит принципу Паули. И поэтому расположение электронов для цинка
будет таково как на приведенном нами рисунке:
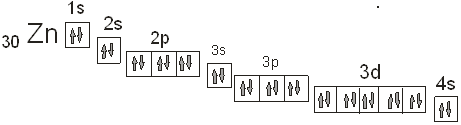
4.7. Прогнозируйте тип
гибридизация валентных атомных орбиталей при образовании бинарных соединений
(фторидов, хлоридов и др.).
Решение.
Рассмотрим получение 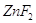 : :
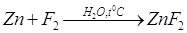
Каждый атом фтора, входящий
в состав данной молекулы, обладает одним неспаренным электроном, который и берет
участие в создании ковалентной связи. Атом цинка в не возбужденном состоянии неспаренных
электронов не имеет вообще:
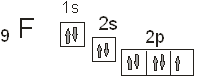
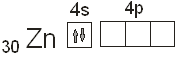
Поэтому для участия в химическом
соединении атом цинка должен перейти в возбужденное состояние: 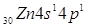 . .
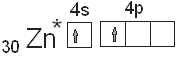
Образовавшийся возбужденный
атом цинка владеет двумя не спаренными электронами, электронное облако одного
электрона соответствует состоянию 4s, а другого состоянию 4p. При
затрате некоторой энергии вместо исходных орбита лей могут образовываться две равноценные
гибридные орбитали (sp – орбитали). У атома
цинка в бинарных соединениях будет наблюдаться sp –гибридизация. Гибридные sp –орбитали будут вытянуты в противоположных направлениях, как
это показано на рисунке.
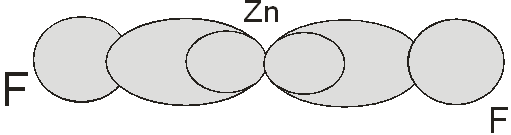
Рис. 1. Строение молекулы
ZnF2.
5. Соединение данного
химического элемента с неметаллами.
5.2. С галогенами.
Решение.
Газообразные фтор, бром, хлор,
иод не реагируют с цинком на холоду. Но в присутствии паров воды реакция может проходить
с воспламенение металла и выделением большого количества теплоты (для фтора 172
ккал, для хлора 95,6 ккал на моль цинка)
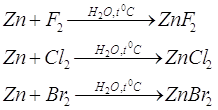
В реакции с галогенами получаем
галоген производные цинка: фториды, хлориды, броматы.
5.4. С азотом.
Решение.
С азотом, даже в парах цинк
не реагирует, но довольно легко реагирует при температуре красного каления с аммиаком
с выделением нитрида цинка 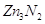 . .
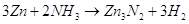
5.5. С углеродом.
Решение.
Цинк непосредственно не реагирует
с углеродом и карбид цинка мы можем получить только через промежуточные реакции.
Карбид цинка мы можем получить при нагревании цинка в токе ацетилена при температурах
около 200 – 300 С.
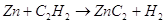
Карбид цинка 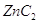 довольно нестойкое соединение,
которое легко разлагается водой и кислотами. довольно нестойкое соединение,
которое легко разлагается водой и кислотами.
6. Оксиды и гидроксиды данного химического элемента.
6.1. Запишите ряд оксидов данного
химического элемента (прогноз по электронной формуле и ковалентности).
Решение.
Для цинка характерна степень
окисления +2. поэтому цинк имеет только один оксид: ZnO. Другие оксиды цинка неизвестны. Возможно существование
пер оксида цинка ZnO2. ковалентность цинка в пер оксиде равна
двум, строение его молекулы приведено на рисунке.

Ковалентность
цинка в оксиде ZnO равна двум.
Запишем электронную
формулу для ZnO:

6.2. Прогнозируйте характер оксидов
(основной, кислотный, амфотерный) по величине Э.О. и правилу химических свойств ряда оксидов.
Решение.
Во второй побочной подгруппе
периодической системе кроме цинка находится
также и кадмий и ртуть. Все эти
металлы имеют основные оксиды, кадмий проявляет также и амфотерные свойства. Поэтому
можно прогнозировать, что оксид цинка будет проявлять также амфотерные свойства.
Рассмотрим электроотрицательности
оксида цинка:
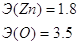
Разница электронегативностей
для ZnO равна 3,5 – 1,8 = 1,7. Для основных оксидов
Na2O, CaO, BaO эта разница составляет около 2,5, а для
кислотных оксидов SO2, SO3, P2O5 около 1÷1,3. как видно оксид цинка лежит посредине
этих значений, как металл он будет обладать амфотерными свойствами.
6.3. Запишите соответствующие гидроксиды
(основания и кислоты). Определите принадлежность к сильным или слабым электролитам.
Решение.
Для цинка характерен только
один гидроксид.
Поскольку цинк двухвалентен,
то формула гидроксида цинка имеет вид: 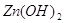 .
Гидроксид цинка выделяется из растворов солей цинка при действии щелочей в виде
белого аморфного осадка. При стоянии он постепенно приобретает кристаллическую структуру.
Скорость кристаллизации зависит от раствора соли из которой она кристаллизируется.
Так из растворов хлоридов гидроксид цинка кристаллизируется значительно быстрее
чем из растворов нитратов. .
Гидроксид цинка выделяется из растворов солей цинка при действии щелочей в виде
белого аморфного осадка. При стоянии он постепенно приобретает кристаллическую структуру.
Скорость кристаллизации зависит от раствора соли из которой она кристаллизируется.
Так из растворов хлоридов гидроксид цинка кристаллизируется значительно быстрее
чем из растворов нитратов.
Гидроксид цинка владеет амфотерными
свойствами (с преобладанием основных свойств), константа диссоциации основания
равна 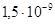 , а кислоты , а кислоты 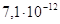 . Произведение растворимости
гидроокиси цинка равно . Произведение растворимости
гидроокиси цинка равно 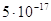 . Есть данные, что
у свежеосажденного гидроксида цинка она несколько больше и составляет . Есть данные, что
у свежеосажденного гидроксида цинка она несколько больше и составляет 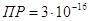 . .
6.4. Составьте уравнения реакций,
подтверждающих характер гидроксидов о молекулярном и ионном виде.
Решение.
Гидроксид цинка владеет амфотерными
свойствами. Он реагирует как с кислотами так и с щелочами. С кислотами гидроксид
цинка дает соли цинка, например:

В щелочном растворе гидроокись
цинка ведет себя как ангидридокислота, то есть переходит в раствор в виде гидроксоцинкат-ионов
за счет присоединения ионов гидроксила. Известны соли три-, тетра- и
гексагидроксоцинкатов, например: 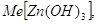 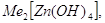 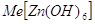 . .
Некоторые из цинкатов выделены
в твердом состоянии: 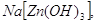 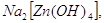 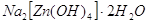 . Они образуются только при
избытке щелочи. . Они образуются только при
избытке щелочи.
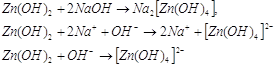
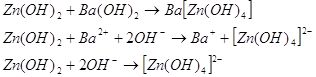
Некоторые из полученных соединений
содержат криталлизационную воду. В большинстве случаев последняя легко отцепляется
при нагревании. Конституционно связанная вода удерживается в таких соединениях довольно
крепко, например при нагревании 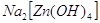 до
температуры 465ºС потери воды не происходит. до
температуры 465ºС потери воды не происходит.
Цинкаты также могут быть получены
при сплавлении окиси цинка и окисей других металлов, но полученные таким образом
цинкаты не растворимы в воде.
6.5. Напишите уравнения реакций
электролитической диссоциации гидроксидов.
Решение.
Гидроксид цинка вещество довольно
мало растворимое, но он все же диссоциирует на ионы, хотя и в малой мере. Произведение
растворимости 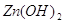 равно равно 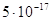 . Рассчитаем содержание иона
цинка в растворе . Рассчитаем содержание иона
цинка в растворе 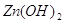 , , 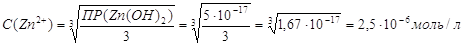
В водных растворах 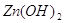 диссоциирует на ионы
согласно уравнения: диссоциирует на ионы
согласно уравнения:
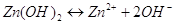 . .
Но поскольку 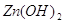 мало растворим, то диссоциация
протекает незначительно. мало растворим, то диссоциация
протекает незначительно.
7. Может ли данный
химический элемент образовывать комплексные соединения? Если да, то, какие (кислоты, основания, соли)? Приведите примеры.
Решение.
Цинк может образовывать комплексные
соединения. Комплексы цинк образовывает с аммиаком, цианидами, гидразином,
роданидами, а также с многими органическими веществами, например акридином, пирамидоном,
дифенилгуанидином, некоторыми органическими красителями. Отсутствие в комплексах
цинка стабилизации полем лигандов приводит к тому, что их стереохимия зависит только
от размера и от электростатической и ковалентной составляющей связи. Комплексы цинка
могут быть тетраэдрическими - 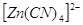 или октаэдрическими
- или октаэдрическими
- 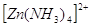 . .
С аммиаком были выделены комплексные
соединения состава: 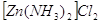 , , 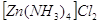 , , 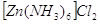 . Комплексы с 6 молекулами аммиака
были получены только в сухом виде. . Комплексы с 6 молекулами аммиака
были получены только в сухом виде.
Известно значительное число комплексов цинка
с органическими соединениями основного характера. В
зависимости от условий могут образовываться соединения двух
типов. К первому из них относятся соединения, где органический
реагент непосредственно связан с ионом цинка и образует
типичный комплекс внесения. Ко второму типу можно отнести
соединения, в которых органическое основание играет роль
катиона, дающего соли с другими ацидокомплексными анионами цинка. Эти
соединения »
характеру связи с органическими реагентами по существу относятся к обычным
ионным ассоциатам.
Интересно отметить, что меняя условия образования комплексов, и прежде всего кислотность среды, нередко
удается наблюдать взаимное превращения комплексов внедрения («аммиакаты»)
в комплексы типа «аммонийных солей» и обратно.
Гидразингидраты состава
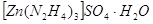 , , 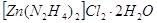 обладают
значительной прочностью из растворов
комплексов сероводород не осаждает сульфид цинка. Первый из них плохо растворяется в воде, не
растворим в спирте. обладают
значительной прочностью из растворов
комплексов сероводород не осаждает сульфид цинка. Первый из них плохо растворяется в воде, не
растворим в спирте.
8. Напишите
уравнения реакций гидролиза соли 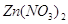 по 1-ой стадии в молекулярном и
ионном виде с учетом всех равновесий. Рассчитайте рН среды
при гидролизе этой соли (0,01 моль/л). Как
усилить гидролиз? по 1-ой стадии в молекулярном и
ионном виде с учетом всех равновесий. Рассчитайте рН среды
при гидролизе этой соли (0,01 моль/л). Как
усилить гидролиз?
Решение.
Соли цинка легко гидролизируются.
Рассмотрим гидролиз
нитрата цинка.
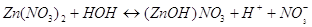
В результате гидролиза нитрата
цинка мы получим основную соль, основной нитрат цинка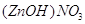 . .
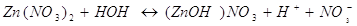
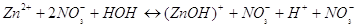
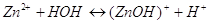
При гидролизе указанной соли
мы получим ионы 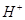 , тогда РН <
7. Раствор будет иметь кислую реакцию. , тогда РН <
7. Раствор будет иметь кислую реакцию.
Рассчитаем РН среды.
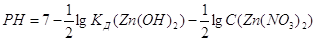
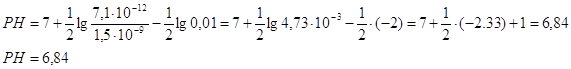
Повлиять на процесс гидролиза
можно с помощью добавки реактивов, кислот или основ. В процессе гидролиза мы получаем
ионы Н+, если их связать действием ионов ОН- , то процесс
гидролиза усилится. Поскольку гидролиз процесс равновесный, то уменьшение концентрации
ионов Н+ из – за реакции: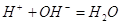 приведет
к смещению равновесия вправо, к усилению гидролиза. приведет
к смещению равновесия вправо, к усилению гидролиза.
Ослабить гидролиз можно введение
ионов Н+, что приведет к смещению равновесия влево.
9. Окислительно-восстановительные
реакции.
9.1. Дайте оценку
восстановительных свойств Zn и
окислительно-восстановительных свойств его ионов в зависимости от его рН среды
(используйте справочные характеристики).
Решение.
Цинк – сильный восстановитель.
На реакции цинка и ионами меди основана работа химического элемента Даниеля.
Нормальный электродный потенциал цинка - 0.7618 В. как восстановитель цинк
используют в многих химических процессах, например, он используется при восстановлении
органических веществ, и т.п.
Восстановительная активность
цинка проявляется особенно активно при РН<7, в кислых растворах. Он восстанавливает
водород из кислот, например разбавленной серной или соляной.
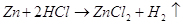
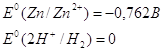
Также цинк может восстанавливать
металлы менее активные чем он сам в нейтральной среде. Он восстанавливает металлы
от хрома (-0,74 В) до серебра (0,79 В). Это его свойство часто используют для изготовления
гальванических элементов.
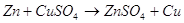
В щелочной среде цинк окисляется
до иона 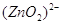 , он также может восстанавливать
водород из воды, восстанавливает многие неорганические соли, кислородные соединения. , он также может восстанавливать
водород из воды, восстанавливает многие неорганические соли, кислородные соединения.
Нормальный электродный потенциал
электрода равен для реакции: 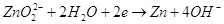 -1,216
В, это значит, что цинк может восстанавливать в щелочной среде все соединения с
более положительным потенциалом, это будут кислородные соединения хрома, марганца,
олова, свинца и т.п. -1,216
В, это значит, что цинк может восстанавливать в щелочной среде все соединения с
более положительным потенциалом, это будут кислородные соединения хрома, марганца,
олова, свинца и т.п.
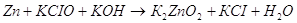
Приведенное выше уравнение
будет примеров взаимодействия цинка в щелочной среде.
9.2.
Составьте уравнения 3-х окислительно-восстановительных реакций ( с
использованием вещества содержащего ионы данного металла) при рН>7, рН=7,
рН<7. 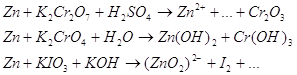
Предварительно
рассчитайте Е0 химической реакции, используя метод
электронно-ионного баланса.
Решение.
Для указанных уравнений запишем
окислительно-восстановительные уравнения реакций. Сначала рассмотрим эти уравнения
и решим их с помощью электронного баланса.
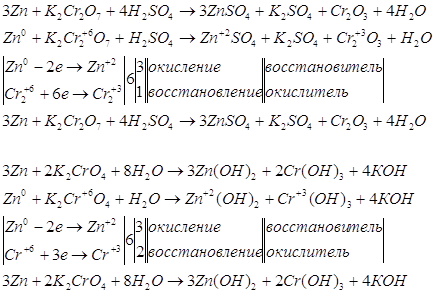
Запишем уравнения электронно-ионного
баланса.
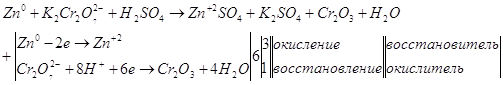
Суммируем уравнения.
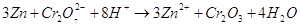
Запишем полученное уравнение
в молекулярном виде:
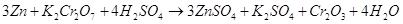
Рассчитаем Е0 химической
реакции.
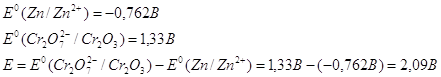
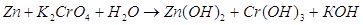
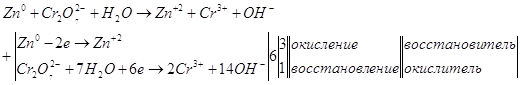
Суммируем уравнения.
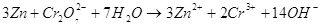
Запишем полученное уравнение
в молекулярном виде:
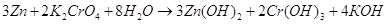
Рассчитаем Е0 химической
реакции.
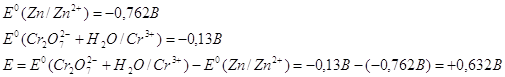
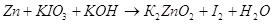
Составим уравнения ионно-электронного
баланса.
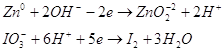
Просуммируем полученные полу
реакции.
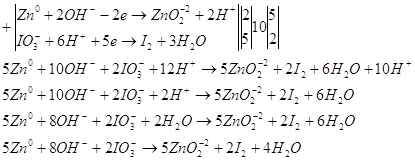
Запишем уравнение в молекулярном
виде.
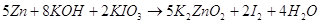
Рассчитаем Е0 химической
реакции.
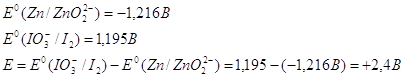
10.3. Составьте
и опишите схему гальванического элемента из металлического электрода данного
металла и электродной системы С, 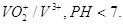
Решение.
Гальванический элемент состоит
из катода и анода. Одним из электродов в нашем случае будет цинковый электрод, другим
электродом будет инертный угольный электрод.
Запишем схему электрода.
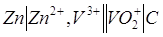
Гальванический элемент состоит
из цинковой пластины опущенной в раствор соли, что содержит ионы V3+ и H+ . поскольку РН <7. угольный электрод опущен в раствор, что
содержит ионы 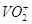 . Между электродами
расположена диафрагма, которая пропускает ионы, но не дает смешиваться электродным
растворам. Если электрическая цепь разеденена. То в при электродных пространствах
быстро наступает равновесие. . Между электродами
расположена диафрагма, которая пропускает ионы, но не дает смешиваться электродным
растворам. Если электрическая цепь разеденена. То в при электродных пространствах
быстро наступает равновесие.
Цинковая пластинка
в гальваническом элементе легко отдает свои катионы в раствор, тогда она будет окислятся.
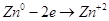
Каждый ион цинка, переходя
в раствор, оставляет на пластинке два электрона. Из-за этого пластинка получит отрицательный
заряд. На угольном электроде будут проходить процессы восстановления:
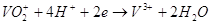
Если цепь замкнуть, то в гальваническом
элементе возникнет электрический ток. Электроны из места, где плотность отрицательного
заряда высока, будут переходить в место с меньшей плотностью отрицательного заряда.
В целом химическую реакцию.
Которая происходит в гальваническом элементе можно записать так: 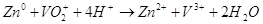 . В молекулярном виде уравнение
будет иметь такой вид: . В молекулярном виде уравнение
будет иметь такой вид: 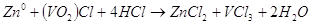 . .
Важной характеристикой любого
гальванического элемента будет его ЭРС. Она равна: 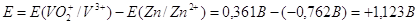 ,
если округлить полученное значение ЭРС, то мы получим: ,
если округлить полученное значение ЭРС, то мы получим: 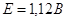 . При вычислении ЭРС мы не учитывали
влияния концентрации ионов на величину потенциала, а приведенные значения точны
только для ситуации, когда концентрации веществ равны нулю. Поэтому значение ЭРС
в реальных гальванических элементах будет несколько другим. Также надо отметить,
что чаще используется медно-цинковые гальванические элементы, которые более дешевы
чем элементы с использованием ванадия. . При вычислении ЭРС мы не учитывали
влияния концентрации ионов на величину потенциала, а приведенные значения точны
только для ситуации, когда концентрации веществ равны нулю. Поэтому значение ЭРС
в реальных гальванических элементах будет несколько другим. Также надо отметить,
что чаще используется медно-цинковые гальванические элементы, которые более дешевы
чем элементы с использованием ванадия.
10.4. Опишите процесс
электрохимической коррозии при контакте металла и изделия из Sn во влажной среде (Без аэрации и при
аэрации).
Решение.
Если включения олова в цинк
имеют значительные размеры, то мы будем иметь дело с гальваническим элементом.
Поскольку электродные потенциалы
для олова и цинка равны:
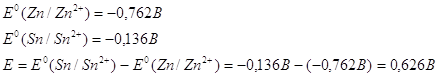
Мы будем иметь гальванический
элемент в котором цинк будет более активным металлом по сравнению с оловом, что
приведет к его окислению.
Рассмотрим случай, когда мы
имеем включения олова в цинк во влажной атмосфере без аэрации. Отсутствие аэрации
означает отсутствие активного кислорода, который может вступать в электрохимические
взаимодействия.
На скорость коррозии цинка
будет также влиять наличие оксидной пленки на поверхности цинка.
Олово будет оказывать на цинк
поляризирующее влияние, что приведет к тому, что цинк (потенциал которого меньше)
будет поляризироваться анодно и скорость его коррозии возрастет.
На аноде будет проходить
реакция: 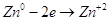 . .
На катоде, в роли которого
выступает олово, будет протекать реакция: 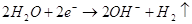 .
В результате реакции будет выделяться водород. Ионы гидроксила будут взаимодействовать
с ионами цинка и в результате мы получим гидроксид цинка. .
В результате реакции будет выделяться водород. Ионы гидроксила будут взаимодействовать
с ионами цинка и в результате мы получим гидроксид цинка.
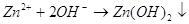
Рассмотрим процесс коррозии
при аэрации. Наличие аэрации означает доступ кислорода к контакту двух металлов.
На аноде будет проходить
реакция: 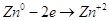 . .
На катоде, в роли которого
выступает олово, будет протекать реакция: 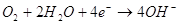 .
В результате реакции мы получим ионы гидроксила. Ионы гидроксила будут взаимодействовать
с ионами цинка и в результате мы получим гидроксид цинка. .
В результате реакции мы получим ионы гидроксила. Ионы гидроксила будут взаимодействовать
с ионами цинка и в результате мы получим гидроксид цинка.
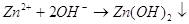
Процесс коррозии при аэрации
проходит более активно чем без аэрации, поэтому такой вид коррозии будет более опасен
для цинковых деталей чем коррозия без доступа воздуха.
10.5. Опишите процесс
электролиза с учетом перенапряжения.
Электролит – раствор ZnCl2 PH= 2, 5
Электроды: катод – С,
анод
– Zn.
Решение.
В растворе хлорид цинка будет
диссоциировать на ионы согласно уравнения:
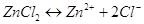
Рассмотрим процессы, которые
будут происходить на аноде.
Анод цинковый. На цинковом
аноде могут происходить несколько процесов:
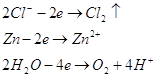
Запишем потенциалы прохождения
указанных процессов:
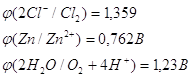
Перенапряжение выделения кислорода
на цинковом электроде при плотности тока 1мА/см2 равно 1,75 В. Это значит,
что кислород данной реакции выделятся не будет и на аноде возможны только две электрохимические
реакции:
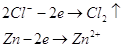
Как видно из значений электродных
потенциалов на аноде будет происходить реакция окисления цинка: 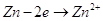 , потенциал которой будет ниже
чем потенциал восстановления хлора. Мы будем иметь дело с рафинированием цинка. , потенциал которой будет ниже
чем потенциал восстановления хлора. Мы будем иметь дело с рафинированием цинка.
Рассмотрим электродные процессы
на катоде. Материал катода – уголь или графит, катод инертен и не будет брать участия
в электрохимических процессах. На катоде также возможны несколько реакций, рассмотрим
их. РН среды равно 2,5. На графите при температуре 20ºС перенапряжение выделения
водорода при плотности тока 1 А/см2 равно 1,2 В, а при плотности тока
1 мА/см2 всего лишь 0,6 В. За уравнением Нернста мы можем вычислить значение
потенциала перенапряжения водорода при РН=2,5. потенциал водородного электрода
находится в линейной зависимости от РН среды.
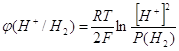
При давлении водорода 1 атмосфера
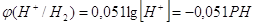 , и при РН=2,5 мы получим перенапряжение
равное: , и при РН=2,5 мы получим перенапряжение
равное: 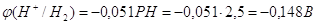
При плотности тока равной
1 А/см2 перенапряжение равно: 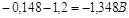 а
при плотности тока 1 мА/см2 а
при плотности тока 1 мА/см2 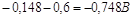 . .
Ионы же цинка восстанавливаются
при потенциале равном - 0,763 В. Перенапряжением восстановления ионов цинка на графитовом
электроде можно пренебречь, поскольку оно довольно мало по значению. Из полученных
расчетов видно что при малых плотностях тока на графитовом электроде возможны две
конкурирующие реакции:
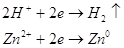
При плотности тока 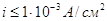 на катоде будет выделятся водород
по уравнению на катоде будет выделятся водород
по уравнению 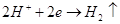 , поскольку потенциал
восстановления водорода будет равен , поскольку потенциал
восстановления водорода будет равен 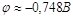 , что больше
потенциала восстановления цинка . При плотности тока , что больше
потенциала восстановления цинка . При плотности тока 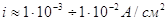 будут происходить конкурирующие
реакции: будут происходить конкурирующие
реакции:
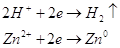
При этих условиях потенциал
восстановления водорода равен около 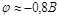 . При плотности
тока равной 1 А/см2 перенапряжение равно: . При плотности
тока равной 1 А/см2 перенапряжение равно: 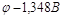 , при этих условиях мы можем
вести выделение цинка из раствора по уравнению: , при этих условиях мы можем
вести выделение цинка из раствора по уравнению: 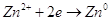 .
Тогда водород на электродах выделяться не будет. .
Тогда водород на электродах выделяться не будет.
При проведении электролиза
надо учитывать повешение температуры, при повышении температуры на 1ºС
перенапряжение уменьшается на 2 – 3 мВ. Оно также зависит от вида поверхности электрода
и от наличия некоторых органических добавок в электролите.
Список использованной литературы.
1.
Глинка Н. Л. Общая
химия. – Л.: Химия, 1988. – 702 с.
2.
Полеес М. Э. Аналитическая
химия. – М.: Медицина, 1981. – 286 с.
3.
Крешков А. П., Ярославцев
А. А. Курс аналитической химии. – М.: Химия, 1964. – 430 с.
4.
Мороз А. С., Ковальова
А. Г. Физическая и коллоидная химия. – Л. : Мир, 1994. – 278 с.
5.
Физическая химия.
Практическое и теоретическое руководство. Под ред. Б. П. Никольского, Л.:
Химия, 1987. – 875 с.
6.
Скуг Д., Уэст Д.
Основы аналитической химии. В 2 т. Пер с англ. М.: Мир, 1979, - 438 с.
7.
Натарова Н. Г.
Аналитическая химия цинка. – М.: Химия, 1982. – 378 с.
|