Контрольная работа: Вирішення задач по аналітичній хімії
Контрольная работа: Вирішення задач по аналітичній хімії
№ 1
В задачі потрібно знайти масу KOH, необхідну для приготування 1,0 л 20% розчину КОН густиною
1,19 г/мл, як також розрахувати молярну та нормальну концентрації розчину
Молярна маса
М(КОН) = 39 + 16 + 1 = 56 г/моль;
еквівалент рівний 1 моль; еквівалентна маса Е(КOH) = 56 г/моль-екв.
Маса 1 л розчину 1,19∙1000 = 1190 г.
20%-на концентрація
означає, що у 100 г розчину має знаходитись 20 г КОН, а у 1190 г
розчину (в 1 л) буде
Маса(КОН) = 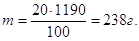
Кількість молей КОН
в 1 л розчину
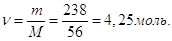 Тому, Тому,
СМ = 4,25 М.
Кількість моль-екв. КОН в 1 л розчину
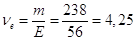 моль-екв. Отже, моль-екв. Отже,
СН = 4,25 н.
№ 2
В задачі потрібно знайти об’єм 0,2 М розчину H2SO4 густиною 1,09 г/мл за умови
розчинення маси 98,0 г H2SO4, як також розрахувати процентну та нормальну
концентрації розчину
Молярна маса M(H2SO4) = 2 + 32 + 16∙4 = 98 г/моль;
еквівалент рівний 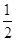 моль;
еквівалентна маса моль;
еквівалентна маса
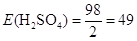 г/моль-екв. г/моль-екв.
Маса 1 л розчину 1,09∙1000 = 1090 г.
В 1 л розчину має бути m = 0,2∙98 = 19,6 г H2SO4, а в невідомому об’ємі Vрозч її буде 98,0 г. Звідси
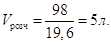
Якщо у 1090 г розчину маємо 19,6 г H2SO4, то у 100 г буде 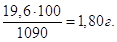 Тому, С% = 1,80 %. Тому, С% = 1,80 %.
Кількість моль-екв. H2SO4 в 1 л розчину 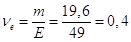 моль-екв. Отже, СН
= 0,4 н. моль-екв. Отже, СН
= 0,4 н.
№ 3
В задачі потрібно знайти масу HCl,
необхідну для приготування 0,5 л 0,1 н розчину HCl густиною 1,02 г/мл, як також розрахувати процентну та молярну
концентрації розчину
Молярна маса М(HCl) = 35,5 + 1 = 36,5 г/моль; еквівалент рівний 1
моль; екві-валентна маса Е(НCl) = 36,5 г/моль-екв.
Маса 1 л розчину 1,02∙1000 = 1020 г.
В 1 л розчину має знаходитись m = 0,1∙36,5 = 3,65 г HCl, а у 0,5 л буде
Маса(HCl) = 3,65∙0,5 = 1,825 г.
Якщо у 1020 г розчину маємо 3,65 г HCl, то у 100 г буде 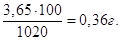 Тому, С% = 0,36
%. Тому, С% = 0,36
%.
Кількість молей HCl в 1 л розчину 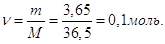 Отже, СМ = 0,1 М. Отже, СМ = 0,1 М.
№ 4
В задачі потрібно знайти масу NaOH, необхідну для приготування 2,0 л 0,5 н розчину NaOH густиною 1,06 г/мл, як також
розрахувати процентну та молярну концентрації розчину
Молярна маса
M(NaOH) = 23 + 16 + 1 = 40 г/моль;
еквівалент рівний 1 моль; еквівалентна маса E(NaOH) = 40 г/моль-екв.
Маса 1 л розчину 1,06∙1000 = 1060 г.
В 1 л розчину має знаходитись
m = 0,5∙40 = 20 г NaOH, а у 2,0 л буде
Маса(NaOH) = 2∙20 = 40 г.
Якщо у 1060 г розчину маємо 20 г NaOH, то у 100 г буде 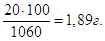 Тому, С% = 1,89
%. Тому, С% = 1,89
%.
Кількість молей NaOH в 1 л розчину 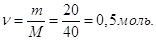 Отже, Отже,
СМ = 0,5 М.
№ 5
В задачі потрібно знайти масу H2SO4, необхідну для приготування 2,5 л
2,0 н розчину H2SO4 густиною 1,04 г/мл, як також розрахувати процентну та
молярну концентрації розчину
Молярна маса M(H2SO4) = 2 + 32 + 16∙4 = 98 г/моль;
еквівалент рівний 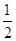 моль;
еквівалентна маса моль;
еквівалентна маса 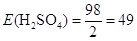 г/моль-екв. г/моль-екв.
Маса 1 л розчину 1,04∙1000 = 1040 г.
В 1 л розчину має знаходитись m = 2∙49 = 98 г H2SO4, а у 2,5 л буде
Маса(H2SO4) = 98 ∙ 2,5 = 245 г.
Якщо у 1040 г розчину маємо 98 г H2SO4, то у 100 г буде 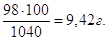 Тому, С% = 9,42 %. Тому, С% = 9,42 %.
Кількість молей H2SO4 в 1 л розчину 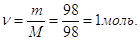 Отже, Отже,
СМ = 1,0 М.
№ 6
В задачі потрібно знайти об’єм 10%-го розчину NH3 густиною 0,96 г/мл за умови розчинення маси 28,8 г аміаку, як
також розрахувати молярну та нормальну концентрації розчину
Молярна маса M(NH3) = 14 + 3 = 17 г/моль;
еквівалент рівний 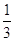 моль;
еквівалентна маса моль;
еквівалентна маса
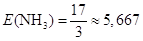 г/моль-екв. г/моль-екв.
10%-на концентрація означає, що у 100 г розчину має знаходитись 10
г NH3. А 28,8 г аміаку мають бути у
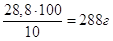 розчину. розчину.
Якщо об’єм розчину 1л має масу 0,96∙1000 = 960 г, то
невідомий об’єм розчину Vрозч має масу 288 г. Звідси 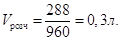
Якщо в 0,3 л розчину знаходиться 28,8 г аміаку, то в 1 л розчину буде 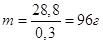 NН3. Кількість
молей аміаку в 1 л розчину Тому, NН3. Кількість
молей аміаку в 1 л розчину Тому,
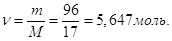
СМ = 5,647 М.
Кількість моль-екв. аміаку в 1 л розчину
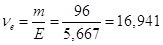 моль-екв. моль-екв.
Отже,
СН = 16,941 н.
№ 7
Знайти масу КОН,
необхідну для приготування 4,0 л 0,5 М розчину КОН густиною 1,03 г/мл.
Розрахувати процентну та нормальну концентрації розчину
Молярна маса
М(КОН) = 39 + 16 + 1 = 56 г/моль;
еквівалент
рівний 1 моль; еквівалентна маса
Е(КОН) = 56 г/моль-екв.
Маса 1 л розчину 1,03∙1000 = 1030 г.
В 1 л розчину має
знаходитись
m = 0,5∙56 = 28 г КОН, а
в 4 л буде
Маса(КОН) = 4∙28 = 112 г.
Якщо у 1030 г розчину маємо 28 г КОН, то у 100 г
буде 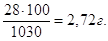 Тому, С% = 2,72 %. Тому, С% = 2,72 %.
Кількість моль-екв. КОН в 1 л розчину 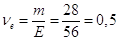 моль-екв. Отже, моль-екв. Отже,
СН = 0,5 н.
№ 8
В задачі
потрібно знайти масу MgCl2,
необхідну для приготування 0,5 л 0,2 н розчину MgCl2 густиною
1,01 г/мл, як також знайти процентну та молярну концентрації розчину
Молярна маса М(MgCl2) = 24,3+35,5∙2 = 95,3г/моль; еквівалент рівний 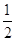 моль; еквівалентна
маса моль; еквівалентна
маса
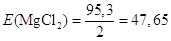 г/моль-екв. г/моль-екв.
Маса 1 л розчину 1,01∙1000 = 1010 г.
В 1 л розчину має знаходитись m = 0,2∙47,65 = 9,53 г MgCl2, а у 0,5 л буде
Маса(MgCl2) = 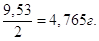
Якщо у 1010 г розчину маємо 9,53 г MgCl2,
то у 100 г буде 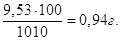 Тому, Тому,
С% = 0,94 %.
Кількість молей MgCl2 в 1 л розчину 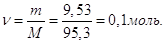 Отже, Отже,
СМ = 0,1 М.
№ 9
В задачі потрібно знайти об’єм 0,1 М розчину CaCl2 густиною 1,03 г/мл при розчиненні
55,5 г препарату CaCl2, як також розрахувати процентну та нормальну
концентрації розчину
Молярна маса М(CaCl2) = 40 + 35,5∙2 = 111 г/моль; еквівалент рівний 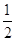 моль; еквівалентна
маса моль; еквівалентна
маса
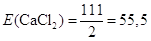 г/моль-екв. г/моль-екв.
Маса 1 л розчину 1,03∙1000 = 1030 г.
В 1л розчину має бути m = 0,1∙111 = 11,1г CaCl2,
а в невідомому об’ємі Vрозч буде 55,5 г. Звідси
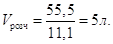
Якщо у 1030 г розчину міститься 11,1 г CaCl2, то у 100 г буде 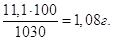 Тому С% = 1,08 %. Тому С% = 1,08 %.
Кількість моль-екв. CaCl2 в
1 л розчину 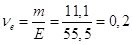 моль-екв.
Отже, моль-екв.
Отже,
СН = 0,2 н.
№ 10
В задачі потрібно знайти масу NaOH, необхідну для приготування 0,2 л 15% розчину NaOH густиною 1,12 г/мл, як також знайти
молярну та нормальну концентрації розчину
Молярна маса М(NaOH) = 23 + 16 + 1 = 40 г/моль; еквівалент рівний 1 моль;
еквівалентна маса Е(NaOH) = 40 г/моль-екв.
Маса 1 л розчину 1,12∙1000 = 1120 г.
Концентрація 15% означає, що у 100 г розчину має знаходитись 15 г
NaOH, а у 1120 г (в 1 л)
його має бути
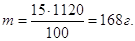
Для приготування 0,2 л
розчину треба взяти
Маса(NaOH) = 168∙0,2 = 33,6 г.
Кількість молей NaOH в 1 л розчину 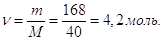 Тому, Тому,
СМ = 4,2 М.
Кількісь моль-екв. NaOH в 1 л розчину 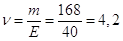 моль-екв.
Отже, моль-екв.
Отже,
СН = 4,2 н.
№ 11
Що собою уявляє:
а) якісний аналіз у розчині та “сухий” метод аналізу; б) макро-, мікро- та
напівмікроаналіз?
У переважній більшості
випадків аналізовану речовину переводять спочатку в розчин, потім визначають
окремі компоненти – іони або молекули. Так наприклад, для визначення іонів
калію в солі KCl останню розчиняють у воді, і, за
допомогою певних, характерних для іонів калію, реакцій визначають їх присутність. Поруч з цим, наявність ряду іонів
можна встановити, не переводячи речовину в розчин. Так, щоб виявити натрій,
невелику кількість речовини на платиновій дротинці вносять у безбарвне полум’я.
Якщо в досліджуваній речовині присутній натрій, полум’я забарвиться в жовтий
колір. Наявність іонів амонію також можна встановити, не переводячи речовину в
розчин. Досить розтерти дослідний зразок з вапном або лугом. При наявності
іонів амонію з’явиться характерний запах аміаку. Такий метод називають“сухим”.
Метод, коли для аналізу
беруть 0,1–1,0 г речовини, називають макроаналізом. Якщо для аналізу беруть менше 0,01 г
речовини, такий метод називають мікроаналізом. Проміжні значення маси досліджуваної
речовини (від 0,01 до 0,1 г) визначають метод напівмікроаналізу.
№ 12
Поняття про
аналітичну реакцію. Чутливість, селективність та специфічність аналітичної
реакції. Навести приклади
Аналітичною називається реакція, за допомогою якої відкривають ті
чи інші речовини (або іони) і/або встановлюють кількість речовини.
Найменша кількість речовини або іонів, яку можна виявити за допомогою тієї
чи іншої реакції в даних умовах називається відкриваним мінімумом
або чутливістю реакції. Ця величина дуже мала і позначається
буквою γ (γ = 10-6г).
Чутливість не слід характеризувати лише абсолютною кількістю речовини.
Має значення ще концентрація іона або речовини в розчині. Найменшу концентрацію
іонів або речовини, при якій їх ще можна виявити, називають граничним розведенням.
Наприклад, треба встановити
чутливість реакції
Fe3+ + 3SCN ↔ Fe(SCN)3.
Для цього готують розчин, в 500 мл якого міститься 1г-іон заліза.
Відомо, що при розведенні в 20 разів в 1 краплі об’ємом 0,02 мл ще можна
виявити іони заліза (ІІІ). Граничне розведення суть
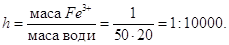
Знаходимо відкриваний мінімум: 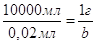 , звідси , звідси
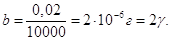
Селективність реакції – її вибірковість до тих чи інших
речовин або іонів. Існують реакції, проведенню яких не заважають
сторонні іони. Так, іони амонію можна виявити лугом.
Ця реакція, та їй подібні називаються специфічними. Високоспецифічних
реакцій відомо надзвичайно мало.
№ 13
Умови виконання
аналітичних реакцій. Приклади реакцій, що проходять на холоді і при нагріванні
розчину
Реакції
проводять при нагріванні чи охолодженні лише в тих випадках, коли нагрівання чи
охолодження сприяє проходженню прямої реакції до кінця, прискорює
її.
Так, при виявленні іону амонію реакція
NH4OH ↔ NH3↑ + H2O
йде швидше при підвищеній температурі, як також при даних умовах зростає чутливість
і вихід даної реакції.
Приклад реакції, яку слід проводити на холоді:
NaCl + K[Sb(OH)6] → Na[Sb(OH)6]↓
+ KCl
З ростом температури розчинність осаду Na[Sb(OH)6] зростає,
через це вищезазначену реакцію треба вести на холоді.
Умовами проведення аналітичних реакцій взагалі є температура,
концентрація і тиск, які максимально сприяють виявленню тих чи інших іонів.
№ 14
Що собою
уявляють буферні розчини? Яка їх роль у виконанні аналітичних реакцій? Навести
конкретні приклади
Буферними називають розчини суміші слабкої кислоти (або
слабкої основи) та її солі. Такою є, наприклад, суміш оцтової кислоти і
оцтовокислого натрію. При добавлянні до такої суміші сильної кислоти або
сильної основи мають місце наступні реакції:
CH3COONa
+ HCl → CH3COOH + NaCl
CH3COOH
+ NaOH → CH3COONa + H2O.
Звідси видно, що
при дії на буферний розчин сильної кислоти або сильної основи змінюється
концентрація слабкої кислоти. У першому випадку вона збільшується, у другому –
зменшується. Проте, рН розчину практично не змінюється. Це пояснюється
тим, що слабка кислота взагалі мало дисоціює, а в присутності однойменних іонів
її солі дисоціація йде значно меншою мірою. Отже, концентрація іонів Н+
буферної суміші під впливом сильної кислоти або сильної основи практично є
величина стала.
У хімії,
біології, медицині, у промисловому виробництві в результаті тих чи інших
процесів можуть виділятись або поглинатись іони Н+. Щоб процес відбувався
при сталому значенні рН, у розчин вводять буферні суміші, які поглинають
водневі або гідроксильні іони. Можна також довести, що при розведенні
буферної суміші рН розчину залишається сталим.
№ 15
Хімічні
реактиви. Поняття про їх чистоту, кваліфікацію. Чи можна застосовувати для
хімічного аналізу технічні реактиви?
Хімічними
реактивами називають
речовини, склад яких відповідає їх хімічним формулам в межах кваліфікації, і
які застосовуються для проведення хімічних реакцій. Кваліфікація
хімічних реактивів та
відповідні їй позначення наступні:
Т – технічний реактив. Вміст основної речовини менше 98%. Найнижча ступінь
чистоти реактиву.
Ч – чистий. Вміст основної речовини 98% і вище. Вміст домішок або нелеткого
залишку 0,01– 0,5%, масова доля залишку після прожарювання до 0,5%.
ЧДА – чистий для аналізу. Вміст основної речовини не менше 99%.
Домішки не перевищують допустимої межі, яка дозволяє проводити точні аналітичні
дослідження.
ХЧ – хімічно чистий. Найвища ступінь чистоти реактиву. Вміст
основної речовини більше 99%, домішок – в межах 0,001– 0,00001%, масова доля залишку
після прожарювання не більше 0,1%.
Для хімічного аналізу застосовують реактиви з кваліфікацією не
нижче ЧДА. Технічні реактиви для проведення аналітичних
визначень застосовувати ні в якому разі не можна через велику
кількість домішок.
№ 16
Що собою
уявляють кристалічний та аморфний осади? Навести приклади та основні умови
отримання
Кристалічний осад – це осад з порівняно сильними зв’язками
між його частинками. Утворення кристалічних осадів характеризується тим, що при
додаванні окремих порцій осаджувача нові центри кристалізації утворюються не
відразу. Основною умовою отримання кристалічних осадів є повільне додавання
реактиву, при якому кристалічні центри виростають у порівняно великі кристали.
Концентрація розчинів. Для осадження кристалічних осадів
користуються розбавленими розчинами, так як у цих умовах утворюються осади у
формі більших кристалів. Температура. При осаджуванні кристалічних осадів з гарячих розчинів збільшується їх
розчинність, тому виникає менше центрів кристалізації. Внаслідок цього
створюються умови для утворення крупніших кристалів.
Приклади: BaSO4, BaCrO4, CaC2O4 та ін.
Аморфний осад характеризується
слабкими зв’язками між його частинками. По суті це коагульований внаслідок
швидкого доливання розчину осаджувача колоїдний розчин. При швидкому доливанні
реактиву, яке, до речі, є основною умовою отримання аморфного осаду, відразу
виникає багато центрів кристалізації та дрібних агрегатів кристалів. Концентрація
розчинів. Аморфні осади, особливо гідроксиди металів, краще осаджувати з
концентрованих розчинів. Це сприяє зменшенню загальної поверхні і утворенню
осаду. Внаслідок зменшення загальної поверхні зменшується адсорбція сторонніх
речовин, що робить осади чистішими.
Температура. При осаджуванні аморфних осадів нагрівання сприяє
коагуляції колоїдних частинок і укрупненню зерен осаду.
Аморфні осади характерні для
багатьох важкорозчинних сполук: гідроксидів та сульфітів металів, силікатної та
вольфрамової кислот, та інших.
№ 17
Який основний
посуд використовують та як його готують для якісного аналізу?
У якісному
аналізі (в основному напівмікроаналізі) застосовують такий посуд: колби,
пробірки, чашки, стакани, скляні лійки, скляні палички, промивалки, бюкси,
кухлі, ступки, ексикатори. Піпетки градуйовані та бюретки
застосовують тільки в кількісному аналізі. Застосовуваний
для якісного аналізу посуд має бути чистим. Його слід мити
відразу після вживання. Для миття посуду застосовують теплий насичений розчин
соди, теплий лужний розчин KMnO4 або розчин хромової суміші. Посудина вважається чистою, якщо після
виливання з неї води внутрішні стінки змочуються водою рівномірно і на них не
залишається крапель. Добре вимитий посуд, перекинутий догори дном, має
здаватись сухим. Після миття посуд споліскують 2–3 рази невеликою кількістю
дистильованої води, що є також способом перевірки чистоти посудини.
№ 18
Чим дистильована вода відрізняється від звичайної питної
води? Чому посуд для аналітичних визначень обов’язково споліскують
дистильованою водою?
Головна відмінність дистильованої води від питної –
практично нульовий рівень концентрації солей кальцію і магнію та інших речовин,
які обов’язково присутні в питній воді. Вимитий посуд двічі споліскують невеликою кількістю
дистильованої води. Мета споліскування – перевірка чистоти посудини.
Посудина вважається чистою, якщо при обмиванні внутрішньої поверхні
дистильованою водою остання рівномірно стікає, не залишаючи краплин.
№ 19
Розкрити суть дробного та систематичного методів якісного
аналізу. Чи можливе виконання аналізу речовини з використанням лише одного з
цих методів?
Дробний метод аналізу передбачає виявлення кожного іона певними,
характерними реакціями в присутності всіх інших іонів. У складніших випадках спочатку
відділяють даний іон від тих, які заважають визначенню.
Систематичний аналіз полягає в тому, що складну суміш іонів
спочатку розділяють за допомогою групових реактивів на кілька окремих груп, потім
у межах кожної групи виявляють окремі іони певними, характерними реакціями.
Розділяють іони на групи і виявляють їх в кожній групі в цілком певній послідовності,
що виключає помилки, які часто роблять недосвідчені хіміки, проводячи аналіз
дробним методом.
Використання лише одного з цих методів (дробного) можливе тільки у випадку
високоспецифічних реакцій (таких, наприклад, як визначення іона амонію за допомогою
лугу), та у випадку, коли визначуваний іон вдається без проблем відділити від
іонів, які заважають визначенню.
№ 20
Які хімічні
реагенти належать до групових, селективних, специфічних? Навести приклади.
Написати рівняння реакцій
Груповими називають реактиви, якими визначають певну
групу катіонів або аніонів. Наприклад, розчин сульфіду амонію є груповим
реактивом на катіони 3-ї аналітичної групи. Розчин хлориду барію є груповим
реактивом на аніони 1-ї аналітичної групи, і т. п.
Селективними називають реактиви, що визначають ті чи інші
іони за певних умов. Так, фероціанід калію дає з іонами Ca2+
осад K2Ca[Fe(CN)6]. Якщо в розчині немає зовсім або є
незначна концентрація іонів Ba2+, даний реактив “віддає перевагу” іонам Ca2+. Якщо ж має місце значна концентрація іонів Ba2+,
фероціанід калію вже не буде селективним на іони Ca2+, тому що іони Ba2+ в значних концентраціях утворюють аналогічний
осад.
Специфічними називають реактиви, дії яких не заважає
жоден сторонній іон. Так, в одній з небагатьох високоспецифічних реакцій
визначення іону амонію
NH4Cl + NaOH →
NH4OH + NaCl
↕
NH3↑ + H2O
гідроксид натрію можна вважати специфічним на іон амонію. Специфічних реактивів,
рівно як і специфічних реакцій, дуже мало.
№ 21
Що покладено в
основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з
розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових
реактивів на катіони: NH4+, Ca2+, Fe3+.
Зазначити
колір осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони
1-ї аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних
груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на
аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи
добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у
воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи
нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи
збігається з поділом на групи в Періодичному Законі. Особливо це стосується
катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені
катіони тріад.
За визначенням,
до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних
сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та
амонію добре розчинні у воді. Тому не існує групового реактиву, здатного
осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1)
груповий
реактив на іони амонію відсутній через належність вказаного катіона до 1-ї
аналітичної групи;
2)
CaCl2
+ (NH4)2CO3 → CaCO3↓ +
2NH4Cl
Ca2+ + CO32– → CaCO3↓
білий аморфний осад, розчинний в кислотах;
3)
Fe2(SO4)3
+ 3(NH4)2S → Fe2S3↓ +
3(NH4)2SO4
2Fe3+ + 3S2– → Fe2S3↓
чорний осад, розчинний в оцтовій і мінеральних кислотах.
№ 22
Що покладено в
основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з
розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових
реактивів на катіони: K+, Mn2+, Ca2+.
Зазначити
колір осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони
1-ї аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних
груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на
аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи
добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у
воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи
нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи збігається
з поділом на групи в Періодичному Законі. Особливо це стосується катіонів 1-ї,
2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені катіони тріад.
За визначенням,
до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних сполук
з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та амонію
добре розчинні у воді. Тому не існує групового реактиву, здатного осадити всі
катіони 1-ї аналітичної групи.
Рівняння реакцій:
1)
на іон
калію груповий реактив відсутній через належність вказаного катіона до 1-ї
аналітичної групи;
2) MnSO4
+ (NH4)2S → MnS↓ + (NH4)2SO4
Mn2+ + S2– → MnS↓
світло-рожевий осад, розчинний в кислотах;
3)
CaCl2 + (NH4)2CO3
→ CaCO3↓ + 2NH4Cl
Ca2+ + CO32– → CaCO3↓
білий аморфний осад, розчинний в кислотах.
№ 23
Що покладено в
основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з
розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових
реактивів на катіони: Na+, Cu2+, Zn2+.
Зазначити колір
осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї
аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних
груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на
аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи
добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у
воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи
нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи
збігається з поділом на групи в Періодичному Законі. Особливо це стосується
катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені
катіони тріад.
За визначенням,
до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних
сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та
амонію добре розчинні у воді. Тому не існує групового реактиву, здатного
осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1)
на іон
натрію груповий реактив відсутній через належність вказаного катіона до 1-ї
аналітичної групи;
2)
CuSO4
+ H2S → CuS↓ + H2SO4
Cu2+ + S2– → CuS↓
чорний осад, нерозчинний в розведених соляній та сірчаній кислотах, проте
розчинний в 2 н розчині азотної кислоти;
3)
ZnSO4
+ (NH4)2S → ZnS↓ + (NH4)2SO4
Zn2+ + S2– → ZnS↓
білий осад, нерозчинний в оцтовій кислоті, але розчинний в розведених
міне-ральних кислотах.
№ 24
Що покладено в
основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з
розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових
реактивів на катіони: Mg2+, Fe3+, Cu2+.
Зазначити колір
осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї
аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних
груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на
аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи
добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у
воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи
нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи
збігається з поділом на групи в Періодичному Законі. Особливо це стосується
катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені
катіони тріад.
За визначенням,
до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних
сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та
амонію добре розчинні у воді. Тому не існує групового реактиву, здатного
осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1)
Іноді Mg2+ відносять до 1-ї аналітичної групи,
на катіони якої не існує групового реактиву. Проте, карбонат амонію при
нагріванні з солями магнію і відсутності солей амонію осаджує магній у вигляді
білого аморфного осаду непостійного складу, найчастіше утворюється Mg(OH)2∙3MgCO3. Саме тому Mg2+ часто відносять до 2-ї аналітичної
групи;
2)
Fe2(SO4)3
+ 3(NH4)2S → Fe2S3↓ +
3(NH4)2SO4
2Fe3+ + 3S2– → Fe2S3↓
чорний осад, розчинний в оцтовій і мінеральних кислотах;
3)
CuSO4 + H2S
→ CuS↓ + H2SO4
Cu2+ + S2– → CuS↓
чорний осад, нерозчинний в розведених соляній та сірчаній кислотах, проте
розчинний в 2 н розчині азотної кислоти.
№ 25
Що покладено в
основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з
розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових
реактивів на катіони: NH4+, Cu2+, Mn2+.
Зазначити колір
осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї
аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних
груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на
аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи
добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у
воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи
нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи
збігається з поділом на групи в Періодичному Законі. Особливо це стосується
катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені
катіони тріад.
За визначенням,
до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних
сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та
амонію добре розчинні у воді. Тому не існує групового реактиву, здатного
осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1)
на іон
амонію груповий реактив відсутній через належність вказаного катіона до 1-ї
аналітичної групи;
2)
CuSO4
+ H2S → CuS↓ + H2SO4
Cu2+ + S2– → CuS↓
чорний осад, нерозчинний в розведених соляній та сірчаній кислотах, але
розчинний в 2 н розчині HNO3 ;
3) MnSO4
+ (NH4)2S → MnS↓ + (NH4)2SO4
Mn2+ + S2– → MnS↓
світло-рожевий осад, розчинний в кислотах.
№ 26
Що покладено в
основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з
розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових
реактивів на катіони: Ca2+, Mg2+, Zn2+.
Зазначити колір
осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї
аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних
груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на
аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи
добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у
воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи
нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи
збігається з поділом на групи в Періодичному Законі. Особливо це стосується
катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені
катіони тріад.
За визначенням,
до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних
сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та
амонію добре розчинні у воді. Тому не існує групового реактиву, здатного
осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1)
CaCl2 + (NH4)2CO3 → CaCO3↓ + 2NH4Cl
Ca2+ + CO32– → CaCO3↓
білий аморфний осад, розчинний в кислотах;
2)
іноді Mg2+ відносять до 1-ї аналітичної групи,
на катіони якої не існує групового реактиву. Проте, карбонат амонію при
нагріванні з солями магнію і відсутності солей амонію осаджує магній у вигляді
білого аморфного осаду непостійного складу. Найчастіше утворюється Mg(OH)2∙3MgCO3. Саме тому Mg2+ часто відносять до 2-ї аналітичної
групи;
3)
ZnSO4
+ (NH4)2S → ZnS↓ + (NH4)2SO4
Zn2+ + S2– → ZnS↓
білий осад, нерозчинний в оцтовій кислоті, проте розчинний в розведених мінеральних
кислотах.
№ 27
Що покладено в
основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з
розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових
реактивів на катіони: Na+, Ba2+, Al3+.
Зазначити колір
осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї
аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних
груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на
аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи
добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у
воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи
нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи
збігається з поділом на групи в Періодичному Законі. Особливо це стосується
катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені
катіони тріад.
За визначенням,
до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних
сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та
амонію добре розчинні у воді. Тому не існує групового реактиву, здатного
осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1)
на іон натрію груповий реактив відсутній через належність
вказаного катіона до 1-ї аналітичної групи;
2)
BaCl2
+ (NH4)2CO3 → BaCO3↓ +
2NH4Cl
Ba2+ + CO32– → BaCO3↓
білий аморфний осад, розчинний в кислотах, крім сірчаної;
3)
2AlCl3
+ 3(NH4)2S + 6H2O → 2Al(OH)3↓
+ 6NH4Cl + 3H2S↑
2Al3+ + 3S2– + 6HOH → 2Al(OH)3↓
+ 3H2S↑
осад білого кольору, що має амфотерні властивості.
№ 28
Що покладено в основу розподілу катіонів
на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в
періодичній системі Д.І. Менделєєва? Навести
молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: Mn2+, Fe2+, Na+.
Зазначити колір осаду,
розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї
аналітичної групи
Систематичний аналіз ділить всі катіони на 5 аналітичних
груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на
аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи
добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у
воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи
нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи
збігається з поділом на групи в Періодичному Законі. Особливо це стосується
катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені
катіони тріад.
За визначенням,
до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних
сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та
амонію добре розчинні у воді. Тому не існує групового реактиву, здатного
осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1)
MnSO4
+ (NH4)2S → MnS↓ + (NH4)2SO4
Mn2+ + S2– → MnS↓
світло-рожевий осад, розчинний в кислотах;
2) FeSO4 + (NH4)2S →
FeS↓ + (NH4)2SO4
Fe2+ + S2– → FeS↓
чорний осад, розчинний в кислотах;
3)
на іон
натрію груповий реактив відсутній через належність вказаного катіона до 1-ї
аналітичної групи.
№ 29
Що покладено в основу розподілу катіонів
на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в
періодичній системі Д.І. Менделєєва? Навести
молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: Mg2+, Fe3+, Cu2+.
Зазначити колір осаду,
розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї
аналітичної групи
Систематичний аналіз ділить всі катіони на 5 аналітичних
груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на
аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи
добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у
воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи
нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи
збігається з поділом на групи в Періодичному Законі. Особливо це стосується
катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені
катіони тріад.
За визначенням,
до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних
сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та
амонію добре розчинні у воді. Тому не існує групового реактиву, здатного
осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1)
Іноді Mg2+ відносять до 1-ї аналітичної групи,
на катіони якої не існує групового реактиву. Проте, карбонат амонію при
нагріванні з солями магнію і відсутності солей амонію осаджує магній у вигляді
білого аморфного осаду непостійного складу, найчастіше утворюється Mg(OH)2∙3MgCO3. Саме тому Mg2+ часто відносять до 2-ї аналітичної
групи;
2)
Fe2(SO4)3
+ 3(NH4)2S → Fe2S3↓ +
3(NH4)2SO4
2Fe3+ + 3S2– → Fe2S3↓
чорний осад, розчинний в оцтовій і мінеральних кислотах;
3)
CuSO4 + H2S
→ CuS↓ + H2SO4
Cu2+ + S2– → CuS↓
чорний осад, нерозчинний в розведених соляній і сірчаній кислотах, проте
розчинний в 2 н розчині азотної кислоти.
№ 30
Що покладено в основу розподілу катіонів
на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в
періодичній системі Д.І. Менделєєва? Навести
молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: Mn2+, Ba2+, NH4+. Зазначити колір
осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї
аналітичної групи
Систематичний аналіз ділить всі катіони на 5 аналітичних
груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на
аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи
добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у воді
карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи
нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у
воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи
збігається з поділом на групи в Періодичному Законі. Особливо це стосується
катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені
катіони тріад.
За визначенням,
до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних
сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та
амонію добре розчинні у воді. Тому не існує групового реактиву, здатного
осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1)
MnSO4 + (NH4)2S → MnS↓ + (NH4)2SO4
Mn2+ + S2– → MnS↓
світло-рожевий осад, розчинний в кислотах;
2)
BaCl2
+ (NH4)2CO3 → BaCO3↓ +
2NH4Cl
Ba2+ + CO32– → BaCO3↓
білий аморфний осад, розчинний в кислотах (крім сірчаної);
3) на іон амонію груповий
реактив відсутній через належність даного катіона до 1-ї аналітичної групи.
№ 35-36-37
Відповідно до номеру
завдання вказати, які з катіонів
NH4+, Na+, K+, Mg2+, Ca2+, Ba2+, Mn2+, Fe2+, Fe3+, Al3+, Cu2+, Zn2+
та за допомогою
яких специфічних реактивів визначають дробним аналізом. Напи-сати молекулярні
та іонні рівняння відповідних реакцій, казати умови виконання та зовнішній
ефект для катіонів 2-ї аналітичної
групи
Характерна
реакція на іон Ba2+:
К2Сr2O7
+ 2ВаСl2 + H2O + 2NaCH3COO → 2ВаСrO4
+ 2КСl + 2NaСl + 2CH3COOН
Основна умова –
присутність ацетату натрію. Хромати стронцію і кальцію, розчиняючись в оцтовій кислоті, не заважають виявленню іона Ba2+. Спостерігатиметься жовтий осад у присутності вказаного
іона.
Характерна
реакція на іон Ca2+:
CaSO4
+ K4[Fe(CN)6] → K2Ca[Fe(CN)6]↓
+ K2SO4
2K+
+ Ca2+ + [Fe(CN)6]4– → K2Ca[Fe(CN)6]↓
В даному випадку
утворюється білий осад фероціаніду калію і кальцію K2Ca[Fe(CN)6]. У присутності солей амонію
утворюється менш розчинна сіль фероціаніду кальцію, калію і амонію змінного
складу. Ця реакція виявляє іон кальцію у присутності іона Sr2+,
але іони Ba2+ в значних концентраціях можуть утворити аналогічні осади. Користуватись
даною реакцією для виявлення іонів кальцію в присутності іонів барію небажано.
Катіон Cu2+ теж можна виявити
дробним аналізом за допомогою надлишку гідроксиду амонію, проте вказаний катіон
не належить до 2-ї аналітичної групи.
№ 38-39-40
Відповідно до
номеру завдання вказати, які з катіонів
NH4+, Na+, K+, Mg2+, Ca2+, Ba2+, Mn2+, Fe2+, Fe3+, Al3+, Cu2+, Zn2+
та за допомогою
яких специфічних реактивів визначають дробним аналізом? Написати молекулярні та
іонні рівняння відповідних реакцій, вказати умови виконання та зовнішній ефект
для катіонів 3-ї аналітичної групи. Характерні реакції на катіони Fe2+ та
Fe3+:
3FeSO4
+ 2K3[Fe(CN)6] → Fe3[Fe(CN)6]2↓
+ 3K2SO4
3Fe2+
+ 2[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓
4FeCl3
+ 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3↓
+ 12KCl
4Fe3+
+ 3[Fe(CN)6]4– → Fe4[Fe(CN)6]3↓
В обох випадках
у присутності вказаних іонів випаде темно-синій осад, який відповідно має назву
“турнбульова синь” та “берлінська лазур”.
Характерна
реакція на катіон Mn2+:
2MnSO4
+ 5NaBiO3 + 16HNO3 → 2HMnO4 + 5Bi(NO3)3
+ 2Na2SO4 + NaNO3 + 7H2O
2Mn2+
+ 5BiO3‾ + 14H+ → 2MnO4‾ +
5Bi3+ + 7H2O
Умови: холодний
азотнокислий розчин. Зовнішній ефект – малиново-фіолетове забарвлення у
присутності іонів Mn2+.
Інша характерна
реакція на цей же катіон:
2MnSO4 +
5(NH4)2S2O8 + 8H2O →
2HMnO4 + 5(NH4)2SO4 + 7H2SO4
2Mn2+
+ 5S2O82– + 8HOH → 2MnO4‾
+ 12SO42– + 16H+
Умови:
присутність AgNO3. Зовнішній ефект: малиново-фіолетове забарвлення у присутності
іонів Mn2+. Буре забарвлення при надлишку вказаних іонів.
Характерна реакція
на катіон Zn2+:
ZnSO4 + H2S + 2CH3COONa → ZnS↓
+ 2CH3COOH + Na2SO4
Zn2+ + H2S + 2CH3COO‾ → ZnS↓ + 2CH3COOH
Умови: повне
осадження тільки за присутності ацетату лужного металу; середовище з РН 2–3.
Зовнішній ефект – білий осад ZnS у присутності іонів Zn2+.
Характерна
реакція на катіон Al3+:
NaAlO2
+ NH4Cl + 2H2O → Al(OH)3↓ + NH4OH
+ NaCl
AlO2‾
+ NH4+ + 2H2O → Al(OH)3↓
+ NH4OH
Умови: присутність
твердої солі NH4Cl. Зовнішній ефект – білий
осад Al(OH)3 у присутності іонів Al3+.
Катіон Cu2+ теж можна виявити
дробним аналізом за допомогою надлишку гідроксиду амонію, проте вказаний катіон
відносять не до 3-ї, а до 4-ї аналітичної групи.
№ 41
Дати обґрунтовану відповідь, який
висновок роблять за результатами дробного аналізу, якщо при дії на окрему
порцію розчину, що аналізується: гідроксиду калію чи натрію (при нагріванні)
виділяється газ з різким запахом, в присутності якого синіє червоний лакмусовий
папірець, змочений водою. Написати
молекулярне та іонне рівняння реакції відкриття встановленого катіону.
Зазначити умови її виконання
Це означає, що в
досліджуваному розчині присутні катіони амонію:
NH4Cl + KOH →
NH4OH + KCl
↨
NH3↑ + H2O
NH4+
+ OH– ↔
NH3↑
+ H2O
Умови –
нагрівання. Червоний лакмусовий папірець, змочений водою, синіє у присутності
пари аміаку, оскільки утворює з водою луг:
NH3 + H2O → NH4OH
№ 42
Дати обґрунтовану відповідь, який висновок роблять за
результатами дробного аналізу, якщо при дії на окрему порцію розчину, що
аналізується:
дихромату калію
(у присутності ацетату натрію) утворюється жовтий осад.
Написати
молекулярне та іонне рівняння реакції відкриття встановленого катіону.
Зазначити умови її виконання.
Це означає, що у
досліджуваному розчині присутні катіони Ва2+:
K2Cr2O7
+ 2BaCl2 + H2O + 2NaCH3COO → 2BaCrO4↓
+ 2KCl + 2NaCl + 2CH3COOH
2Ba2+ + Cr2O72–
+ 2CH3COO– + H2O → 2BaCrO4↓
+ 2CH3COOH
Основна умова –
присутність ацетату натрію. Хромати стронцію і кальцію, розчиняючись в оцтовій
кислоті, не заважають виявленню іона Ba2+.
№ 43-44
Дати обґрунтовану відповідь, який висновок роблять за результатами дробного
аналізу, якщо при дії на окрему порцію розчину, що аналізується: гексаціаноферату
(ІІІ) калію утворюється темно-синій осад. Написати молекулярне та іонне
рівняння реакції відкриття встановленого катіону. Зазначити умови її виконання
Це означає, що досліджуваний розчин містить катіони Fe2+:
3FeSO4
+ 2K3[Fe(CN)6] → Fe3[Fe(CN)6]2↓
+ 3K2SO4
3Fe2+ + 2[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓
Осад має назву “турнбульова синь”.
Умови:
нелужне середовище (нейтральне або слабокисле), оскільки вказаний осад розчинний
в лугах.
№ 45-46
Дати обґрунтовану відповідь, який
висновок роблять за результатами дробного аналізу, якщо при дії на окрему
порцію розчину, що аналізується: гексаціаноферату (ІІ) калію утворюється
темно-синій осад. Написати
молекулярне та іонне рівняння реакції відкриття встановленого катіону.
Зазначити умови її виконання
Це означає, що досліджуваний розчин містить катіони Fe3+:
4FeCl3 + 3K4[Fe(CN)6] →
Fe4[Fe(CN)6]3↓ + 12KCl
4Fe3+ + 3[Fe(CN)6]4– →
Fe4[Fe(CN)6]3↓
Осад має назву “берлінська лазур”.
Умови: не додавати надлишок реактиву; не додавати щавелеву
кислоту (осад в ній розчинний); нейтральне середовище.
№ 47-48
Дати обґрунтовану відповідь, який
висновок роблять за результатами дробного аналізу, якщо при дії на окрему
порцію розчину, що аналізується: вісмутату натрію в присутності HNO3
розчин забарвлюється в малиново-фіолетовий колір. Написати молекулярне та іонне
рівняння реакції відкриття встановленого катіону. Зазначити умови її виконання
Це означає присутність у досліджуваному розчині катіонів Mn2+:
2Mn(NO3)2
+ 5NaBiO3 + 14HNO3 → 2NaMnO4 + 3NaNO3
+ 5Bi(NO3)3
+ 7H2O
2
Mn2+
+ 4H2O – 5е– → MnO4– +
8H+
5 BiO3– + 6H+ + 2е–
→ Bi3+ + 3H2O
2Mn2+ + 5BiO3– + 14H+
→ 2MnO4– + 5Bi3+ + 7H2O
Умови: реакцію виконувати на холоді.
№ 49-50
Дати обґрунтовану відповідь, який
висновок роблять за результатами дробного аналізу, якщо при дії на окрему
порцію розчину, що аналізується: надлишку гідроксиду амонію утворюється розчин
координаційної сполуки інтенсивно-синього кольору. Написати молекулярне та
іонне рівняння реакції відкриття встановленого катіону. Зазначити умови її
виконання
Це означає присутність у досліджуваному розчині катіонів Cu2+:
2Cu2+
+ 2SO42– + 2NH4OH → [Cu(OH)]2SO4
+ 2NH4+ + SO42–
[Cu(OH)]2SO4 + 2NH4+
+ 6NH3 → 2[Cu(NH3)4]2+ + SO42–
+ 2H2O
Умови виконання реакції – непідкислений розчин.
№ 51
Скласти молекулярні та іонні рівняння
основних реакцій визначення катіонів Ca2+, Al3+. Навести умови виконання цих реакцій. Звернути увагу на
іони, що заважають визначенню
CaCl2 + (NH4)2C2O4 → CaC2O4↓
+ 2NH4Cl
Ca2+ + C2O42– → CaC2O4↓
Іони барію та
стронцію заважають виявленню іона Ca2+, так як дають з оксалатом амонію аналогічні
осади.
CaCl2 + K4[Fe(CN)6] → K2Ca[Fe(CN)6]↓ + 2KCl
2K+
+ Ca2+ + [Fe(CN)6]4– → K2Ca[Fe(CN)6]↓
Іони барію в
значних концентраціях можуть заважати визначенню іонів кальцію, так як
утворюють аналогічний осад.
NaAlO2 + NH4Cl + 2H2O → Al(OH)3↓
+ NaCl + NH4OH
AlO2‾
+ NH4+ + 2HOH → Al(OH)3↓ + NH4OH
Реакція йде за
присутності твердого хлориду амонію. Визначенню іонів Al3+ заважають іони Cr3+.
№ 52
Скласти молекулярні та іонні рівняння
основних реакцій визначення катіонів K+, Ca2+. Навести умови виконання цих реакцій. Звернути увагу на
іони, що заважають визначенню
KCl + NaHC4H4O6 → KHC4H4O6↓ + NaCl
K+ + HC4H4O6‾
→ KHC4H4O6↓
Умови:
нейтральний або оцтовокислий холодний розчин, велика концентрація іонів К+.
Заважають іони амонію.
2KNO3 + Na3[Co(NO2)6]
→ K2Na[Co(NO2)6]↓ + 2NaNO3
2K+
+ Na+ + [Co(NO2)6]3– → K2Na[Co(NO2)6]↓
Умови:
нейтральний чи оцтовокислий розчин. Заважають іони амонію.
CaSO4 + (NH4)2C2O4 → CaC2O4↓
+ (NH4)2SO4
Ca2+ + C2O42– → CaC2O4↓
Заважають іони
барію та стронцію, які з оксалатом амонію дають аналогічні осади.
CaCl2
+ K4[Fe(CN)6] → K2Ca[Fe(CN)6]↓
+ 2KCl
2K+
+ Ca2+ + [Fe(CN)6]4– → K2Ca[Fe(CN)6]↓
Іони барію в
значних концентраціях можуть заважати визначенню іонів кальцію, оскільки
утворюють аналогічний осад.
№ 53
Скласти молекулярні та іонні рівняння
основних реакцій визначення катіонів Na+, Zn2+. Навести умови виконання цих реакцій. Звернути увагу на
іони, що заважають визначенню
NaCl +
K[Sb(OH)6] → Na[Sb(OH)6]↓ + KCl
Na+
+ [Sb(OH)6]‾ → Na[Sb(OH)6]↓
Умови:
нейтральне або слабколужне середовище, досить висока концентрація солі натрію,
холодний розчин. Солі амонію заважають даній реакції тому що гідролізують,
результуючи іони водню. Реактив K[Sb(OH)6] у присутності солей амонію розкладається так
само, як при дії кислот.
Na+
+ Zn[(UO2)3(CH3COO)8] + CH3COO‾
+ 9H2O →
→
NaZn[(UO2)3(CH3COO)9]∙9H2O↓
Умови: нейтральний
або оцтовокислий розчин.
ZnSO4
+ H2S + 2CH3COONa → ZnS↓ + 2CH3COOH
+ Na2SO4
Zn2+
+ H2S + 2CH3COO‾ → ZnS↓ + 2CH3COOH
Осад ZnS розчинний в мінеральних кислотах. В даній реакції
присутність ацетату натрію необхідна тому що сильна кислота HCl, яка утворюється без його присутності, замінюється на слабку CH3COOH, в якій ZnS не розчиняється. Заважають іони Co2+ та Ni2+ якщо рН розчину не дорівнює 2.
№ 54
Скласти молекулярні та іонні рівняння
основних реакцій визначення катіонів Mg2+, Al3+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають
визначенню
MgSO4
+ 2NH4OH ↔ Mg(OH)2↓ + (NH4)2SO4
Mg2+
+ 2NH4OH ↔ Mg(OH)2↓ + 2NH4+
Іони амонію
заважають визначеннню іонів магнію.
NaAlO2 + NH4Cl + 2H2O → Al(OH)3↓
+ NaCl + NH4OH
AlO2‾
+ NH4+ + 2HOH → Al(OH)3↓ + NH4OH
Умови:
присутність твердого хлориду амонію. Іони Cr3+ заважають визначенню іонів Al3+.
№ 55
Скласти молекулярні та іонні рівняння
основних реакцій визначення катіонів Na+, Al3+. Навести умови виконання цих реакцій. Звернути увагу на
іони, що заважають визначенню
NaCl +
K[Sb(OH)6] → Na[Sb(OH)6]↓ + KCl
Na+
+ [Sb(OH)6]‾ → Na[Sb(OH)6]↓
Умови:
нейтральне або слабколужне середовище, досить висока концентрація солі натрію,
холодний розчин.
Солі амонію
заважають даній реакції тому що гідролізують, результуючи іони водню. Реактив K[Sb(OH)6] у присутності солей амонію розкладається так
само, як при дії кислот.
Na+
+ Zn[(UO2)3(CH3COO)8] + CH3COO‾
+ 9H2O →
→
NaZn[(UO2)3(CH3COO)9]∙9H2O↓
Умови:
нейтральний або оцтовокислий розчин.
NaAlO2 + NH4Cl + 2H2O → Al(OH)3↓
+ NaCl + NH4OH
AlO2‾
+ NH4+ + 2HOH → Al(OH)3↓ + NH4OH
Реакція йде за
присутності твердого хлориду амонію. Визначенню іонів Al3+ заважають
іони Cr3+.
№ 56
Скласти молекулярні та іонні рівняння
основних реакцій визначення катіонів Ca2+, Zn2+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають
визначенню
CaSO4
+ (NH4)2C2O4 → CaC2O4↓
+ (NH4)2SO4
Ca2+ + C2O42– → CaC2O4↓
Виявленню іонів
кальцію заважають іони барію та стронцію, які дають з оксалатом амонію
аналогічні осади.
CaCl2 + K4[Fe(CN)6] → K2Ca[Fe(CN)6]↓ + 2KCl
2K+
+ Ca2+ + [Fe(CN)6]4– → K2Ca[Fe(CN)6]↓
Іони барію в
значних концентраціях можуть заважати визначенню іонів кальцію, оскільки дають
аналогічні осади.
ZnSO4
+ H2S + 2CH3COONa → ZnS↓ + 2CH3COOH
+ Na2SO4
Zn2+ + H2S + 2CH3COO‾ → ZnS↓ + 2CH3COOH
Осад ZnS розчинний в мінеральних кислотах. В даній реакції присутність ацетату
натрію необхідна тому що сильна кислота HCl, яка
утворюється без його присутності, замінюється на слабку CH3COOH, в якій ZnS не розчиняється.
Заважають іони Co2+ та Ni2+ якщо рН розчину не
дорівнює 2.
№ 57
Скласти молекулярні та іонні рівняння
основних реакцій визначення катіонів K+, Al3+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають
визначенню
KCl + NaHC4H4O6 → KHC4H4O6↓ + NaCl
K+ + HC4H4O6‾
→ KHC4H4O6↓
Умови :
нейтральний або оцтовокислий розчин, велика концентрація іонів К+,
холодний розчин. Іони амонію заважають виявленню іонів калію.
2KNO3
+ Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2NaNO3
2K+
+ Na+ + [Co(NO2)6]3– → K2Na[Co(NO2)6]↓
Умови:
нейтральний або оцтовокислий розчин. Іони амонію заважають визначенню іонів
калію.
NaAlO2 + NH4Cl + 2H2O → Al(OH)3↓
+ NaCl + NH4OH
AlO2‾
+ NH4+ + 2HOH → Al(OH)3↓ + NH4OH
Умови:
присутність твердого хлориду амонію. Іони Cr3+ заважають
визначенню іонів Al3+.
№ 58
Скласти молекулярні та іонні рівняння
основних реакцій визначення катіонів Zn2+, Na+. Навести умови виконання цих реакцій. Звернути увагу на
іони, що заважають визначенню
ZnSO4
+ H2S + 2CH3COONa → ZnS↓ + 2CH3COOH
+ Na2SO4
Zn2+
+ H2S + 2CH3COO‾ → ZnS↓ + 2CH3COOH
Осад ZnS розчинний в мінеральних кислотах. В даній реакції
присутність ацетату натрію необхідна тому що сильна кислота HCl, яка утворюється без його присутності, замінюється на слабку CH3COOH, в якій ZnS не розчиняється.
Заважають іони Co2+ та Ni2+ якщо рН розчину не дорівнює 2.
NaCl +
K[Sb(OH)6] → Na[Sb(OH)6]↓ + KCl
Na+
+ [Sb(OH)6]‾ → Na[Sb(OH)6]↓
Умови:
нейтральне або слабколужне середовище, досить висока концентрація солі натрію,
холодний розчин.
Солі амонію
заважають даній реакції тому що гідролізують, результуючи іони водню. Реактив K[Sb(OH)6] у присутності солей амонію розкладається так
само, як при дії кислот.
Na+
+ Zn[(UO2)3(CH3COO)8] + CH3COO‾
+ 9H2O →
→ NaZn[(UO2)3(CH3COO)9]∙9H2O↓
Умови:
нейтральний або оцтовокислий розчин.
№ 59
Скласти молекулярні та іонні рівняння
основних реакцій визначення катіонів Mg2+, Na+. Навести умови виконання цих реакцій. Звернути увагу на
іони, що заважають визначенню
MgSO4 + 2NH4OH ↔ Mg(OH)2↓ + (NH4)2SO4
Mg2+
+ 2NH4OH ↔ Mg(OH)2↓ + 2NH4+
Іони амонію
заважають визначенню іонів магнію.
NaCl + K[Sb(OH)6] → Na[Sb(OH)6]↓
+ KCl
Na+
+ [Sb(OH)6]‾ → Na[Sb(OH)6]↓
Умови:
нейтральне або слабколужне середовище, досить висока концентрація солі натрію, холодний
розчин.
Солі амонію
заважають даній реакції тому що гідролізують, результуючи іони водню. Реактив K[SB(OH)6] у присутності солей амонію розкладається так
само, як при дії кислот.
Na+
+ Zn[(UO2)3(CH3COO)8] + CH3COO‾
+ 9H2O →
→ NaZn[(UO2)3(CH3COO)9]∙9H2O↓
Умови:
нейтральний або оцтовокислий розчин.
№ 60
Скласти молекулярні та іонні рівняння
основних реакцій визначення катіонів Ca2+, Mg2+. Навести умови виконання цих реакцій. Звернути увагу на
іони, що заважають визначенню
CaSO4
+ (NH4)2C2O4 → CaC2O4↓
+ (NH4)2SO4
Ca2+
+ C2O42– → CaC2O4↓
Виявленню іонів
кальцію заважають іони барію та стронцію, які дають з оксалатом амонію
аналогічні осади.
CaCl2 + K4[Fe(CN)6] → K2Ca[Fe(CN)6]↓ + 2KCl
2K+
+ Ca2+ + [Fe(CN)6]4– → K2Ca[Fe(CN)6]↓
Іони барію в
значних концентраціях можуть заважати визначенню іонів кальцію, так як
утворюють аналогічні осади.
MgSO4
+ 2NH4OH ↔ Mg(OH)2↓ + (NH4)2SO4
Mg2+
+ 2NH4OH ↔ Mg(OH)2↓ + 2NH4+
Іони амонію
заважають визначенню іонів магнію.
№ 61
Принцип аналітичної класифікації аніонів. До яких аналітичних груп належать
аніони SO42–, PO43–, CO32–,Cl‾,
Br‾, I‾, NO2‾, NO3‾ ?
Написати молекулярні та іонні рівняння реакцій дії групових реактивів,
якщо в розчині присутні такі аніони: SO42– , I‾, NO2‾.
Зазначити колір осадів, розчинність
Поділ аніонів на аналітичні
групи оснований на різній розчинності солей барію і солей срібла:
І група – аніони, солі барію
яких важкорозчинні у воді;
ІІ група – аніони, солі
срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) Na2SO4 + BaCl2 ↔ BaSO4↓ + 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Білий кристалічний осад, практично нерозчинний у воді і кислотах.
2) KI + AgNO3 ↔ KNO3 + AgI↓
I‾ + Ag+ ↔ AgI↓
Осад жовтого кольору, розчинний в тіосульфаті натрію і ціаніді калію, але
нерозчинний в гідроксиді амонію.
3) На аніон NO2‾ груповий реактив
відсутній через належність вказаного аніона до ІІІ аналітичної групи.
№ 62
Принцип аналітичної
класифікації аніонів. До яких аналітичних груп належать аніони SO42–,
PO43–, CO32–,Cl‾, Br‾,
I‾, NO2‾, NO3‾ ? Написати молекулярні
та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі
аніони: PO43–, Cl‾, NO3‾. Зазначити
колір осадів, розчинність
Поділ аніонів на аналітичні
групи оснований на різній розчинності солей барію і солей срібла:
І група – аніони, солі барію
яких важкорозчинні у воді;
ІІ група – аніони, солі
срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1)
Серед
фосфатів добре розчинними у воді є лише фосфати лужних металів та однозаміщені
фосфати лужноземельних металів. Тому, з нейтральних розчинів
хлорид барію осаджує білий гідрофосфат барію за рівнянням:
HPO42– + Ba2+ ↔ BaHPO4↓
З лужних розчинів осаджується білий фосфат барію:
2PO43– + 3Ba2+ ↔ Ba3(PO4)2↓
Обидва осади розчинні в оцтовій та мінеральних кислотах.
2) KCl + AgNO3 ↔ KNO3 + AgCl↓
Cl‾ + Ag+ ↔ AgCl↓
Білий сирнистий осад, нерозчинний в розведених кислотах, але добре розчинний
в гідроксиді та карбонаті амонію. Подано лише перше рівняння реакції. Фактично
вказаний осад оброблюють або 10%-ним розчином (NH4)2CO3
або 2 н. розчином NH4OH до отримання прозорого розчину, потім по
краплях додають 2 н. розчин НNO3 до кислої реакції. В присутності
іонів Cl‾ знову випадає осад AgCl.
3) На аніон NO3‾ груповий реактив
відсутній через належність вказаного аніона до ІІІ аналітичної групи.
№ 63
Принцип аналітичної
класифікації аніонів. До яких аналітичних груп належать аніони SO42–,
PO43–, CO32–,Cl‾, Br‾,
I‾, NO2‾, NO3‾ ? Написати молекулярні
та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі
аніони: CO32–, Br‾, SO42–. Зазначити
колір осадів, розчинність
Поділ аніонів на аналітичні
групи оснований на різній розчинності солей барію і солей срібла:
І група – аніони, солі барію
яких важкорозчинні у воді;
ІІ група – аніони, солі
срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) Na2CO3 + BaCl2 ↔ BaCO3↓ + 2NaCl
CO32– + Ba2+ ↔ BaCO3↓
Об’ємистий білий осад, практично нерозчинний у воді, але розчинний в азотній
кислоті.
2) KBr + AgNO3 ↔ KNO3 + AgBr↓
Br‾ + Ag+ ↔ AgBr↓
Жовтуватий сирнистий осад, нерозчинний в азотній кислоті, але розчинний в
гідроксиді амонію, тіосульфаті натрію та ціаніді калію. Подано лише перше рівняння
реакції. Фактично вказаний осад оброблюють 2 н. розчином NH4OH до
отримання прозорого розчину, потім по краплях додають 2 н. розчин НNO3
до кислої реакції. В присутності іонів Br‾ знову випадає осад AgBr.
3)Na2SO4 + BaCl2 ↔ BaSO4↓
+ 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Білий кристалічний осад, практично нерозчинний у воді і кислотах.
№ 64
Принцип аналітичної
класифікації аніонів. До яких аналітичних груп належать аніони SO42–,
PO43–, CO32–,Cl‾, Br‾,
I‾, NO2‾, NO3‾ ? Написати молекулярні
та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі
аніони: Cl‾, PO43–, CO32–. Зазначити
колір осадів, розчинність
Поділ аніонів на аналітичні
групи оснований на різній розчинності солей барію і солей срібла:
І група – аніони, солі барію
яких важкорозчинні у воді;
ІІ група – аніони, солі
срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) KCl + AgNO3 ↔ KNO3 + AgCl↓
Cl‾ + Ag+ ↔ AgCl↓
Білий сирнистий осад, нерозчинний в розведених кислотах, але добре розчинний
в гідроксиді та карбонаті амонію. Подано лише перше рівняння реакції. Фактично
вказаний осад оброблюють або 10%-ним розчином (NH4)2CO3
або 2 н. розчином NH4OH до отримання прозорого розчину, потім по
краплях додають 2 н. розчин НNO3 до кислої реакції. В присутності
іонів Cl‾ знову випадає осад AgCl.
2)
Серед
фосфатів добре розчинними у воді є лише фосфати лужних металів та однозаміщені
фосфати лужноземельних металів. Тому з нейтральних розчинів
осаджується білий гідрофосфат барію:
HPO42– + Ba2+ ↔ BaHPO4↓
З лужних розчинів осаджується білий фосфат барію:
2PO43– + 3Ba2+ ↔ Ba3(PO4)2↓
Обидва осади розчинні в оцтовій та мінеральних кислотах.
3) Na2CO3 + BaCl2 ↔
BaCO3↓ + 2NaCl
CO32– + Ba2+ ↔ BaCO3↓
Об’ємистий білий
осад, практично нерозчинний у воді, але розчинний в азотній кислоті.
№ 65
Принцип аналітичної класифікації аніонів. До яких аналітичних груп належать
аніони SO42–, PO43–, CO32–,Cl‾,
Br‾, I‾, NO2‾, NO3‾ ? Написати
молекулярні та іонні рівняння реакцій дії групових реактивів, якщо в розчині
присутні такі аніони: I‾, SO42–, NO3‾.
Зазначити колір осадів, розчинність
Поділ аніонів на аналітичні
групи оснований на різній розчинності солей барію і солей срібла:
І група – аніони, солі барію
яких важкорозчинні у воді;
ІІ група – аніони, солі
срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) KI + AgNO3 ↔ KNO3 + AgI↓
I‾ + Ag+ ↔ AgI↓
Осад жовтого кольору, розчинний в тіосульфаті натрію і ціаніді калію,
проте нерозчинний в гідроксиді амонію.
2) Na2SO4
+ BaCl2 ↔ BaSO4↓ + 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Білий кристалічний осад, практично нерозчинний у воді і кислотах.
3) На аніон NO3‾ груповий реактив
відсутній через належність даного аніона до ІІІ аналітичної групи.
№ 66
Принцип аналітичної
класифікації аніонів. До яких аналітичних груп належать аніони SO42–,
PO43–, CO32–,Cl‾, Br‾,
I‾, NO2‾, NO3‾ ?
Написати молекулярні та іонні
рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: NO3‾,
Br‾, PO43–.
Зазначити колір осадів,
розчинність
Поділ аніонів на аналітичні
групи оснований на різній розчинності солей барію і солей срібла:
І група – аніони, солі барію
яких важкорозчинні у воді;
ІІ група – аніони, солі
срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) На аніон NO3‾ груповий реактив
відсутній через належність даного аніона до ІІІ аналітичної групи.
2) KBr + AgNO3 ↔ KNO3 + AgBr↓
Br‾ + Ag+ ↔ AgBr↓
Жовтуватий сирнистий осад, нерозчинний в азотній кислоті, але розчинний в
гідроксиді амонію, тіосульфаті натрію та ціаніді калію. Подано лише перше рівняння
реакції. Фактично вказаний осад оброблюють 2 н. розчином NH4OH до
отримання прозорого розчину, потім по краплях додають 2 н. розчин НNO3
до кислої реакції. В присутності іонів Br‾ знову випадає осад AgBr.
3) Серед фосфатів добре розчинними у воді є лише фосфати лужних металів
та однозаміщені фосфати лужноземельних металів. Тому, з нейтральних
розчинів осаджується білий гідрофосфат барію:
HPO42– + Ba2+ ↔ BaHPO4↓
З лужних розчинів осаджується білий фосфат барію:
2PO43– + 3Ba2+ ↔ Ba3(PO4)2↓
Обидва осади розчинні в оцтовій і мінеральних кислотах.
№ 67
Принцип аналітичної
класифікації аніонів. До яких аналітичних груп належать аніони SO42–,
PO43–, CO32–,Cl‾, Br‾,
I‾, NO2‾, NO3‾ ?
Написати молекулярні та іонні
рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: PO43–,
Cl‾, CO32–.
Зазначити колір осадів, розчинність
Поділ аніонів на аналітичні
групи оснований на різній розчинності солей барію і солей срібла:
І група – аніони, солі барію
яких важкорозчинні у воді;
ІІ група – аніони, солі
срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) Серед фосфатів добре
розчинними у воді є лише фосфати лужних металів та однозаміщені фосфати
лужноземельних металів. Тому, з нейтральних розчинів осаджується
білий гідрофосфат барію:
HPO42– + Ba2+ ↔ BaHPO4↓
З лужних розчинів осаджується білий фосфат барію:
2PO43– + 3Ba2+ ↔ Ba3(PO4)2↓
Обидва осади розчинні в
оцтовій та мінеральних кислотах.
2) KCl + AgNO3 ↔ KNO3 + AgCl↓
Cl‾ + Ag+ ↔ AgCl↓
Білий сирнистий осад, нерозчинний в розведених кислотах, але добре розчинний
в гідроксиді та карбонаті амонію. Подано лише перше рівняння реакції. Фактично
вказаний осад оброблюють або 10%-ним розчином (NH4)2CO3
або 2 н. розчином NH4OH до отримання прозорого розчину, потім по
краплях додають 2 н. розчин НNO3 до кислої реакції. В присутності
іонів Cl‾ знову випадає осад AgCl.
3) Na2CO3 + BaCl2 ↔ BaCO3↓ + 2NaCl
CO32– + Ba2+ ↔ BaCO3↓
Об’ємистий білий
осад, практично нерозчинний у воді, проте розчинний в азотній кислоті.
№ 68
Принцип аналітичної
класифікації аніонів. До яких аналітичних груп належать аніони SO42–,
PO43–, CO32–,Cl‾, Br‾,
I‾, NO2‾, NO3‾ ?
Написати молекулярні та іонні
рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: I‾,
CO32–, NO3‾.
Зазначити колір осадів, розчинність
Поділ аніонів на аналітичні
групи оснований на різній розчинності солей барію і солей срібла:
І група – аніони, солі барію
яких важкорозчинні у воді;
ІІ група – аніони, солі
срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) KI + AgNO3 ↔ KNO3 + AgI↓
I‾ + Ag+ ↔ AgI↓
Осад жовтого
кольору, розчинний в тіосульфаті натрію і ціаніді калію, проте нерозчинний в
гідроксиді амонію.
2) Na2CO3 + BaCl2 ↔
BaCO3↓ + 2NaCl
CO32– + Ba2+ ↔ BaCO3↓
Об’ємистий білий
осад, практично нерозчинний у воді, проте розчинний в азотній кислоті.
3) На аніон NO3‾ груповий реактив
відсутній через належність даного аніона до ІІІ аналітичної групи.
№ 69
Принцип аналітичної
класифікації аніонів. До яких аналітичних груп належать аніони SO42–,
PO43–, CO32–,Cl‾, Br‾,
I‾, NO2‾, NO3‾ ?
Написати молекулярні та іонні
рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: NO2‾,
I‾, SO42–.
Зазначити колір осадів, розчинність
Поділ аніонів на аналітичні
групи оснований на різній розчинності солей барію і солей срібла:
І група – аніони, солі барію
яких важкорозчинні у воді;
ІІ група – аніони, солі
срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32 належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) На аніон NO2‾ груповий реактив відсутній
через належність даного аніона до ІІІ аналітичної групи.
2) KI +
AgNO3 ↔ KNO3 + AgI↓
I‾
+ Ag+ ↔ AgI↓
Осад жовтого кольору, розчинний в тіосульфаті натрію і ціаніді калію,
проте нерозчинний в гідроксиді амонію.
3) Na2SO4 + BaCl2 ↔ BaSO4↓ + 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Білий кристалічний осад, практично нерозчинний у воді і кислотах.
№ 70
Принцип аналітичної
класифікації аніонів. До яких аналітичних груп належать аніони SO42–,
PO43–, CO32–,Cl‾, Br‾,
I‾, NO2‾, NO3‾ ?
Написати молекулярні та іонні
рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: SO42– , PO43– , Cl‾.
Зазначити колір осадів, розчинність
Поділ аніонів на аналітичні
групи оснований на різній розчинності солей барію і солей срібла:
І група – аніони, солі барію
яких важкорозчинні у воді;
ІІ група – аніони, солі
срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) Na2SO4 + BaCl2 ↔ BaSO4↓ + 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Білий кристалічний осад, практично нерозчинний у воді і в кислотах.
2) Серед фосфатів добре розчинними у воді є лише фосфати лужних металів
та однозаміщені фосфати лужноземельних металів. Тому, з нейтральних розчинів
хлорид барію осаджує білий гідрофосфат барію за рівнянням:
HPO42– + Ba2+ ↔ BaHPO4↓
З лужних розчинів осаджується білий фосфат барію:
2PO43– + 3Ba2+ ↔ Ba3(PO4)2↓
Обидва осади розчинні в оцтовій та мінеральних кислотах.
3) KCl + AgNO3 ↔ KNO3 + AgCl↓
Cl‾ + Ag+ ↔ AgCl↓
Білий сирнистий осад, нерозчинний в розведених кислотах, але добре розчинний
в гідроксиді та карбонаті амонію. Подано лише перше рівняння реакції. Фактично
вказаний осад оброблюють або 10%-ним розчином (NH4)2CO3
або 2 н. розчином NH4OH до отримання прозорого розчину, потім по
краплях додають 2 н. розчин НNO3 до кислої реакції. В присутності
іонів Cl‾ знову випадає осад AgCl.
№ 71-72
Пояснити, чому
відсутній груповий реактив на аніони третьої аналітичної групи
До ІІІ аналітичної групи належать аніони NO2‾ , NO3‾
, ClO3‾ , ClО4‾ , CH3COO‾.
Всі солі барію і срібла вказаних аніонів добре розчинні у воді, тому груповими
реактивами – хлоридом барію і нітратом срібла вони не осаджуються.
№ 73-74-75
Дати мотивовану відповідь, чи можна замість BaCl2 використовувати для осадження
аніонів першої аналітичної групи інші солі барію. Скласти відповідні рівняння
реакцій
Крім BaCl2 можна використовувати ВаBr2,
ВаI2 та Ва(NO3)2. Всі три названі солі добре
розчинні у воді і дадуть з аніонами I-ї аналітичної групи аналогічні осади:
Na2SO4 + ВаBr2 ↔ ВаSO4↓
+ 2NaBr
Na2SO4 + ВаI2 ↔ ВаSO4↓
+ 2NaІ
Na2SO4 + Ва(NO3)2 ↔
ВаSO4↓ + 2NaNO3
№ 76-77-78
Чому осадження аніонів другої аналітичної групи за допомогою групового реактиву
проводять в присутності НNO3? Відповідь обґрунтувати рівняннями реакцій
До ІІ-ї аналітичної групи
належать аніони, які утворюють з катіонами срібла солі, важкорозчинні у воді і
у розведеній азотній кислоті. Фактично реакцію на аніони ІІ-ї аналітичної групи
проводять таким чином: до 2-3 крапель досліджуваного розчину додають 2-3 краплі
0,1 н розчину AgNO3; осад відділяють і оброблюють 2-3
краплями 2 н розчину NH4OH і/або 10%-го розчину (NH4)2CO3.
На цьому етапі роблять висновок, який саме аніон присутній в досліджуваному
розчині: хлорид срібла добре розчинний і в NH4OH і в (NH4)2CO3.
Бромід срібла малорозчинний в NH4OH і нерозчинний в (NH4)2CO3.
Йодиди і сульфіди срібла нерозчинні ні в розчині аміаку, ні в карбонаті амонію.
Отримавши там, де це можливо, прозорий розчин, до нього додають по краплях
розчин НNO3 до кислої реакції (проба на лакмус). В присутності іонів
Cl‾ і Br‾ знову випадають аналогічні осади AgCl та AgBr.
Рівняння реакцій подаю на прикладі виявлення аніона Cl‾ :
1) NaCl + AgNO3 ↔ NaNO3 + AgCl↓
Ag+ + Cl‾ ↔ AgCl↓
2) AgCl
+ 2NH4OH → [Ag(NH3)2]+ + Cl‾
+ 2H2O
3) [Ag(NH3)2]Cl
+ 2HNO3 → AgCl↓ + 2NH4NO3
[Ag(NH3)2]+ + Cl‾ + 2H+ → AgCl↓ + 2NH4+
№ 79-80
Пояснити, як
можна відокремити аніони ІІІ аналітичної групи від аніонів І та ІІ аналітичних
груп. Скласти відповідні рівняння реакцій
Припускаємо, що в розчині є суміш аніонів І, ІІ, та ІІІ аналітичних груп.
Як відомо, на аніони ІІІ аналітичної групи не існує групового реактиву.
Через це, краще спершу дробними реакціями видалити з розчину
аніони ІІІ аналітичної групи, потім вже груповими реактивами
виявляти аніони І та ІІ аналітичних груп.
Спочатку
видалимо нітрит-іон в присутності нітрат-іона за допомогою NH4Cl:
NO2‾ + NH4+ → N2↑ + 2H2O
Потім видалимо
нітрат-іон:
2NO3‾ + 3Cu + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
2NO + O2(повітря) → 2NO2↑(бурий газ)
Після видалення з розчину вищезазначених аніонів практичної потреби у видаленні
інших аніонів ІІІ аналітичної групи не виникає, тому, після вказаної
процедури можна вважати, що в розчині залишилась суміш аніонів І та ІІ
аналітичних груп.
№ 81
Скласти молекулярні та іонні
рівняння основних реакцій визначення аніонів PO43–, I– , SO42–. Навести умови їх виконання
та зовнішній ефект, який супроводжує перебіг даних реакцій.
Характерна реакція на фосфат-іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект
– жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при нагріванні.
Характерні реакції на йодид-іон:
2NaI + Cl2 → I2 + 2NaCl
2I‾
+ Cl2 → I2 + 2Cl‾
Вільний йод, що виділяється, можна виявити за допомогою крохмалю (синє
забарвлення) або бензолу (червоно-фіолетове забарвлення).
2KI + 2HNO2 + H2SO4 → I2 + 2NO↑ + K2SO4 + 2H2O
2I‾ + 2NO2‾ + 4H+ → I2 + 2NO↑ + 2H2O
Умови: кисле середовище. Зовнішній ефект – синє забарвлення розчину в
присутності йодид-іонів.
Характерна реакція на сульфат-іон:
Na2SO4 + BaCl2 ↔ BaSO4↓
+ 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Умови: додавання кількох крапель 2 н розчину HNO3 перед вливанням розчину хлориду
барію. Зовнішній ефект: білий кристалічний осад сульфату барію.
№ 82
Скласти молекулярні та іонні
рівняння основних реакцій визначення аніонів PO43–, Cl‾ , NO3‾ .
Навести умови їх
виконання та зовнішній ефект, який супроводжує перебіг даних реакцій
Характерна реакція на фосфат-іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект
– жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при
нагріванні.
Визначення хлорид-іону за допомогою групового реактиву:
KCl + AgNO3 ↔ AgCl↓ + KNO3
Cl‾ + Ag+ ↔ AgCl↓
Умови: азотнокисле середовище. Зовнішній ефект – білий сирнистий осад хлориду
срібла.
Характерна реакція на хлорид-іон:
NaCl + H2SO4(конц.) ↔ NaHSO4 + HCl↑
Умова: нагрівання. Зовнішній ефект – специфічний запах хлороводню.
Характерна реакція на нітрат-іон:
2KNO3 + 3Cu + 4H2SO4 →
3CuSO4 + 2NO↑ + K2SO4 + 4H2O
2NO3‾ + 3Cu + 8H+ → 3Cu2+
+ 2NO↑ + 4H2O
2NO + O2(повітря) → 2NO2↑
Умови: сірчанокисле середовище. Зовнішній ефект – бурий газ NO2.
№ 83
Скласти молекулярні та іонні рівняння
основних реакцій визначення аніонів SO42–, NO2‾, PO43–. Навести умови їх виконання та зовнішній ефект, який
супроводжує перебіг даних реакцій
Характерна реакція на сульфат-іон:
Na2SO4 + BaCl2 ↔ BaSO4↓
+ 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Умови: додавання кількох крапель 2 н розчину HNO3 перед вливанням розчину хлориду
барію. Зовнішній ефект: білий кристалічний осад сульфату барію.
Характерні реакції на нітрит-іон:
NaNO2 + H2SO4 → NaHSO4
+ HNO2
3HNO2 → HNO3 + 2NO↑
+ H2O
2NO + O2(повітря) → 2NO2↑
Реакцію вести на холоді. Зовнішній ефект – бурий газ NO2.
2KMnO4 + 5NaNO2 + 3H2SO4
→ 2MnSO4 + 5NaNO3 + K2SO4 +
3H2O
5NO2‾ + 2MnO4‾ + 6H+
→ 2Mn2+ + 5NO3‾ + 3H2O
Умови: сірчанокисле середовище. Зовнішній ефект: рожеве забарвлення
розчину.
Характерна реакція на фосфат іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект
– жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при нагріванні.
№ 84
Скласти молекулярні та іонні
рівняння основних реакцій визначення аніонів Cl‾ , PO43–, NO2‾. Навести умови їх виконання та зовнішній
ефект, який супроводжує перебіг даних реакцій
Визначення хлорид-іону за допомогою групового реактиву:
KCl + AgNO3 ↔ AgCl↓ + KNO3
Cl‾ + Ag+ ↔ AgCl↓
Умови:
азотнокисле середовище. Зовнішній ефект – білий сирнистий осад хлориду срібла.
Характерна реакція на хлорид-іон:
NaCl + H2SO4(конц.) ↔ NaHSO4 + HCl↑
Умова: нагрівання. Зовнішній ефект – специфічний запах хлороводню.
Характерна реакція на фосфат-іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект
– жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при нагріванні.
Характерні реакції на нітрит-іон:
NaNO2 + H2SO4 → NaHSO4
+ HNO2
3HNO2 → HNO3 + 2NO↑ + H2O
2NO + O2(повітря) → 2NO2↑
Реакцію вести на холоді. Зовнішній ефект – бурий газ NO2.
2KMnO4 + 5NaNO2 + 3H2SO4
→ 2MnSO4 + 5NaNO3 + K2SO4 +
3H2O
5NO2‾ + 2MnO4‾ + 6H+
→ 2Mn2+ + 5NO3‾ + 3H2O
Умови: сірчанокисле середовище. Зовнішній ефект: рожеве забарвлення
розчину.
№ 85
Скласти молекулярні та іонні рівняння основних реакцій визначення аніонів
I–, SO42–, NO3‾ Навести умови їх виконання та
зовнішній ефект, який супроводжує перебіг даних реакцій
Характерні реакції на йодид-іон:
2NaI + Cl2 → I2 + 2NaCl
2I‾
+ Cl2 → I2 + 2Cl‾
Вільний йод,
що виділяється, можна виявити за допомогою крохмалю (синє забарвлення) або
бензолу (червоно-фіолетове забарвлення).
2KI + 2HNO2 + H2SO4 → I2 + 2NO↑ + K2SO4 + 2H2O
2I‾ + 2NO2‾ + 4H+ → I2 + 2NO↑ + 2H2O
Умови: кисле середовище. Зовнішній ефект – синє забарвлення розчину в присутності
йодид-іонів.
Характерна реакція на сульфат-іон:
Na2SO4 + BaCl2 ↔ BaSO4↓
+ 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Умови: додавання кількох крапель 2н розчину HNO3 перед вливанням розчину хлориду
барію. Зовнішній ефект: білий кристалічний осад сульфату барію.
Характерна реакція на нітрат-іон:
2KNO3 + 3Cu + 4H2SO4 → 3CuSO4 + 2NO↑ + K2SO4 + 4H2O
2NO3‾ + 3Cu + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
2NO + O2(повітря) → 2NO2↑
Умови: сірчанокисле середовище. Зовнішній ефект – бурий газ NO2.
№ 86
Скласти молекулярні та іонні
рівняння основних реакцій визначення аніонів NO3‾ , NO2‾ , PO43–. Навести умови їх виконання
та зовнішній ефект, який супроводжує перебіг даних реакцій
Характерна реакція на нітрат-іон:
2KNO3 + 3Cu + 4H2SO4 →
3CuSO4 + 2NO↑ + K2SO4 + 4H2O
2NO3‾ + 3Cu + 8H+ → 3Cu2+
+ 2NO↑ + 4H2O
2NO + O2(повітря) → 2NO2↑
Умови: сірчанокисле середовище. Зовнішній ефект – бурий газ NO2.
Характерні реакції на нітрит-іон:
NaNO2 + H2SO4 → NaHSO4
+ HNO2
3HNO2 → HNO3 + 2NO↑ + H2O
2NO + O2(повітря) → 2NO2↑
Реакцію вести на холоді. Зовнішній ефект – бурий газ NO2.
2KMnO4 + 5NaNO2 + 3H2SO4
→ 2MnSO4 + 5NaNO3 + K2SO4 +
3H2O
5NO2‾
+ 2MnO4‾ + 6H+ → 2Mn2+ + 5NO3‾
+ 3H2O
Умови: сірчанокисле середовище. Зовнішній ефект: рожеве забарвлення
розчину.
Характерна реакція на фосфат-іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект
– жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при
нагріванні.
№ 87
Скласти молекулярні та іонні рівняння
основних реакцій визначення аніонів PO43–, Cl‾ , CO32–. Навести умови їх
виконання та зовнішній ефект, який супроводжує перебіг даних реакцій
Характерна реакція на фосфат-іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект
– жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при нагріванні.
Визначення хлорид-іону за допомогою групового реактиву:
KCl + AgNO3 ↔ AgCl↓ + KNO3
Cl‾ + Ag+ ↔ AgCl↓
Умови: азотнокисле середовище. Зовнішній ефект – білий сирнистий осад хлориду
срібла.
Характерна реакція на хлорид-іон:
NaCl + H2SO4(конц.) ↔ NaHSO4 + HCl↑
Умова: нагрівання. Зовнішній ефект – специфічний запах хлороводню.
Характерна реакція на карбонат-іон:
Na2CO3 + 2HCl → 2NaCl + H2CO3
↕
CO2↑ + H2O
CO2 + Ba(OH2) ↔ BaCO3↓ + H2O
Зовнішній ефект – помутніння баритової води (випадає білий осад карбонату
барію).
№ 88
Скласти молекулярні та іонні рівняння основних реакцій визначення аніонів
I–, CO32–, NO3‾. Навести умови їх виконання та
зовнішній ефект, який супроводжує перебіг даних реакцій
Характерні реакції на йодид-іон:
2NaI + Cl2 → I2 + 2NaCl
2I‾ + Cl2 → I2 + 2Cl‾
Вільний йод, що виділяється, можна виявити за допомогою бензолу
(червоно-фіолетове забарвлення) або крохмалю (синє забарвлення).
2KI+ 2HNO2 + H2SO4 → I2 + 2NO↑
+ K2SO4 + 2H2O
2I‾
+ 2NO2‾ + 4H+ → I2 + 2NO↑ + 2H2O
Умови: кисле середовище. Зовнішній ефект – синє забарвлення розчину в присутності
йодид-іонів.
Характерна реакція на карбонат-іон:
CaCO3 + 2HCl → CaCl2 + H2CO3
↕
CO2↑ + H2O
CO2 + Ba(OH)2 ↔ BaCO3↓ + H2O
Зовнішній ефект – помутніння баритової води (випадає білий осад карбонату
барію).
Характерна реакція на нітрат-іон:
2KNO3 + 3Cu + 4H2SO4 →
3CuSO4 + 2NO↑ + K2SO4 + 4H2O
2NO3‾ + 3Cu + 8H+ → 3Cu2+
+ 2NO↑ + 4H2O
2NO + O2(повітря) → 2NO2↑
Умови: сірчанокисле середовище. Зовнішній ефект – бурий газ NO2.
№ 89
Скласти молекулярні та іонні рівняння
основних реакцій визначення аніонів NO3‾ , I–, SO42–. Навести умови їх
виконання та зовнішній ефект, який супроводжує перебіг даних реакцій
Характерна реакція на нітрат-іон:
2KNO3 + 3Cu + 4H2SO4 →
3CuSO4 + 2NO↑ + K2SO4 + 4H2O
2NO3‾ + 3Cu + 8H+ → 3Cu2+
+ 2NO↑ + 4H2O
2NO + O2(повітря) → 2NO2↑
Умови: сірчанокисле середовище. Зовнішній ефект – бурий газ NO2.
Характерні реакції на йодид-іон:
2NaI + Cl2 → I2 + 2NaCl
2I‾
+ Cl2 → I2 + 2Cl‾
Вільний йод, що виділяється, можна виявити за допомогою крохмалю (синє
забарвлення) або органічного розчинника (червоно-фіолетове забарвлення).
2KI + 2HNO2 + H2SO4 → I2 + 2NO↑ + K2SO4 + 2H2O
2I‾ + 2NO2‾ + 4H+ → I2 + 2NO↑ + 2H2O
Умови: кисле середовище. Зовнішній ефект – синє забарвлення розчину в присутності
йодид-іонів.
Характерна реакція на сульфат-іон:
Na2SO4 + BaCl2 ↔ BaSO4↓+
2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Умови: додавання кількох крапель 2н розчину HNO3 перед вливанням розчину хлориду
барію. Зовнішній ефект: білий кристалічний осад сульфату барію.
№ 90
Скласти молекулярні та іонні
рівняння основних реакцій визначення аніонів NO2‾ , PO43–, Cl‾. Навести умови їх виконання та
зовнішній ефект, який супроводжує перебіг даних реакцій
Характерні реакції на нітрит-іон:
NaNO2 + H2SO4 → NaHSO4
+ HNO2
3HNO2 → HNO3 + 2NO↑ + H2O
2NO + O2(повітря) →
2NO2↑
Реакцію вести на холоді. Зовнішній ефект – бурий газ NO2.
2KMnO4
+ 5NaNO2 + 3H2SO4 → 2MnSO4 +
5NaNO3 + K2SO4 + 3H2O
5NO2‾
+ 2MnO4‾ + 6H+ → 2Mn2+ + 5NO3‾
+ 3H2O
Умови: сірчанокисле середовище. Зовнішній ефект: рожеве забарвлення
розчину.
Характерна реакція на фосфат-іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект
– жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при
нагріванні.
Визначення хлорид-іону за допомогою групового реактиву:
KCl + AgNO3 ↔ AgCl↓ + KNO3
Cl‾ + Ag+ ↔ AgCl↓
Умови: азотнокисле середовище. Зовнішній ефект – білий сирнистий осад хлориду
срібла.
Характерна реакція на хлорид-іон:
NaCl + H2SO4(конц.) ↔ NaHSO4 + HCl↑
Умови: концентрована сірчана кислота, нагрівання. Зовнішній ефект – специфічний
запах хлороводню.
№ 91-92
Який аніон
відкривають за допомогою магнезіальної суміші? Написати рівняння реакції. При
визначенні якого катіону утворюється такий самий осад? Який ще реагент
використовують для відкриття цього аніону?
Це аніон PO43– :
HPO42– + Mg2+ + NH4OH ↔ MgNH4PO4↓ + H2O
Такий самий білий кристалічний осад отримаємо при визначенні катіона Mg2+.
Ще для відкриття
фосфат-іона використовують молібденову рідину:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
№ 93-94
Для відкриття
якого з аніонів застосовують молібденову рідину? Написати рівняння реакції.
Навести 5 об’єктів сільськогосподарського призначення, які містять цей аніон
Це аніон PO43– :
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
5 об’єктів сільськогосподарського призначення, які містять даний аніон: простий
суперфосфат, подвійний суперфосфат, амофос, диамофос, преципітат.
№ 95
Чи можна задля відкриття йодид-іону за допомогою хлорної води замість бензолу
використати крохмаль? Яка функція бензолу в цій реакції? Як ще можна відкрити
аніон І– ? Написати відповідні рівняння реакцій
Реакція відкриття йодид-іону за допомогою хлорної води наступна:
2КІ + Cl2 → 2КCl + I2
Органічні розчинники, зокрема бензол, екстрагують вільний
йод, забарвлюючись у червоно-фіолетовий колір.
Вільний йод також можна виявити крохмалем, який у
присутності йоду синіє.
Крім цього, йодид-іон можна виявити так:
1)
KI +
AgNO3 ↔ AgI↓ + KNO3
2)
2KI +
3H2SO4 → 2KHSO4 + I2 + SO2↑
+ 2H2O
3)
4I–
+ 2Cu2+ ↔ Cu2I2 + I2
4)
2I–
+ Pb2+ → PbI2
5)
2I–
+ 2NO2‾ + 4H+ → 2NO↑ + I2 +
2H2O
6)
10I–
+ 2MnO4‾ + 16H+ → 2Mn2+ + 5I2
+ 8H2O
№ 96-97
Який аніон ІІІ-ї
аналітичної групи можна відкрити за допомогою перманганату калію в кислому середовищі?
Які ще реагенти застосовуються для його відкриття? Написати відповідні рівняння
реакцій
Це нітрит-іон:
5NO2‾ + 2MnO4‾ + 6H+
→ 2Mn2+ + 5NO3‾ + 3H2O
Ще нітрит-іон можна відкрити такими способами:
1.
Сірчана
кислота розкладає всі нітрити при звичайних умовах:
NaNO2 + H2SO4 → NaHSO4 + HNO2
3HNO2 → HNO3 + 2NO↑ + H2O
2NO + O2(повітря) → 2NO2↑(бурий газ)
2.
За
допомогою нітрату срібла:
NaNO2 + AgNO3 ↔ AgNO2↓ + NaNO3
3.
Хлористий
амоній взаємодіє з нітритами при кипінні суміші в розведеній оцтовій кислоті:
NO2‾ +
NH4+ → N2↑ + 2H2O
4.
Алюміній у лужному
середовищі відновлює азотисту кислоту до аміаку:
NO2‾ +
2Al + OH‾ + H2O →
2AlO2‾ + NH3↑
5.
Йодид
калію в присутності розведеної кислоти окислюється нітритами до вільного йоду:
2NO2‾ + 2І‾ + 4Н+ → I2
+ 2NO↑ + 2H2O
№ 98-99-100
Які з аніонів
І-ІІІ аналітичних груп мають важливе агробіологічне значення? За допомогою яких
реагентів вони можуть бути виявлені в аналізованому об’єкті? Написати рівняння
реакцій
Важливе
агробіологічне значення мають: фосфат-іон PO43–, сульфат-іон SO42–, карбонат-іон CO32–, нітрат-іон NO3‾, хлорид-іон Cl‾ та деякі інші. Рівняння
реакцій визначення цих аніонів, наприклад, в мінеральних добривах:
CaHPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+Ca(NO3)2+21NH4NO3+12H2O
K2SO4
+ BaCl2 ↔ BaSO4↓ + 2KCl
K2CO3
+ BaCl2 ↔ BaCO3↓ + 2KCl
2KNO3
+ 3Cu + 4H2SO4 → 3CuSO4 + 2NO↑ + K2SO4
+ 4H2O
KCl + H2SO4(конц.) ↔ KHSO4
+ HCl↑
№ 101
Навести класифікацію хімічних
методів кількісного аналізу. Перерахувати основні етапи визначень цими методами
Кількісне визначення хімічними методами складається з трьох основних етапів.
Перший етап – відмірювання певної кількості речовини для аналізу,
для чого речовину зважують або вимірюють об’єм розчину. Другий етап –
проведення реакції, внаслідок якої визначуваний компонент перетворюється в
сполуку з певними хімічними та фізичними властивостями. Третій етап –
вимірювання показника якоїсь фізичної властивості системи, за величиною якого
роблять висновок про кількість визначуваної речовини.
Перша група методів кількісного хімічного аналізу включає методи, в
основу яких покладено вимірювання показника властивості продукту реакції. До
цієї групи відносять: а)ваговий аналіз; б)колориметричний аналіз.
У ваговому
аналізі вимірюють вагу продукту реакції. На першому етапі відмірюють певну
кількість речовини для аналізу зважуванням або вимірюванням об’єму розчину.
Другий етап – за допомогою певних хімічних реактивів проводять реакцію
осадження визначуваного компонента. Третій етап – відокремлення утвореного
осаду від розчину і зважування осаду.
Колориметричний аналіз складається з двох стадій – утворення (руйнування)
забарвленої сполуки і вимірювання інтенсивності утвореного забарвлення.
Друга група методів кількісного хімічного аналізу включає методи,
в основу яких покладено вимірювання кількості реактиву, витраченого на
взаємодію з визначуваним компонентом. До цієї групи належить об’ємний аналіз з
його підрозділами.
За типом реакції
розрізняють такі підрозділи об’ємного аналізу:
1) метод кислотно-основного титрування, в основі якого лежить
реакція між іонами Н+ та OH– з утворенням
малодисоційовних молекул H2O. Розчин кислоти титрують розчином
основи або навпаки до точки еквівалентності, за якою обчислюють концентрацію, а
значить і кількість визначуваної речовини;
2) метод осадження і комплексоутворення, основним етапом якого є
переведення визначуваної речовини в осад або в комплексну сполуку;
3) метод окислення-відновлення, який налічує багато підметодів,
проте суть єдина – на етапі проведення реакції змінюються ступені окислення
реагуючих речовин.
Третя група методів кількісного хімічного аналізу ґрунтується на
вимірюванні змін властивості самого визначуваного компонента, зумовлених зв’язуванням
його реактивом у певну хімічну сполуку. До цієї групи відносять також газовий
аналіз.
Прикладом є визначення кисню в повітрі. Відмірюють певний об’єм повітря і
пропускають його через розчин пірогалолу, який вбирає кисень. Внаслідок вбирання
кисню об’єм проби повітря зменшується. Вимірюють об’єм повітря, що залишилось
після реакції. За різницею вказаних об’ємів обчислюють кількість речовини кисню
у взятому об’ємі повітря, або об’ємний процентний його вміст.
№ 102
Розкрити суть гравіметричного аналізу
У
гравіметричному аналізі визначуваний компонент зразка виділяють з розчину у вигляді
осаду відомого хімічного складу, потім, знаючи масу отриманого осаду,
обчислюють кількість даного компоненту аналізованої речовини.
№ 103
Викласти суть титрометричного аналізу
Основною
операцією титрометричного аналізу є вимірювання об’єму робочого розчину,
витраченого на взаємодію з розчином визначуваної речовини (об’єм розчину
останньої має бути відомим).
Робочий розчин доливають до аналізованого розчину (титрують) до досягнення
точки еквівалентності, тобто моменту, коли кількості двох
реагуючих речовин стануть еквівалентними. Точку еквівалентності зручно
встановлювати за кольоровими індикаторами.
Нормальність розчину визначуваної речовини знаходять за законом еквівалентів,
а кількість речовини – з рівнянь реакцій та за допомогою відповідних розрахункових
формул.
№ 104
Навести класифікацію
методів титрометричного аналізу
За типом реакції розрізняють такі методи титрометричного
аналізу:
1) метод нейтралізації;
2)
метод
осадження і комплексоутворення;
3)
методи
окислення-відновлення.
Третя
група методів титрометричного аналізу має такі основні підгрупи:
а) перманганатометрія;
б) йодометрія;
в) хроматометрія.
Перша і друга групи методів теж мають свої підгрупи.
За способом встановлення точки еквівалентності методи об’ємного аналізу
класифікують так:
а) визначення з кольоровими індикаторами;
б) потенціометрія;
в) кондуктометрія;
г) амперометрія.
№ 105
Дати обґрунтовану
відповідь щодо вимог, які висуваються до хімічних реакцій у титрометричному аналізі
Основні вимоги наступні:
1)
реакції
мають йти до кінця і стехіометрично;
2)
кінець
реакції має бути добре помітним за зміною окраски розчину чи за зміною
забарвлення індикатора;
3)
концентрація
стандартного розчину має бути відома з високою точністю (від цього майже цілком
залежить точність визначення кількості аналізованої речовини);
4)
інші
речовини, які є в розчині, не повинні заважати основній реакції.
№ 106
Навести визначення та дати пояснення щодо основних понять і
термінів титрометричного аналізу: робочі розчини, фіксанали (стандарт- титри)
Розчин реактиву
відомої концентрації називають робочим або титрованим розчином.
Стандарт-титр або фіксанал – це точна наважка сухої
вихідної речовини, або точно відмірений об’єм розчину відомої концентрації,
запаяні в скляну ампулу.
№ 107
Навести визначення та дати пояснення щодо основних понять і термінів титрометричного
аналізу: вихідні
речовини та вимоги, яким вони повинні відповідати
Хімічні сполуки,
придатні для приготування титрованих розчинів називають вихідними
речовинами.
Вимоги до вихідних речовин:
1. Відповідність дійсного складу речовини її хімічній формулі, тобто чистота
препарату. Це означає, що:
а) вихідні речовини мають бути класу чистоти не нижче ЧДА (чистий для аналізу);
б) вихідні речовини не повинні бути гігроскопічними (навіть під
час зважування NaOH
настільки енергійно вбирає воду, що це робить сам вказаний процес практично
нездійсненним);
в) хоча допустимо, але небажано, щоб вихідні речовини містили кристалізаційну
воду.
2. Розчини вихідних речовин мають бути стійкими і концентрація таких
розчинів не повинна змінюватись під впливом зовнішніх умов.
№ 108
Навести
визначення та дати пояснення щодо основних понять і термінів
титрометричного аналізу: титрування, точка еквівалентності
Титрування – це поступове доливання робочого розчину до розчину визначуваної
речовини до досягнення точки еквівалентності.
Точка еквівалентності – момент, коли кількості двох
реагуючих між собою речовин стануть еквівалентними.
№ 109
Навести визначення та дати пояснення щодо
основних понять і термінів титрометричного аналізу: індикатори, помилки
титрування
Як відомо, у титрометричному аналізі до розчину одного компонента додають
розчин другого компонента до досягнення точки еквівалентності. Для визначення
кінця титрування використовують індикатори. Практично неможливо підібрати індикатор,
який показував би кінець титрування в точці еквівалентності. Через це визначають
так звану кінцеву точку титрування, тобто кінець титрування, визначений
індикатором. Чим більше кінцева точка титрування і точка еквівалентності відрізняються
між собою, тим більша помилка титрування.
Індикатори є
слабкими органічними кислотами або основами, молекулярна форма яких має інше
забарвлення, ніж іонна. Індикатори бувають одноколірні і двоколірні.
Одноколірні індикатори безбарвні в молекулярній формі і забарвлені в іонній
формі. Двоколірні – забарвлені в різні кольори як в молекулярній, так і в
іонній формах.
Залежно від константи дисоціації КНIn індикатори поділяють на
сильні, проміжні та слабкі.
Сильні індикатори характеризуються величиною КНIn > 10–7 і змінюють
забарвлення в кислому середовищі при рН < 7. Типовий представник – метилоранж,
забарвлення якого змінюється в межах 3,4 < pH < 4,3.
Проміжні індикатори змінюють забарвлення при рН ≈
7. Типовим представником є лакмус, що змінює забарвлення при 6,8 < рН
< 7,2.
Слабкі індикатори змінюють забарвлення в слабколужному
середовищі. Типовий представник – фенолфталеїн, який безбарвний при рН < 8 і
червоний при рН > 8.
Основними причинами помилок титрування є відхилення показника титрування рТ
індикатора від рН точки еквівалентності і не досить різка зміна кольору
індикатора біля точки еквівалентності.
Наприклад, при титруванні сильної основи сильною кислотою помилка титрування
суть відношення об’єму витраченої на титрування кислоти до об’єму взятого
розчину лугу.
При титруванні
слабкої кислоти лугом помилка титрування є відношення концентрацій розчинів невідтитрованої
і відтитрованої кислоти. Крім цього, в даному випадку помилку титрування можна
виразити так:
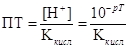 , де Kкисл – константа дисоціації кислоти. , де Kкисл – константа дисоціації кислоти.
При титруванні солей слабких кислот
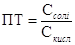 , де Ссолі і Скисл , де Ссолі і Скисл
відповідно нормальні концентрації солі і кислоти.
№ 110
Навести
визначення та дати пояснення щодо основних понять і термінів титрометричного
аналізу: мірний посуд, який застосовують у титрометричному аналізі та правила
користування ним
В титрометричному
аналізі для точного вимірювання об’ємів рідини застосовують мірні колби, піпетки і бюретки.
Мірні
колби застосовують для
приготування розчинів і для відмірювання певного об’єму рідини. Колбу перед
використанням добре миють. Розчини готують, висипаючи наважку реактиву в
колбу, доливають розчинник приблизно до ½ її об’єму, дають реактиву
розчинитись, потім доливають цей же розчинник до мітки. Певний об’єм рідини
відмірюють аналогічно, заповнюючи колбу до мітки. Доводять об’єм рідини до
мітки в обох випадках так, щоб нижній край меніску був на рівні мітки колби.
Очі спостерігача теж мають бути на рівні мітки.
Піпетки використовують для відбору певного об’єму рідини. Звичайна піпетка – це
скляна трубка з розширенням посередині. Нижній кінець витягнуто в капіляр. На
верхньому кінці є мітка, до якої слід набирати рідину, яку відмірюють. Перед
використанням піпетку добре миють хромовою сумішшю, споліскують спочатку
дистильованою водою, потім розчином, яким будуть її наповнювати.
Бюретки застосовують для відмірювання точних об’ємів рідини. Бюретка являє собою
вузьку циліндричну трубку. Є бюретки, оснащені затискачем, а є оснащені внизу
краном.
Нульова мітка
шкали розміщена вгорі трубки. Бюретки градуюють вниз від нульової мітки на
десяті долі мілілітра. Перед використанням бюретку добре миють хромовою
сумішшю, споліскують 2-3 рази дистильованою водою, потім розчином, яким будуть
її наповнювати. В роботі бюретку закріплюють на штативі у вертикальному
положенні і заповнюють потрібним розчином трохи вище нульової мітки. Потрібно
слідкувати, щоб в капілярі крана, в гумовій трубці і в наконечнику не було
повітря.
Відкривають кран
або відпускають затискач. Об’єм рідини, що витекла з бюретки, відраховують по
меніску, що рухатиметься вниз по шкалі. Темні і світлі рідини бажано
відмірювати по різним краям меніска, проте в будь-якому разі відмірювання слід
проводити по якомусь одному (верхньому або нижньому) краю. Очі спостерігача
мають бути на рівні меніска. Відмірявши певний об’єм, закривають кран або
затискач.
№ 111-112-113
Розкрити суть титрометричних
визначень методом нейтралізації
Основною реакцією методу є реакція нейтралізації – взаємодія кислоти і
основи: Н+ + ОН‾ → Н2О
Стандартними розчинами в розглядуваному методі є розчини кислот і основ.
Фактично це титрування розчину кислоти розчином лугу або навпаки до досягнення точки
еквівалентності – моменту, коли кількості добавленого і взятого компонентів
стануть еквівалентними. Точку еквівалентності найзручніше визначати за
кольоровими індикаторами. Нормальності розчинів встановлюють за законом еквівалентів.
Кількість речовини визначають за рівняннями реакцій та за розрахунковими
формулами.
Головним чином
метод нейтралізації застосовують для кількісного визначення кислот і основ.
Даним методом можна визначати, наприклад, жорсткість води, концентрацію солей
амонію та солей слабких кислот.
№ 114-115-116
Розкрити суть перманганатометрії
Перманганатометрія – один з методів об’ємного аналізу
(підгрупа методів окислення-відновлення), в якому речовину визначають
титруванням розчином перманганату калію.
У кислому середовищі основна реакція методу йде за рівнянням:
MnO4‾ + 8H+ + 5e‾ → Mn2+ + 4H2O
У слабокислих або лужних розчинах перманганат відновлюється до Mn4+, який випадає у вигляді нерозчинного
осаду двоокису марганцю:
MnO4‾ + 4H+ + 3e‾ → MnO2↓ + 2H2O
Метод застосовують для визначення багатьох відновників, серед них Fe2+, Sn2+, Mn2+, V4+, U4+.
При титруванні розчином перманганату калію звичайно не застосовують ніяких
спеціальних індикаторів. Точку еквівалентності встановлюють за рожевим забарвленням,
яке виникає від невеликого надлишку добавленого розчину KMnO4. Отже, індикатором є сам робочий
розчин. Оскільки препарат KMnO4 не має властивостей вихідної речовини через значну
кількість домішок двоокису марганцю, нормальність розчину перманганату калію
встановлюють за щавлевою кислотою.
№ 117-118
Розкрити суть йодометрії
Йодометрія – один з методів об’ємного аналізу, в основі якого
лежить вимірювання кількості йоду, що витрачається на окислення відновників або
виділяється при взаємодії окисників з розчином йодиду калію.
Основна реакція методу йде за рівнянням:
I2 + 2е– ↔ 2I‾
Особливість даного методу – можливість досить точно встановити точку еквівалентності,
що пов’язано з використанням чутливого специфічного індикатора – розчину
крохмалю (вже 0,00001 н. розчини йоду утворюють з крохмалем помітно
синє забарвлення).
№ 119-120
Розкрити суть комплексонометрії
Комплексонометрія – один з методів об’ємного аналізу,
в якому речовину визначають титруванням трилоном Б (динатрієва сіль
етилендиамінтетраоцтової кислоти). Характерними особливостями методу, можна
сказати, його перевагами є те, що трилон Б реагує з катіонами дуже багатьох
металів, в тім числі лужно-земельних, що дозволяє застосовувати даний метод для
визначення постійної твердості води. Крім того, 1 г-іон комплексону завжди
реагує з 1 г-іоном металу у випадку всіх дво- і тривалентних металів. Під час
реакції не утворюється ніяких побічних продуктів, присутність яких ускладнює
визначення.
№ 121
Дати загальну
характеристику методу нейтралізації
Основною реакцією методу є реакція нейтралізації – взаємодія кислоти і основи:
Н+ + ОН‾ → Н2О
Стандартними розчинами в розглядуваному методі є розчини кислот і основ.
Фактично це титрування розчину кислоти розчином лугу або навпаки до досягнення точки
еквівалентності – моменту, коли кількості добавленого і взятого компонентів
стануть еквівалентними. Точку еквівалентності найзручніше визначати за
кольоровими індикаторами. Нормальності розчинів встановлюють за законом еквівалентів.
Кількість речовини визначають за рівняннями реакцій та за розрахунковими
формулами.
Головним чином
метод нейтралізації застосовують для кількісного визначення кислот і основ.
Даним методом можна визначати, наприклад, жорсткість води, концентрацію солей
амонію та солей слабких кислот.
№ 122
Навести приклади
робочих розчинів методу нейтралізації. Які вихідні речовини застосовують для
встановлення нормальності робочих розчинів?
Робочими
розчинами методу нейтралізації є розчини кислот і основ. Переважно
застосовуються розчини соляної, сірчаної та азотної кислот, розчини гідроксиду
натрію і гідроксиду калію.
Методи
встановлення нормальності робочих розчинів приведу для HCl і NaOH: нормальність розчину
соляної кислоти встановлюють за бурою, а нормальність розчину гідроксиду натрію
встановлюють за щавелевою кислотою.
№ 123
Дати обґрунтовану
відповідь, чи можна приготувати титрований робочий розчин гідроксиду натрію,
виходячи з точної наважки речовини NaOH
Не можна. Тому що,
по-перше, луги дуже важко дістати в чистому вигляді. При їх виготовленні (а
особливо при зберіганні) завжди утворюється певна кількість соди в результаті
поглинання CO2 з повітря. По-друге, луги містять воду та інші
домішки.
У нашому випадку
препарат NaOH надзвичайно гігроскопічний. Вже під час зважування на аналітичних
терезах їдкий натр настільки сильно поглинає воду, що це робить сам процес зважування
практично неможливим, не говорячи вже про приготування титрованого розчину.
№ 124
Дати обґрунтовану відповідь, чи можна приготувати титрований робочий
розчин соляної кислоти, виходячи з точного об’єму розчину HCl відомої концентрації
Не можна. Тому що, по-перше, точна концентрація кислот звичайно
невідома. По-друге, концентрована соляна кислота дуже легко втрачає хлороводень
у вигляді газу (випаровується), а це означає, що її концентрація змінюється.
№ 125
Описати основні
етапи визначення концентрації робочих розчинів у методі нейтралізації. Скласти
рівняння реакцій, які відбуваються при визначенні концентрації НCl
Для встановлення
нормальності розчинів сильних кислот найчастіше використовують буру, а для
встановлення нормальності розчину лугу – щавлеву кислоту. Основні етапи
визначення концентрації робочих розчинів наступні.
1. Перекристалізація бури і щавлевої кислоти. При зберіганні ці препарати
втрачають певну кількість води, тому їх треба перекристалізовувати навіть тоді,
коли за чистотою вони цілком придатні для роботи.
2. Приготування робочого розчину сильної кислоти або лугу. Звичайно готують
1 л 0,1 н розчину, нормальність якого відома приблизно.
3. Приготування розчину вихідної речовини. Це розчин бури у випадку встановлення
нормальності розчину сильної кислоти і розчин щавлевої кислоти у випадку
встановлення нормальності розчину лугу.
4. Проведення реакції титрування. У нашому випадку при визначенні концентрації
розчину НCl йде реакція:
Na2В4O7 + 2НCl + 5H2O →
4Н3ВО3 + 2NaCl
5. Визначення
нормальності розчину кислоти за формулою:
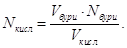
№ 126
Описати основні етапи визначення концентрації робочих розчинів у методі
нейтралізації. Скласти рівняння реакцій, які відбуваються при визначенні концентрації
NaOH
Для встановлення
нормальності розчинів сильних кислот найчастіше використовують буру, а для
встановлення нормальності розчину лугу – щавлеву кислоту. Основні етапи
визначення концентрації робочих розчинів наступні.
1. Перекристалізація бури і щавлевої кислоти. При зберіганні ці препарати
втрачають певну кількість води, тому їх треба перекристалізовувати навіть тоді,
коли за чистотою вони цілком придатні для роботи.
2. Приготування робочого розчину сильної кислоти або лугу. Звичайно готують
1 л 0,1 н розчину, нормальність якого відома приблизно.
3. Приготування розчину вихідної речовини. Це розчин бури у випадку встановлення
нормальності розчину сильної кислоти і розчин щавелевої кислоти у випадку
встановлення нормальності розчину лугу.
4. Проведення реакції титрування. У нашому випадку при визначенні концентрації
розчину NaOH йде реакція:
H2С2O4 + 2NaOH → Na2С2O4
+ 2H2O
Проте, цей метод встановлення нормальності розчину лугу можна застосовувати
лише у випадках коли в останньому немає карбонатів. Якщо в розчині лугу
присутні карбонати, то іони С2O42– осаджують
хлоридом кальцію. Соляну кислоту, яка при цьому звільняється, титрують лугом у
присутності метилоранжу:
Na2С2O4 + СаCl2 ↔ СаС2O4↓
+ 2NaCl
H2С2O4 + СаCl2 ↔ СаС2O4↓
+ 2НCl
НCl + NaOH → NaCl + H2O
2НCl + Na2CO3 → 2NaCl + CO2↑
+ H2O
Проводять 3–4
титрування і за середнім значенням обчислюють нормальність розчину лугу. Крім
того, для встановлення нормальності розчину лугу можна використати титрований
розчин НCl. Тоді нормальність лугу обчислюють за формулою:
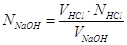
Однак, точність
в даному випадку буде нижча.
№ 127
Розрахувати нормальність, молярність, титр розчину HCl, якщо на титрування 25 мл 0,0936 н
розчину бури витрачено 21,4 мл розчину HCl
Реакція йде за рівнянням:
2HCl + Na2B4O7 + 5H2O → 4H3BO3 + 2NaCl
Зі співвідношення закону еквівалентів
Vбури∙Nбури = VHCl∙NHCl
знайдемо нормальність соляної кислоти:
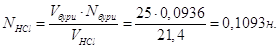
В даному випадку моль-еквівалент соляної кислоти рівний 1 молю, отже, молярність
HCl становить
СМ = 0,1093 М.
Титр знайдемо із співвідношення
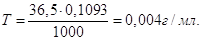
№ 128
Зазначити
основні індикатори методу нейтралізації. Пояснити, що таке інтервал переходу та
показник титрування індикатора
Основні індикатори методу показник
нейтралізації:
титрування (рТ)
метиловий фіолетовий (І перехід) 1
тимоловий синій (І перехід) 2
метиловий фіолетовий (ІІ перехід) 2,5
метилоранж 4
бромфенол синій 4
метиловий червоний 5
лакмус 7
нейтральний червоний 7
феноловий червоний 8
тимоловий синій (ІІ перехід) 9
фенолфталеїн 9
тимолфталеїн 10
Інтервал рН, в межах якого відбувається помітна для людського ока зміна забарвлення
індикатора, називають інтервалом переходу індикатора.
У межах інтервалу переходу індикатора є значення рН, при якому спостерігається
найбільш помітна для людського ока зміна кольору індикатора. Це значення рН
називають показником титрування індикатора
(позначають рТ).
№ 129
Дати мотивовану відповідь, для чого застосовують індикатори та як їх вибирають
Індикатори в
титрометричному аналізі і в його підрозділі – методі нейтралізації використовують
для встановлення точки еквівалентності за різкою зміною кольору індикатора, яка
повинна спостерігатись поблизу точки еквівалентності і в самій цій точці.
Однак, таким методом встановити точку еквівалентності можна лише з певною
точністю, так як, по-перше, показник титрування рТ вибраного індикатора і рН
розчину в точці еквівалентності можуть суттєво відрізнятись; по-друге, не
всякий індикатор різко змінює колір у вказаній точці.
Умовою
правильного вибору індикатора, а значить, і умовою найбільш точного визначення
точки еквівалентності, є те, щоб різниця значень рТ індикатора і рН розчину в
точці еквівалентності була якнайменшою. При цьому показник титрування
індикатора знаходять з довідників, а рН розчину в точці еквівалентності обчислюють
за рівнянням реакції.
№ 130
За допомогою кривих титрування дати обґрунтовану відповідь, де точність
титрування буде найвищою:
а) при титруванні сильної кислоти лугом;
б) при титруванні слабкої кислоти лугом?
Чи можна титрувати слабку кислоту слабкою основою?
а) поглянемо на криву титрування сильної кислоти лугом
(0,1 н розчин HCl 0,1 н розчином NaOH):
 рН 14 рН 14
 7 7

 0 0
0 40 80 120 160 200
об’єм NaOH, мл
З малюнка видно,
що при титруванні сильної кислоти лугом біля точки еквівалентності
спостерігається різка зміна рН розчину. Помилка титрування в даному
випадку становить 0,1%.
б) тепер
поглянемо на криву титрування слабкої кислоти лугом
(0,1 н розчину
оцтової кислоти 0,1 н розчином NaOH):
  рН 14 рН 14
 7 7
 0 0
0 40 80 120 160
200 об’єм NaOH, мл
Характер кривої
показує, що при титруванні слабкої кислоти лугом немає різкої зміни рН біля
точки еквівалентності. У цьому випадку помилка титрування може сягати 10%.
Таким чином,
точність титрування буде найвищою у випадку титрування сильної кислоти
сильною основою.
Титрувати слабку
кислоту слабкою основою практично неможливо тому що при зміні рН на ± 1
кислота буде недотитрована приблизно на 10%, потім приблизно на стільки ж буде
перетитрована.
№ 131
Дати загальну характеристику методу перманганатометрії
Перманганатометрія – один з методів об’ємного аналізу
(підгрупа методів окислення-відновлення), в якому речовину визначають
титруванням розчином перманганату калію.
У кислому середовищі основна реакція методу йде за рівнянням:
MnO4‾ + 8H+ + 5e‾ → Mn2+ + 4H2O.
У слабокислих або лужних розчинах перманганат відновлюється до Mn4+, який випадає у вигляді нерозчинного
осаду двоокису марганцю:
MnO4‾ + 4H+ + 3e‾ → MnO2↓ + 2H2O
Метод застосовують для визначення багатьох відновників, серед них
Fe2+, Sn2+, Mn2+, V4+, U4+.
При титруванні розчином перманганату калію звичайно не застосовують ніяких
спеціальних індикаторів. Точку еквівалентності встановлюють за рожевим забарвленням,
яке виникає від невеликого надлишку добавленого розчину перманганату. Отже, індикатором
є сам робочий розчин.
Оскільки препарат KMnO4 не має властивостей вихідної речовини через значну
кількість домішок двоокису марганцю, нормальність розчину перманганату калію
встановлюють за щавлевою кислотою.
№ 132
Титровані розчини методу перманганатометрії. У чому полягає різниця приготування
робочого титрованого розчину КMnO4 та стандартного розчину щавлевої
кислоти?
Робочим розчином методу перманганатометрії є розчин перманганату калію.
Після встановлення нормальності цього розчину за щавлевою кислотою він має назву
титрований робочий розчин. Різниця приготування титрованого
робочого розчину КMnO4 та стандартного розчину щавлевої кислоти
полягає в тому, що, по-перше, препарат перманганату калію, на відміну від
препарату щавлевої кислоти, не містить кристалізаційної води (яку останній з
часом втрачає), отже його не треба перекристалізовувати перед розчиненням;
по-друге, приготувавши стандартний розчин щавлевої кислоти, ми будемо знати
його нормальність з достатньою точністю, тоді як нормальність приготовленого
робочого розчину КMnO4 відома лише приблизно і встановити її буде
необхідно за тим же розчином щавлевої кислоти.
№ 133
Дати мотивовану відповідь, чи можна приготувати титрований розчин KMnO4, виходячи з точної наважки, без
встановлення його концентрації за вихідною речовиною
НЕ МОЖНА. Тому, що KMnO4 не має властивостей вихідної речовини. Препарат
завжди має більшу або меншу кількість домішок двоокису марганцю, позбутися яких
важко. Крім того, концентрація розчину KMnO4 з часом змінюється внаслідок
відновлення під впливом світла, невеликих кількостей органічних речовин, які
потрапляють у розчин з пилом, тощо.
Точну концентрацію розчину KMnO4 можна встановити за щавелевою кислотою.
№ 134
Розрахувати наважку КMnO4,
необхідну для приготування 1,0 л 0,05 н розчину. Зазначити основні етапи
приготування розчину КMnO4
Зрівняння
реакції
MnO4‾
+ 8Н+ + 5е– → Mn2+ + 4H2O
бачимо, що еквівалент КMnO4 рівний 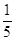 його
молярної маси. Отже, для того, щоб приготувати 1 л 0,05 н розчину, треба
відважити на технічних терезах його
молярної маси. Отже, для того, щоб приготувати 1 л 0,05 н розчину, треба
відважити на технічних терезах
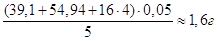 препарату КMnO4. препарату КMnO4.
Наважку переносять у вимірювальну колбу і заливають приблизно на ½
дистильованою водою, старанно перемішують до повного розчинення кристалів. Слідкують,
щоб кристали КMnO4 розчинились повністю, оскільки процес дуже повільний.
Потім доводять об’єм розчину до 1 л. Не раніше, як через 10–12 діб
нормальність отриманого розчину встановлюють за щавлевою кислотою.
№ 135
Скласти рівняння реакції, яка відбувається при встановленні нормальності
робочого розчину КMnO4 за вихідною речовиною. Зазначити хід та умови
цього визначення
Рівняння
реакції:
2КMnO4 + 5H2С2O4 + 3H2SO4
→ К2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
2 MnO4‾
+ 8H+ + 5е– → Mn2+ + 4H2O
5
 C2O42–
→ 2е– + 2CO2↑ C2O42–
→ 2е– + 2CO2↑
2MnO4‾ + 5C2O42–
+ 16H+ → 2Mn2+ + 10CO2↑ + 8H2O
Хід визначення: піпеткою відбирають 20 або 25 мл 0,1 н розчину щавлевої
кислоти і переносять у конічну колбу ємністю 200 мл. Добавляють 15–20 мл розчину
сірчаної кислоти (1:4) і нагрівають до температури 80–90°С. При цьому стежать, щоб
стінки колби вище рівня рідини не перегрівались, оскільки це може призвести до
термічного розкладу щавлевої кислоти:
t°
H2С2O4 → CO2↑ + CO↑ + H2O
До гарячого
розчину щавлевої кислоти з бюретки добавляють кілька крапель розчину
перманганату калію і чекають, доки зникне рожеве забарвлення. Потім додають
наступні порції розчину перманганату, щоразу чекаючи зникнення рожевого
забарвлення. Після додавання 2–3 мл розчину перманганату титрування йде швидше
і робочий розчин можна добавляти більшими порціями. Ознакою кінця титрування є
забарвлення розчину в рожевий колір, який не зникає тривалий час. Визначення
треба повторити з новими порціями розчину щавлевої кислоти ще 2–3 рази, при
цьому розходження в об’ємах між окремими паралельними пробами не має перевищувати
0,02–0,03 мл. Відлічувати об’єм розчину перманганату, витраченого на
титрування, зручно за верхнім меніском на бюретці. Нормальність розчину
перманганату обчислюють за формулою:
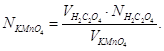
№ 136
Як прискорити реакцію, що є основою визначення концентрації розчину KMnO4? Що є каталізатором?
Реакція між KMnO4 і щавлевою кислотою
безпосередньо не йде або йде дуже повільно. Навпаки, швидкість реакції між KMnO4 і іонами марганцю(ІІ), в результаті
якої утворюється двоокис марганцю, досить велика. Найшвидше взаємодіють MnO2 та H2C2O4.
Досліди показують, що каталізатором в даній реакції є іони
марганцю(ІІ). Збільшення їх концентрації значно прискорює реакцію.
№ 137
Чому не потрібен
індикатор при перманганатометричних визначеннях? Як встановлюють точку
еквівалентності при титруванні розчином перманганату калію?
Тому що в даному випадку індикатором є сам робочий розчин
KMnO4. Точку еквівалентності
встановлюють за рожевим забарвленням, яке виникає від невеликого надлишку
добавленого розчину KMnO4. Помилку титрування при
такому способі визначення точки еквівалентності легко встановити за допомогою
сліпої проби.
№ 138
Чому титрування перманганатом
калію проводять у кислому середовищі? Чи можна використати нейтральне чи лужне
середовище? Відповідь обґрунтуйте рівняннями реакцій.
У кислому середовищі реакція йде за рівнянням:
MnO4‾ + 8Н+ + 5е– → Mn2+ + 4H2O
При меншій концентрації водневих іонів у слабокислих, нейтральних і слабколужних
розчинах перманганат відновлюється до Mn4+, який виділяється у вигляді
нерозчинного осаду двоокису марганцю:
MnO4‾ + 4Н+ + 3е– →
MnO2↓ + 2H2O
Осад
двоокису марганцю утруднює спостереження точки еквівалентності, роблячи
визначення не досить точним.
В лужному середовищі перманганат калію відновлюється до манганату К2MnO4,
який в розчині самовільно розпадається на перманганат калію і той же нерозчинний
осад двоокису марганцю. Титрування в слабокислих, нейтральних та лужних
середовищах проводять лише з метою визначення марганцю (ІІ) та в деяких інших
випадках.
№ 139
Розрахувати нормальність, молярність, титр розчину KMnO4, якщо на титрування 20 мл 0,0497 н
розчину H2C2O4 витрачено 18,6 мл розчину KMnO4
З закону еквівалентів знайдемо:
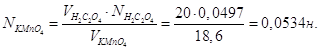
Дана реакція йде за рівнянням: MnO4‾ + 8H+ + 5e‾ = Mn2+ + 4H2O
Очевидно, що моль-еквівалент KMnO4 в даному випадку рівний 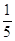 його
молярної маси. Отже, шукана молярність буде його
молярної маси. Отже, шукана молярність буде 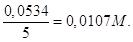
Титр обчислимо із співвідношення:
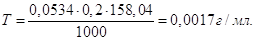
№ 140
Розрахувати нормальність, молярність, титр розчину щавлевої кислоти,
одержаної розчиненням 1,7334 г кислоти в мірній колбі ємністю 250 мл. Скільки
мл цього розчину піде на титрування 25,00 мл 0,0912 н розчину КMnO4?
Молекулярна формула
кристалогідрату щавлевої кислоти H2С2O4∙2H2O.
Молярна маса її становить
МH2C2O4∙2H2O =
2+12∙2+16∙4+2(2+16) = 126 г/моль.
Щавлева кислота є
двоосновною, тому моль-еквівалент її рівний ½ моль, а еквівалентна маса
становить
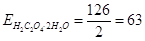 г/моль-екв. г/моль-екв.
Кількість моль-еквівалентів щавлевої кислоти, що містяться в 1000 мл
розчину:
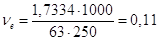 моль-екв. моль-екв.
Отже, нормальність отриманого розчину NH2C2O4∙2H2O =
0,11н.
Кількість молей щавелевої кислоти, що містяться в 1000 мл розчину:
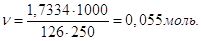
Тому, молярність розчину СМ = 0,055 М.
Титр розчину щавлевої кислоти знайдемо із співвідношення:
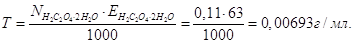
Об’єм розчину щавлевої
кислоти, що піде на титрування 25,00 мл 0,0912 н розчину КMnO4
буде
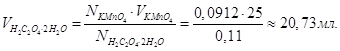
№ 141-142
За допомогою якого методу кількісного аналізу можна визначити вміст у
складі зразка мінерального добрива, рослини, води, грунтів або інших
об’єктів:заліза (ІІ)
Дати загальну характеристику методу, який для цього
застосовується. Описати основні етапи виконання даного аналізу.
Залізо (ІІ) визначають методом перманганатометрії. Загальна
характеристика: титрування робочим розчином перманганату калію, тобто розчином,
нормальність якого була попередньо встановлена за щавелевою кислотою.
Метод застосовується головним чином для визначення заліза в рудах, силікатах
і шлаках з великим вмістом заліза. Для переведення заліза в розчин ці матеріали
безпосередньо оброблюють кислотами, а ті, що не розчиняються в кислотах,
спочатку сплавляють з карбонатом натрію або іншими речовинами. Після такої обробки
звичайно утворюється хлорид заліза(ІІІ). Тому перед титруванням розчином
перманганату калію залізо (ІІІ) відновлюють до заліза (ІІ). Для відновлення
застосовують гази, розчини відновників або тверді речовини. Відновлені іони
заліза титрують робочим розчином перманганату калію. Після цього вміст заліза
(ІІ) визначають за відповідною розрахунковою формулою.
№ 143
За допомогою якого методу кількісного
аналізу можна визначити вміст у складі зразка мінерального добрива, рослини,
води, грунтів або інших об’єктів: міді (ІІ)
Дати загальну характеристику методу, який для цього
застосовується. Описати основні етапи виконання даного аналізу.
Мідь (ІІ)
визначають йодометрією. В основу йодометричного визначення міді (ІІ) покладено окислювальну дію
іонів міді (ІІ) відносно іонів йоду.
При взаємодії солей міді з йодидом калію мідь (ІІ) відновлюється до міді
(І) з утворенням нерозчинного йодиду міді і виділенням вільного йоду, який
потім титрують розчином тіосульфату натрію:
2CuSO4 + 4KI → 2CuI↓ + 2K2SO4
+ I2
I2 + 2Na2S2O3 →
Na2S4O6 + 2NaI
Після титрування вміст міді розраховують за відповідною формулою. Варто
зазначити, що йодометричне визначення міді дуже точне.
№ 144
За допомогою якого методу кількісного аналізу можна визначити
вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших
об’єктів: нітритів
Дати загальну характеристику методу, який для цього застосовується. Описати
основні етапи виконання даного аналізу.
Цей метод – перманганатометрія.
Загальна характеристика: титрування робочим розчином перманганату калію, тобто
розчином, нормальність якого була попередньо встановлена за щавлевою кислотою.
В основі кількісного визначення нітритів
є реакція окислення останніх перманганатом калію у присутності сірчаної
кислоти. Сірчана кислота, будучи сильною, витісняє слабшу азотисту кислоту,
яка, будучи дуже нестійкою, розкладається на оксиди азоту. Побічні реакції виділення
азотистої кислоти та її розкладання на оксиди азоту є причиною того, що пряме титрування
розчинів нітритів в сірчанокислому середовищі не дає правильних результатів.
Тому застосовується інша техніка.
До відміряної кількості робочого розчину перманганату калію добавляють розведену
сірчану кислоту, суміш нагрівають і доливають до неї нейтральний розчин нітриту
з таким розрахунком, щоб після повного окислення в розчині був ще певний
надлишок KMnO4. За вказаних умов оксиди азоту не
виділяються в повітря, бо в розчині весь час є великий надлишок KMnO4, який повністю окислює азотисту
кислоту. Таким чином, реакція йде за рівнянням:
2KMnO4 + 5NaNO2 + 3H2SO4 → 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O.
Після
вищезазначених процесів вміст нітритів обчислюють за відповідною формулою.
№ 145-146
За допомогою якого методу кількісного аналізу можна визначити вміст у
складі зразка мінерального добрива, рослини, води грунтів або інших об’єктів:
солей кальцію і магнію (тимчасової твердості води)
Дати загальну характеристику методу, який для цього застосовується.
Описати основні етапи виконання даного аналізу
Тимчасова
твердість води зумовлена вмістом у воді бікарбонатів кальцію і магнію. Виявити,
рівно як і позбутися її, можна процедурою кип’ятіння. При цьому йде реакція:
Ca(HCO3)2 → CaCO3↓ + CO2↑ + H2O
Після цього
вміст бікарбонатів обчислюють за відповідною формулою.
№ 147
За допомогою якого методу кількісного аналізу можна визначити
вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших
об’єктів: солей кальцію і магнію (постійної твердості води)
Дати загальну характеристику методу, який
для цього застосовується. Описати основні етапи виконання даного аналізу. Постійну
твердість води визначають комплексонометрією. В основі комплексонометричного
визначення постійної твердості води лежить титрування відміряного об’єму води
0,1 н розчином трилону Б в присутності індикатора хромогену чорного
спеціального (ЕТ-00). Для
визначення беруть таку кількість води, щоб загальний вміст солей кальцію і
магнію, по можливості, не перевищував 0,5 мг-екв. Так як 1 мл 0,1 н розчину
трилону Б відповідає 0,1 мг-екв, на титрування має витрачатись не більше 5 мл
0,1 н розчину трилону.
Пробу води розводять дистильованою водою приблизно до 100 мл, доливають 5
мл буферного розчину (суміш NH4Cl і NH4OH), після чого добавляють краплинами
індикатор до утворення помітного винно-червоного забарвлення. Потім титрують
розчином трилону Б до переходу забарвлення в синє із зеленуватим відтінком. І
нарешті, обчислюють вміст солей кальцію і магнію (мг-екв) за формулою:
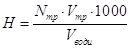
де Nтр – нормальність розчину
трилону; Vтр – об’єм розчину трилону,
витраченого на титрування води; Vводи – об’єм взятої для аналізу води.
№ 148
За допомогою якого методу кількісного
аналізу можна визначити вміст у складі зразка мінерального добрива, рослини,
води, грунтів або інших об’єктів: фосфору
Дати загальну характеристику методу, який для цього застосовується. Описати
основні етапи виконання даного аналізу
Фосфор
визначають двома ваговими методами. Один з них – цитратний.
Суть методу в тому, що фосфор осаджують у вигляді магній-амоній фосфату. Прожарюючи
осад, дістають пірофосфат магнію, за масою якого знаходять вміст фосфору. Метод
дістав свою назву від того, що іони металів утримують в розчині за допомогою
цитратної кислоти.
Інший метод – молібдатний. Суть методу в тому, що фосфор
осаджують у вигляді фосфорно-молібденовокислого амонію (NH4)3[P(Mo3O10)4]. Цей осад фільтрують
крізь скляний фільтр, висушують і зважують.
Вміст фосфорного ангідриду обчислюють за відповідними розрахунковими
формулами.
№ 149
За допомогою якого методу кількісного аналізу можна визначити вміст у
складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: оцтової
кислоти. Дати загальну характеристику методу, який для цього застосовується. Описати
основні етапи виконання даного аналізу
Оцтову кислоту визначають методом нейтралізації. Фактично
відбувається титрування слабкої оцтової кислоти сильною основою NaOH. При цьому йде реакція:
CH3COOH + NaOH ↔ CH3COONa + H2O
Для визначення концентрації оцтової кислоти зважують бюкс з притертою
кришкою, в який наливають 5–10 мл води. Потім у бюкс наливають 1–1,5 мл оцтової
кислоти, закривають кришкою, знову зважують, розчин переносять у колбу об’ємом
250 мл, доводять до риски і перемішують. У конічній колбі на 150–200 мл
піпеткою беруть по 25 мл титрованого розчину NaOH, добавляють по 1–2 краплинах
фенолфталеїн і титрують приготовленим розчином оцтової кислоти. Нарешті, вміст
оцтової кислоти розраховують за відповідною формулою.
№ 150
За допомогою якого методу кількісного
аналізу можна визначити вміст у складі зразка мінерального добрива, рослини,
води, грунтів або інших об’єктів: гідроксиду натрію. Дати загальну характеристику методу, який для цього
застосовується. Описати основні етапи виконання даного аналізу
Застосовуваний метод має назву метод нейтралізації.
Загальна характеристика: кислотно-основне титрування до досягнення точки
еквівалентності, тобто моменту, коли кількості двох реагуючих речовин стануть
еквівалентними.
Для визначення гідроксиду натрію у закритому бюксі зважують 0,8–1,2 г препарату,
наважку переносять у вимірювальну колбу на 250 мл, розчиняють у воді, з якої
видалено вуглекислоту, об’єм доводять до риски і добре перемішують. Беруть кілька
проб по 250 мл, добавляють 1–2 краплі фенолфталеїну і титрують робочим розчином
HCl (нормальність якого була попередньо
встановлена за бурою) до знебарвлення розчину. Після цього вміст NaOH обчислюють за відповідною розрахунковою
формулою.
Література
1) І.В. П’ятницький
“Аналітична хімія”, Київ, Вища школа, 1969;
2) И. Шапиро, В.
Шапиро “Аналитическая химия”, М.,Наука, 1978
|