Учебное пособие: Методы органического синтеза
Учебное пособие: Методы органического синтеза
"Методы органического
синтеза"
Введение
Органический
синтез - раздел органической химии, в котором рассматриваются пути и
методы искусственного создания органических соединений в лаборатории и
промышленности. Широко применим в лабораторных условиях (главным образом для
исследовательских целей) и в промышленности.
Успешное
развитие органического синтеза началось после разработки теории химического
строения и накопления сведений о химических свойствах органических соединений
(2‑я пол. 19 в.). С этого времени органический синтез как основной
источник новых органических соединений играет фундаментальную роль в становлении
органической химии как науки и в ее дальнейшем развитии, обеспечивая постоянно
расширяющийся круг изучаемых объектов. Развитие органического синтеза в 20 в.,
особенно в последние десятилетия, характеризуется все возрастающим вниманием к
синтезу природных соединений и их аналогов, значительным укреплением
методической базы (созданием надежных синтетических методов), началом создания
самостоятельной теории органического синтеза. Осуществление синтеза сложнейших
природных соединений (например хлорофилла, витамина В12,
биополимеров), создание материалов с необычными свойствами (например так
называемые органические металлы) показывает, что для современного органического
синтеза практически не существует неразрешимых задач.
В
реферате рассмотрены вопросы, касающиеся планирования органического синтеза,
т.е. выбора оптимального пути получения соединения с заранее заданной
структурой. Конкретные методы синтеза – образование новой связи С–С, введение
функциональных групп и другое.
Обычно
синтез целевого соединения осуществляют из относительно простых и доступных (т.е.
выпускаемых промышленностью) исходных веществ. Как правило, при синтезе сложных
веществ путь от исходных соединений к целевому разбивается на ряд этапов
(стадий), на каждом из которых происходит образование одной – двух связей
(фрагментов) будущей молекулы или подготовка к образованию таких связей.
Осуществление
органического синтеза сопряжено с решением двух основных вопросов: 1)
разработка общего плана синтеза, т.е. выбор оптимальных исходных соединений и
последовательности стадий, ведущих кратчайшим путем к целевому продукту
(стратегия синтеза); 2) выбор (или разработка новых) синтетических методов,
обеспечивающих возможность построения необходимой связи в определенном месте
собираемой молекулы (тактика синтеза).
Основу
тактики органического синтеза составляют различные синтетические методы, каждый
из которых представляет собой стандартную совокупность одной или нескольких
реакций и приемов выделения продуктов, которые обеспечивают возможность
построения или разрыва определенного типа связи (или связей), необходимой для
синтеза целевого соединения. Важные характеристики эффективного синтетического
метода – общность (слабая зависимость результата от конкретных особенностей
структуры исходных соединений), селективность (участие в основных реакциях
метода лишь определенных функциональных групп) и высокие выходы продуктов.
Типичным примером эффективного синтетического метода может служить синтез
олефинов по Виттигу (реакции 1–3) из алкилгалогенидов и карбонильных
соединений:

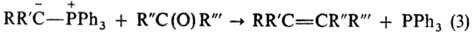
Основные
методы органического синтеза можно разбить на три группы: 1) конструктивные,
ведущие к образованию новых связей С–С, назначение которых – построение скелета
будущей молекулы (например, реакция Гриньяра, реакция Фриделя-Крафтса, цикло –
присоединение); 2) деструктивные, ведущие к разрыву определенных связей С–С с
целью удаления той или иной группировки из молекулы после того, как ее роль в
синтезе сыграна (например, декарбоксилирование, периодатное окисление диолов);
3) методы трансформации функциональных групп. Последнее важно для введения в
молекулы исходных или промежуточных соединений функциональных групп и их защиты,
требующихся для осуществления очередной конструктивной реакции, а на
заключительных стадиях синтеза-для введения необходимых функциональных групп в
целевое соединение.
Алкилирование
и ацилирование
Реакция
Шоттена-Баумана, ацилирование спиртов или аминов хлорангидридами карбоновых к-т в
присут. водного р-ра щелочи или соды (акцепторов образующегося НС1):
RCOC1
+ HOR' + NaOH RCOOR' + NaCl + Н2О
RCOC1 + H2NR' + Na2CO3 RCOOR' + NaCl + Н2О
RCOC1 + H2NR' + Na2CO3 RCONHR' +
NaCl + CO2 + H2O RCONHR' +
NaCl + CO2 + H2O
В
качестве акцепторов НС1 применяют также NaHCO3, CaO, MgO, CH3COONa.
Ацилирующими агентами обычно являются трудногидролизуемые хлорангидриды
ароматических к-т (например, бензоилхлорид), а также хлорангидриды высших
алифатических к-т (С10-С18). При ацилировании спиртов
выход сложных эфиров повышается с понижением температуры реакции за счет
снижения гидролиза хлорангидрида и отчасти эфира. Чтобы избежать местных
перегревов, хлорангидрид прибавляют небольшими порциями к р-ру спирта в водной
щелочи при эффективном перемешивании. Поскольку реакционная среда должна
оставаться слабощелочной до конца р-ции, хлорангидрид и щелочь берут с 20–25%-ным
избытком. Эти же правила применимы и для ацилирования аминов. Выходы 60–95%.
Ацилирование легкогидролизующимися хлорангидридами (СОС12, AlkCOCl)
проводят в инертных растворителях (диэтиловый эфир, хлороформ, бензол) в
присутствии мелкоизмельченного порошка щелочи или соды.
Аналогично
спиртам в р-цию вступают тиолы:
RCOC1 + HSR' + NaOH RCOSR' + NaCl
+ Н2О RCOSR' + NaCl
+ Н2О
Ш.‑Б.
р. используют для лабораторного и промышленного получения разложение сложных
эфиров и амидов, например бензанилида C6H5NHCOC6H5.
Реакцию применяют в аналитической практике для идентификации хлорангидридов в
виде их анилидов и аминов в виде бензоильных производных.
Метод впервые применен К. Шоттеном в 1884 для ацилирования аминов и Э. Бауманом
в 1886 для ацилирования спиртов.
Модификация Ш.‑Б. р. – метод Айнхорна, в к-ром вместо щелочи
используют пиридин, служащий одновременно растворителем и акцептором НС1:
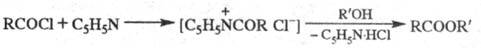
Метод
находит широкое применение благодаря мягким условиям синтеза и высокой
ацилирующей способности пиридиниевой соли. В ряде случаев вместо пиридина
используют третичные амины, например (C2H5)3N
или (CH3)2NC6H5.
Алкилирование, введение алкильной
группы в молекулу органического соединения, а также получение алкильных
производных химических элементов.
Наиб. часто в
качестве алкилирующих агентов используют алкилгалогениды, алкены,
эпоксисоединения, спирты, реже – альдегиды, кетоны, эфиры, сульфиды,
диазоалканы.
Алкилирование
изопарафиновых и ароматических углеводородов проводят: в жидкой фазе в инертном
растворителе при температурах до 100 °С и давлении, необходимом для
поддержания жидкофазного состояния; в паровой фазе с применением гетерогенных
катализаторов при 200–350 °С и давлением 0,3–3,5 МПа. Например,
алкилирование триметилметана бутеном осуществляют в жидкой фазе при 0–10 °С
(кат. – Н25О4) или – 10 °С (HF), алкилирование бензола этиленом- в жидкой
фазе при 90–100 °С (А1С13) или паровой фазе при 250 °С и давлением
3,5 МПа (BF3), алкилирование бензола пропиленом- в жидкой фазе при 50 °С и
давлением 0,7 МПа (HF) или паровой фазе при 300 °С и давлением 0,3–1,0 МПа
(H3P04/Si02).
О – алкилирование
проводят при температурах не выше 100 С в воде или органических растворителях,
например:
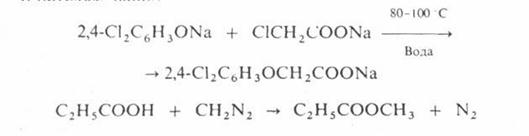
N – алкилирование
аминов спиртами осуществляют в газовой фазе в присутствии кислотных
катализаторов при 200–300 °С, напр.:
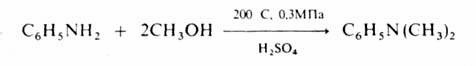
Получение
алкильных производных металлов проводят в присутствии меди, например:

Алкилирование
углеводородов сопровождается полиалкилированием, изомеризацией и
полимеризацией. Так, при этилировании бензола по р-ции Фриделя – Крафтса, кроме
этилбензола, образуются ди- и полиэтилбензолы. Полиалкилирование объясняется
лучшей растворимостью в образующемся каталитическом комплексе алкилатов по
сравнению с исходным в-вом. При использовании в качестве растворителя
нитрометана идет преимущественное образование моноалкилпроизводных. Для
увеличения выхода моноалкилпроизводных уменьшают мольное соотношение олефин:
бензол, а также проводят рециркуляцию полиалкилпроизводных, в результате
которой идет их деалкилирование.
Механизм
алкилирования наиболее подробно изучен на примере С‑и О – алкилирования
реакции с участием алкилгалогенидов, спиртов, сложных эфиров протекают
следующим образом:
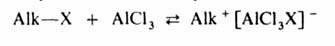 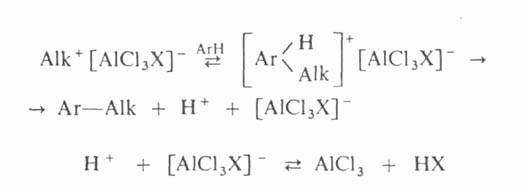
Поскольку
третичные алкилгалогениды ионизируются легче всего, вторичные – труднее, а
первичные практически не ионизируются, вероятность образования соответствующих
карбкатионов уменьшается в том же ряду. Такое же влияние строения алкилирующего
агента отмечено при О – алкилировании, которое в целом протекает как
нуклеофильное замещение у насыщенного атома углерода:
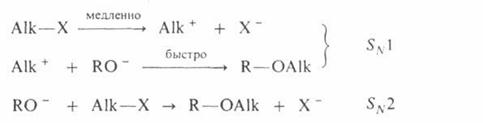
Помимо
приведенных выше реакций, алкилирование применяют в лабораторной практике для
получения алкильных производных карбонильных соединений, дикарбонильных
соединения, при хлорметилировании ароматических углеводородов:
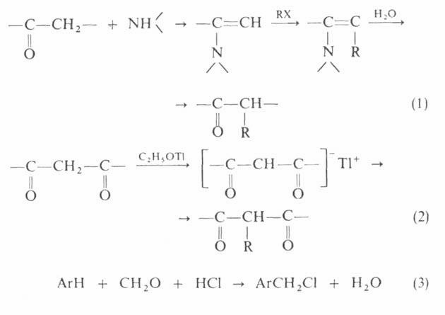
Алкилирование
широко применяется в промышленности, в частности для получения алкилата,
этилбензола, изопропилбензола, высших алкилбензолов.
Реакции
конденсации
Исторически
закрепившееся в органической химии название большой группы реакций различного
характера. В более узком значении – внутри- и межмолекулярные процессы
образования новой связи С–С в результате взаимодействия двух или более молекул
органических соединений. Реакции конденсации можно разбить на след. группы: 1.
Замещение атома или группы атомов с отщеплением простой неорганической или
органической молекулы:
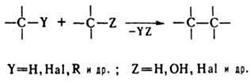
В качестве
конденсирующих агентов используют в-ва, которые связывают отщепляющиеся
соединения, образуют реакционноспособные промежуточные продукты или действуют
как катализаторы. Реакции конденсации с отщеплением воды могут проходить по
одной из след. схем:
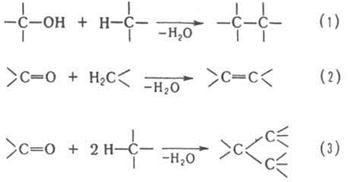
Схеме (1)
соответствуют алкилирование ароматических и непредельных соединений спиртами,
автоконденсация жирных спиртов, например:
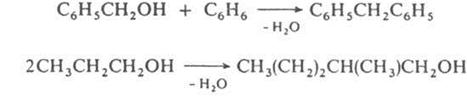
По схеме (2)
протекают кротоновая конденсация и многочисленные родственные процессы,
например Перкина реакция, Кнёвенагеля реакция и др.; по схеме (З) – многие
синтезы ряда трифенилметана, например:
Отщепление воды
катализируется обычно кислотами и основаниями, такими, как H2SO4,
HCl, АlСl3, ZnCl2, NaOH, NaOR, NaNH2, NaH, RNH2.
Некоторые реакции, сопровождающиеся образованием связи углерод–гетероатом или
гетероатом–гетероатом, также относят к реакциям конденсации, например:
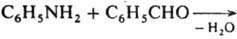
Под действием
металлов реакции конденсации происходят с отщеплением атомов галогена от двух молекул
орг. галогенида (Вюрца реакция, Ульмана реакция). Реакции конденсации с
отщеплением водорода могут осуществляться пиролитически либо под действием окислителей,
например:
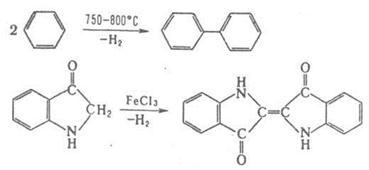
Ряд процессов
реакции конденсации сопровождается отщеплением молекул орг. соединения,
например спиртов. К этому типу принадлежат сложноэфирная конденсация, Клайзена
конденсация, Дикмана реакция. Конденсирующие агенты – щелочные металлы, орг. и
неорг. основания. Обычно к К. р. не относят этерификацию, переэтерификацию,
алкилирование и ацилирование по гетероатомам, однако происходящие по этим
схемам процессы образования полимеров называют поликонденсацией. 2.
Присоединение молекулы органического соединения по кратной связи другой молекулы:
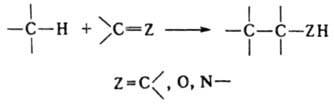
Сюда относят,
например, многочисленные случаи альдольной конденсации, зачастую представляющей
собой предварительную стадию кротоновой конденсации, Михаэля реакцию,
бензоиновую и ацилоиновую конденсации, диеновый синтез, а также реакции гидро-
и карбометаллирования олефинов и ацетиленов.
Диазотирование
Способ
получения ароматических диазосоединений, заключающийся обычно в действии NaNO2
на первичные ароматические амины в присутствии минеральной к-ты НХ:
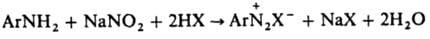
Диазотирование
проводят в воде, концентрированных кислотах, реже – в неводных средах.
Поскольку реакция экзотермична, а диазосоединения при нагревании легко
разлагаются, реакционная смесь обычно охлаждают, поддерживая температуру в
интервале 0–10 °С. При недостатке кислоты могут образовываться
диазоамино- и аминоазосоединения. Производные о-аминонафтолов при
диазотировании окисляются; для предотвращения этого в реакционную смесь
добавляют соли Сu или Zn. Механизм диазотирования включает нитрозирование
свободного амина с последующим отщеплением Н2О от катиона N‑нитрозаммония
(I) или ОН – от N‑нитрозамина (II):
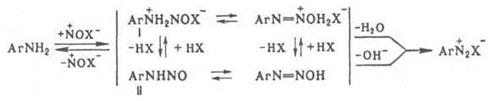
Нитрозирующий
агент NOX образуется по р-ции: NO2- + + 2Н+ +
Х- D NOX + Н2O, где X = ОН, ОС(О) CН3, OSO3H,
NO2, Hal и др. (X расположены в порядке возрастания активности NOX).
Наиболее активный агент – свободный нитрозоний – катион NO+; он
образуется только в концентрированной серной или хлорной к-те. Если NOX
образуется быстрее, чем катион N – нитрозаммония, скорость диазотирования
зависит от концентрации амина. Чем ниже кислотность среды, тем выше концентрация
NO2- и ОН-, а следовательно, и концентрация
малоактивных частиц N2O3 и HNO2, в результате
чего скорость диазотирования должна снижаться. Однако одновременно
увеличивается концентрация свободного амина, что приводит к увеличению скорости
диазотирования. С увеличением кислотности среды, как правило, увеличивается концентрация
наиболее активных NOX, однако уменьшается концентрация свободного амина, что
приводит к снижению скорости диазотирования. Поэтому в слабокислой среде
диазотируют более основные амины, в сильнокислой – менее основные, в
концентрированной H2SO4 с помощью нитрозилсерной к-ты – амины
крайне низкой основности (например, полинитроанилины). Чтобы увеличить скорость
последней р-ции, среду разбавляют ледяной СН3СООН, сдвигая равновесие
в сторону образования свободного амина. При диазотировании обычно к р-ру или
мелкодисперсной суспензии соли амина в к-те прибавляют NaNO2, взятый
с небольшим избытком. При использовании плохо растворимых аминосульфокислот к
слабощелочному р-ру амина, содержащему NaNO2, прибавляют соляную
к-ту. Для выделения галогенидов диазония процесс ведут в абсолютном спирте или
ледяной СН3СООН, используя http://www.xumuk.ru/encyklopedia/909.html водородные соли амина и
в качестве диазотирующего агента – алкилнитриты. Для контроля р-ции в
промышленности используют анализаторы с электро – химической индикацией
избыточной HNO2. Анализатор связан с автоматическим дозиметром,
регулирующим прибавление к-ты, NaNO2 и амина таким образом, чтобы не
возникал избыток нитрозирующего агента. диазотирования – первая стадия синтеза азокрасителей,
а также р-ций Зандмейера, Гомберга, Шимана, Гаттермана, Несмеянова, Барта,
Меервейна. Диазотирование открыто П. Гриссом в 1858.
Нитрование
Введение
нитрогруппы – NO2 в молекулы органических соединений. Может
проходить по электрофильному, нуклеофильному и радикальному механизмам;
активные частицы в этих реакциях – соответственно катион нитрония NO2,
нитрит-ион NO2 и радикал NO2. Нитрование может
осуществляться по атомам С, N, О замещением атома водорода (прямое нитрование)
или других функциональных групп (заместительное нитрование) либо в результате
присоединения группы NO2 по кратной связи.
Электрофильное
нитрование. Среди электрофильных нитрующих агентов доминирующее положение
занимает HNO3. Безводная и конц. HNO3 способны к
самопротонированию: 2HNO3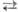 [Н2NО3]+
+ NO3- [Н2NО3]+
+ NO3- 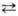 NО2+
+ NO-3 + H2O. Присутствие воды снижает концентрацию
NO+2 и в 93 – 95%-ной HNO3 спектрофотометрически
он уже не обнаруживается. Для увеличения нитрующей активности HNO3
используют ее смеси с H2SO4 или олеумом, к-рые генерируют
NO2, связывая воду: NО2+
+ NO-3 + H2O. Присутствие воды снижает концентрацию
NO+2 и в 93 – 95%-ной HNO3 спектрофотометрически
он уже не обнаруживается. Для увеличения нитрующей активности HNO3
используют ее смеси с H2SO4 или олеумом, к-рые генерируют
NO2, связывая воду:
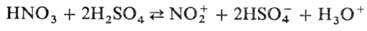
В
безводной H2SO4 при содержании HNO3 меньше 10%
равновесие полностью сдвинуто вправо. Применяют также комбинации HNO3,
разложение оксидов азота и органических нитратов с кислотами Льюиса (АlСl3,
ZnCl2, BF3 и др.); сильным нитрующим действием обладает
смесь HNO3 с (СН3СО)2О благодаря образованию
ацетилнитрата и N2O5 (последний при содержании в смеси
более 90% HNO3 полностью диссоциирует на NO+2
и NO-3); перспективны также смеси HNO3 с
безводным SO3 или N2O5. Вместо HNO3
можно применять ее соли, однако в промышленности такой метод не используют
из-за осложнения процесса регенерации отработанных к-т. В случае слабой
взаимной р-римости нитрующего агента и субстрата, а также для уменьшения
побочных процессов нитрование проводят в органических р-рителях, например
нитрометане, сульфолане, уксусной к-те; полярные р-рители способствуют диссоциации
[H2NO3]+ и тем самым увеличивают концентрацию
NO2.
В
лабораторной практике широко используют апротонные нитрующие агенты (нитраты, соли
нитрония, полинитросоед. и др.), активность которых в реакциях электрофильного
нитрования увеличивается в ряду: AlkONO2 < (CH3)2C(CN) ONO2 < < RC(N02)3 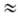 RN(N02)2
< NO2F < CH3COONO2 < < N2O5
< NO2+X-. RN(N02)2
< NO2F < CH3COONO2 < < N2O5
< NO2+X-.
Субстратами
для электрофильного нитрования служат ароматические и гетероциклические соединения,
олефины, относительно сильные СН – кислоты, амины, спирты.
Нитрование
ароматического соединения протекает по схеме:
Возможно
также образование s‑комплекса, в котором группа NO2 связана с атомом
углерода кольца, несущим заместитель. Соединения с электронодопорными
заместителями более реакционноспособны и нитруются в орто- и пара-положения, а
с электроноакцепторными – в мета-положение. В промышленности для нитрования
ароматических соединений применяют в основном смесь HNO3 и H2SO4
(выход нитропродуктов ~ 90–95%). Основная побочная р-ция – окисление,
приводящее, как правило, к деструкции ароматического кольца. В зависимости от
реакционной способности субстрата условия нитрования варьируют в широких
пределах – от водной HNO3 при 0 °С (обязательно присутствие оксидов
азота) до дымящей HNO3 в олеуме при повышенных температурах. При
низких температурах с высокой скоростью протекает нитрование ароматических
соединений солями нитрония; при этом часто лимитирующая стадия-скорость растворения
соли нитрония. Используют также заместительное нитрование – замещение сульфо-,
диазо- и др. функциональных групп. Этим приемом пользуются, в частности, в
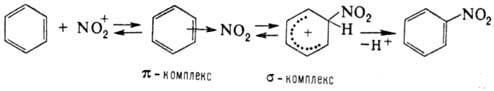
случаях, когда невозможно прямое нитрование. Нитрование олефинов апротонными
нитрующими агентами в зависимости от условий и строения реагентов может идти по
разным направлениям, включая отщепление Н+, присоединение элементов
р-рителя и противоиона, полимеризацию и др., например:
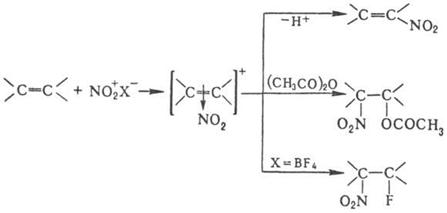
При
нитровании олефинов тетранитрометаном в зависимости от строения олефина
образуются либо алифатическое полинитро – соединение, либо производные
изоксазолидина, например:
Некоторые
СН – кислоты при нитровании образуют анионы соответствующих нитросоединений;
например, при действии на флуорен этил – нитрата в присутствии С, Н5ОК
образуется К – соль 9‑нитро-флуорена, примером нитрования карбанионов
может служить также превращение солей моно- и динитросоединений соответственно
в геминальные ди- и тринитропроизводные при действии FNO2. Соединения
с активированной метиленовой группой можно нитровать и в кислых условиях;
например, при обработке диэтилмалоната HNO3 образуется
нитродиэтилмалонат, нитрование в аналогичных условиях 1,3 – индандиона с
последующим щелочным гидролизом образующегося a – нитрокетона – удобный метод
синтеза первичных нитроалканов:
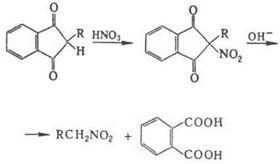
Электрофильное
нитрование аминов в отличие от нитрования по атому С – обратимый процесс и
протекает по схеме:
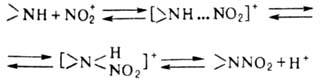
В
промышленности нитрование аминов проводят кислыми нитрующими агентами (конц.
HNO3 или ее смесями с H2SO4, уксусной к-той
или ангидридом). Слабоосновные амины и амиды нитруются с высокими выходами.
Высокоосновные амины (первичные и вторичные), протонирующая форма которых не
реагирует с NO2+, превращают либо в амиды, которые
нитруют и затем снимают защитную ацильную группу щелочным гидролизом, либо в N‑хлорамины;
в последнем случае нитрование проводят в присутствии катализаторов (НСl, ZnCl2).
Нитрование
третичных аминов конц. HNO3 или ее смесью с уксусным ангидридом
сопровождается разрывом связи С– N (такой тип нитрирования называется
нитролизом). Эту реакцию широко используют в промышленности, например для
получения гексагена и октогена из уротропина. Жирно – ароматические амины типа
ArNHR часто нитруются в ядро, что происходит в результате непосредственного
нитрования по атому С или перегруппировки N‑нитропроизводного; при этом
группа NO2 вступает в ортo – положение к аминной функции. В ряде
случаев нитрования по атому N проводят через стадию образования соли. Для этого
амин обрабатывают разб. HNO3 и на образовавшийся нитрат действуют
конц. HNO3 или уксусным ангидридом:
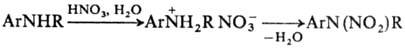
В
лабораторных условиях заместительное нитрование ацетамидов, сульфамидов, уретанов,
имидов или их солей проводят в апротонной среде апротонными нитрующими
агентами, например солями нитрония:
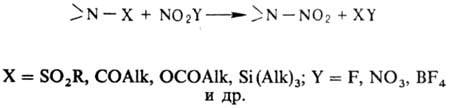
Из
первичных аминов можно синтезировать N, N‑дини-троамины, которые, в свою
очередь, являются нитрующими агентами.
Спирты
нитруют любыми нитрующими агентами, содержащими NO+2 (в
кислых средах р-ция обратима), например: RCH2OH + NO2+X-
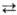 RCH2ONO2 + НХ. RCH2ONO2 + НХ.
Нуклеофильное
нитрование осуществляют солями HNO2:
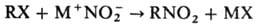
В
реакцию вступают алкилгалогениды, в основном бромиды и иодиды, a‑галогенкарбоновые
к-ты и их эфиры, алкилсульфаты. В качестве нитрующих агентов используют нитриты
щелочных металлов в апротонных диполярных р-рителях или проводят нитрование в
присутствии краун – эфиров. Побочные продукты реакции – органические нитриты,
что связано с двойственной реакционной способностью NO-2.
Реакцию используют для получения алифатических нитросоединений.
Радикальное
нитрование. Характерно в основном для парафинов и олефинов. Источником NO.2
служат HNO.3 и оксиды азота. Нитрование парафинов
проводят разб. HNO3 под давлением при повышенной температуре
(Коновалова реакция). Р-ция нитрования протекает по схеме:
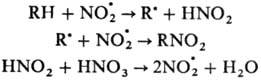
Наряду
с нитрованием идет также процесс окисления, связанный с взаимодействием NO.2
с орг. радикалом по атому кислорода. Наиболее легко протекает нитрование по
третичным атомам углерода, трудно – по первичным. В промышленности
нитропарафины получают жидкофазным и парофазным нитрованием смеси парафинов.
Жидко-фазное нитрование проводят HNO3 при нормальном или повышенном давлении
и температуре выше 180 °С, или оксидами азота при давлении 2–4,5 МПа, 150–220 °С,
время контакта ~15 с. В этих условиях линейные углеводороды нитруются
быстрее, чем их разветвленные изомеры. Парофазное нитрование (метод Хэсса)
осуществляют HNO3 при давлении 0,7–1,0 МПа, 400–500 °С, время
контакта ~ 1 с. Побочные процессы – деструкция углеводородной цепи и окисление.
Эти методы используют также для нитрования алифатических боковых цепей жирно – ароматических
соединений (р-цию проводят в присутствии катализаторов – О2, О3,
галогенов и др.),
Нитрование
непредельных соединений HNO3 приводит к формальному замещению атома водорода
у sp2-гибридизованного атома углерода на группу NO2.
Условия нитрования зависят от строения непредельных соединений. Обычно
применяют 70–80%-ную HNO3 или разб. HNO3 в присутствии оксидов
азота.
Галогенирование (галоидирование)
Введение
галогена в молекулу орг. соединения. Осуществляют путем р-ций замещения
(заместительное галогенирования) или присоединения (присоединительное
галогенирование).
Заместительное
галогенирование. При действии галогенов на насыщ. углеводороды (металепсия)
процесс протекает при инициировании светом по свободнорадикальному цепному
механизму, например:
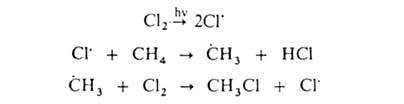
По
свободнорадикальному механизму идет также галогенирование углеводородных цепей
жирноароматических соединений. В присутствии к-т Льюиса р-ция протекает по электрофильному
механизму, напр.:
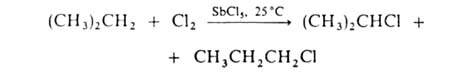
Галогенирование
алифатических карбоновых к-т в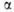 -положение
проводят с помощью С12 или Вг2 в присутствии красного Р
(Гелля-Фолъгарда-Зелинского реакция). Замещение -положение
проводят с помощью С12 или Вг2 в присутствии красного Р
(Гелля-Фолъгарда-Зелинского реакция). Замещение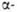 водородных атомов
в алифатических и жирноароматических карбонильных соединений идет через
присоединение галогена к фенольной форме, например: водородных атомов
в алифатических и жирноароматических карбонильных соединений идет через
присоединение галогена к фенольной форме, например:
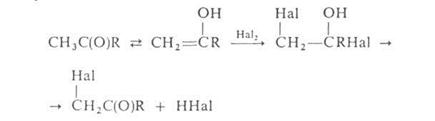
Действием
N – галогенамидов, главным образом N – бромсукцинимида, в присутствии
пероксидов осуществляют свободнорадикальное галогенирование олефинов,
жирноароматических и гетероароматических соединений по метальной или
метиленовой группе, соседней с двойной связью или циклом (Воля – Циглера
реакция).
Замещение
атомов Н на F с образованием полифторзамешенных соединений проводят путем
электрохимеского фторирования в безводном HF (р-ция Саймонса), действием CoF3
и др.
Заместительное
галогенирование в ядро ароматических и гетероароматических соединений протекает
по механизму электрофильного замещения; обычно его осуществляют с
использованием катализаторов (гл. обр. апротонных или протонных к-т), например:
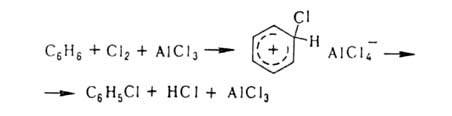
Если
в ядре этих соединений присутствуют пассивирующие заместители, процесс можно
проводить действием катиона галогена, образующегося из молекулярного галогена и
соли Ag в среде сильной протонной к-ты (р-ция Биркенбаха-Губо-Уотерса),
например:
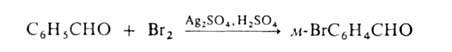
Замещение
на галоген атомов, отличных от водорода, или группы атомов осуществляется чаще
всего по нуклеофильному механизму. В алифатических соединениях для замены атомов
галогенов на иод используют Nal (Финкелъштапна реакция), а на фтор-SbF3
(р-ция Свартса). Группы ОН замещают на хлор или бром действием соответствующих
галогеноводородов, тригалогенидов или оксигалогенидов фосфора, а также
тионилгалогенидов, а на фтор – действием диэтил – 1,1,2 – трифтор‑2‑хлорэтиламина
или SF4. Карбоксильную группу замещают на С1, Вг или I действием на
серебряные соли карбоновых к-т соответствующего галогена (Бородина –
Хунсдиккера реакция). Заменой карбонильного кислорода в альдегидах или кетонах
на галоген (например, с помощью РС15, PBr5, SF4,
MoF6) получают геминальные галогензамещенные.
В
ароматическом ряду для получения галогензамсщеиных используют замену групп NH2
на С1, Вr или I каталитическим разложением соответствующих солей диазония в
присутствии порошка Сu (Гаттермана – Коха реакция) или действием солей Сu
(Зандмепера реакция), а на F‑разложением гидрофторидов диазония (Шимана
реакция). Для галогенирования ароматические и гетероароматические соединения
используют также р-цию замещения (в т.ч. обмен галогенов), протекающую по
механизму присоединения-отщепления с промежуточным образованием анионных комплексов, напр.: комплексов, напр.:
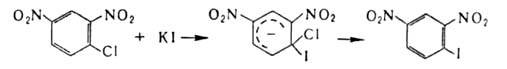
Присоединительное
галогенирование. К ароматическим и гетероароматическим соединениям галоген
присоединяется, как правило, по радикальному механизму под действием света или
при нагревании, например:
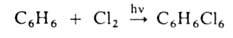
Если
цикл активирован, р-ция может протекать по ионному механизму, к-рый включает
стадию присоединения аниона галогена к промежуточно образующемуся в процессе
электрофильного замещения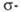 комплексу,
например: комплексу,
например:
Присоединение
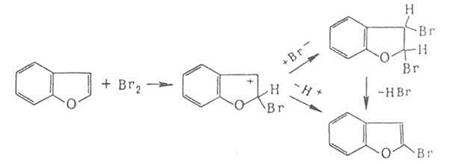
галогенов по кратной связи происходит по электрофильному или радикальному
механизму. Его можно осуществлять действием галогсноводородов, межгалогенных
соединений или гипогалогенитов. В случае электрофильного присоединения может
нарушаться правило Марковникова, что обусловлено образованием промежуточного
мостикового катиона, например:
Сульфирование (сульфонирование).
Введение
сульфо – группы SO2OH в молекулу орг. соединения; в широком смысле
сульфирование – введение группы SO2X (X = ОН, ONa, OAlk, OAr, Hal,
NAlk2 и т.п.). О введении группы SO3H с образованием
связей О–S (О – сульфирование, сульфатирование, сульфоэтерификация).
Процесс,
обратный сульфированию (удаление группы SO2X из молекулы орг.
соединения), называется десульфированием (десульфонированием). Сульфирование
осуществляют прямым путем с использованием сульфирующих агентов либо косвенным
путем, например введением сульфогруппы в составе сульфоалкильных фрагментов (СН2)nSО2Х.
Сульфирующие агенты: H2SO4, SO3 и его
комплексы с орг. соединениями (эфирами, третичными аминами и фосфинами, амидами
карбоновых кислот, триалкилфосфатами и др.), олеум, SOCl2,
галогенсульфонрвые и сульфаминовые к-ты, диалкилсульфаты, ацилсульфаты.
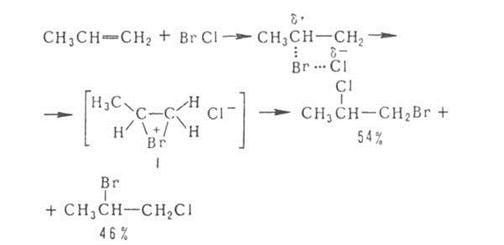
Сульфирование
ароматических углеводородов протекает по механизму электрофильного замещения:
Реакцию
осуществляют как в паровой, так и в жидкой фазе (р-рители: SO2, СС14,
хладоны и т.п.). При сульфировании серной к-той для смещения равновесия вправо
применяют избыток к-ты или связывают воду добавлением олеума, азеотропной
отгонкой и т.п.
Соединение
с электронодонорными заместителями более реакционноспособны и сульфируются
преимущественно в орто- и пара-положения; соединения с электроноакцепторными
заместителями- в мета-положение. В большинстве случаев при сульфировании
замещенных бензолов образуются смеси изомеров, соотношение к-рых зависит от
природы заместителя, сульфирующего реагента и условий р-ций (концентрации
реагентов, т-ры, р-рителя, наличия катализаторов и т.д.). Путем подбора
оптимальных условий возможно селективное сульфирование. Так, сульфирование толуола
серной к-той при 20 °С приводит к равным кол-вам о- и n‑толуолсульфокислот,
а при, использовании SO3 в тех же условиях – исключительно к n‑изомеру;
при сульфировании фенола на холоду преимущественно образуется
о-фгнолсульфокислота, тогда как при 100 °С-n‑фенолсульфокислота. Как
правило, подобные различия обусловлены превращением одних изомеров в другие,
термодинамически более стабильные, благодаря изомеризации или обратимости
сульфирования. Например, нафталин при температурах ниже 100 °С
первоначально образует a‑наф-талинсульфокислоту, к-рая во времени
превращается в b‑изомер в результате последовательного десульфирования – ресульфирования.
Сульфирование при 160 °С приводит исключительно к b‑нафталинсульфокислоте.
Для
сульфирования гетероциклических соединений (фуран, пиррол, тиофен, индол и др.)
используют комплексы SO3 с диоксаном или пиридином. Эти же реагенты
применяют для сульфирования алифатических соединений, содержащих сильные
электроноакцепторные группы; при этом образуются, как правило, a‑сульфопроизводные:
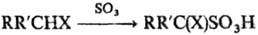
X = СНО, COR:, COOH, CN, NO2, SO3H и др.
Повышение
СН-кислотности алифатических соединений способствует тому, что последующее
сульфирование протекает более однозначно, чем моносульфирование. Например, ацетальдегид
и уксусная к-та с высоким выходом образуют соответствующие да- и
трисульфосоединения:
СН3СНО
+ 2SO3·Диоксан: (HSO3)2CHCHO
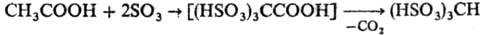
Легко
реагируют с SO3 и его комплексами алкены, которые образуют в
зависимости от структуры и условий b- или d‑сультоны (см. Сулътоны) либо
a, b- или b, g‑ненасыщ. сульфокислоты, а также b‑гидроксисульфокис-лоты,
напр.:
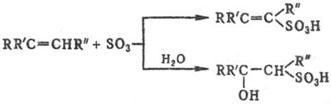
Прямое
С. алканов протекает с трудом и сопровождается, как правило, окислением.
Подобные р-ции редко используют для препаративных целей, но находят им практич.
применение для С. полимеров, напр. полиэтилена, с целью их модификации.
Значительно легче сульфируются углеводороды при совместном действии SO2
и О2 (сульфо-окисление), а также SO2 и Сl2
(сульфохлорирование). Обе р-ции имеют радикальный характер и инициируются
пе-роксидами, УФ или g‑облучением:
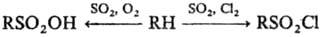
Эти
процессы имеют важное значение в пром. произ-ве ПАВ.
Для
С. орг. соединений широко используют H2SO3 и ее
производные. Гидросульфиты присоединяются к альдегидам и кетонам (р-ция 1), а
также в условиях радикального инициирования к алкенам и алкинам (2,3); взаимод.
с трифенил- и три (n‑толил) карбинолами (4); реагируют с оксиранами, тииранами
с раскрытием кольца (5):
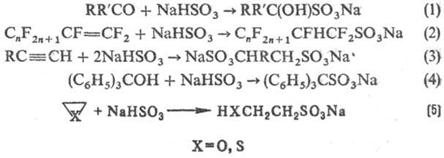
Диазоалканы
сульфируют SO2 в присутствии воды, спиртов, тиолов и аминов (6),
последоват. действие SO2 и галогена на реактивы Гриньяра приводит к
сульфонил-галогенидам (7):
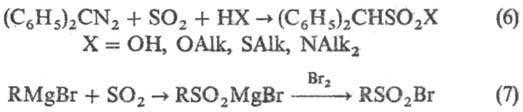
К
косвенным методам С. относят сульфометилирование, сульфоэтилирование и т.д.,
напр.:
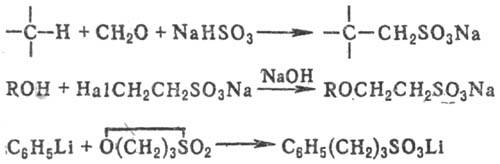
Амины. N‑ОКСИДЫ (N‑окиси аминов).
Производные
третичных аминов и гетероароматич. соединений, содержащие семиполярную связь –О-
Большинство хорошо раств. в воде, ограниченно-в неполярных орг. р-рителях.
Образуют с к-тами устойчивые кристаллич. соли –О-
Большинство хорошо раств. в воде, ограниченно-в неполярных орг. р-рителях.
Образуют с к-тами устойчивые кристаллич. соли
R3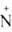 OHX-
Расположение четырех заместителей у атома азота тетраэдрическое. OHX-
Расположение четырех заместителей у атома азота тетраэдрическое.
Свойства
n‑оксидов аминов
| Показатель Т. пл., °С |
(СН3Ь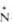 -O-212,0 -O-212,0
|
С6Н5(СН3)2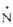 -O -O
|
С5Н5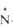 -O-65,6 -O-65,6
|
| Т. кип., °С |
– |
154,0 |
100* |
|
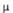 *10-30,
Кл-м *10-30,
Кл-м
|
16,7 |
16,15 |
14,11 |
|
рКа
|
4,65 |
4,21 |
1,90 |
| Потенциал полуволны восстановления,
В |
-0,456 |
-0,705 |
– 1,278 |
|
v(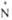 ->O-),
см-1 ->O-),
см-1
|
930–970 |
– |
1230–1320 |
А.о.-более
слабые основания, чем исходные амины. Их основные св-ва определяются отрицат.
зарядом на кислороде, по к-рому происходит как присоединение протона, так и
алкилирование. При действии арилгалогенидов образуются соли тетразамещенного
гидроксиаммония, разлагающиеся при обработке щелочью:
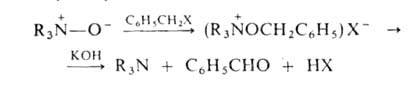
При
ацилировании А.о. происходят след. превращения:
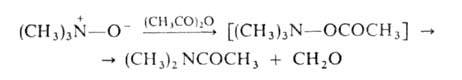
При
нагр. алифатич. А. о. образуют замещенные гидроксиламины (перегруппировка
Майзенхаймера) или олефины (перегруппировка Коупа), напр.:
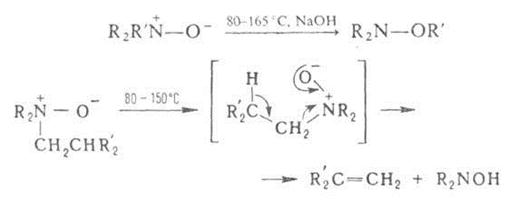
где
R – Alk, Ar; R' = СН2С6Н5, СН(С6Н5)2,
СН2СН=СН2.
А.
о. восстанавливаются до аминов гидрированием на Ni или Pd, а также действием
производных трехвалентного фосфора, напр. (С6Н5bР- В электронной системе цикла гетероциклич. А. о. группа электронной системе цикла гетероциклич. А. о. группа –О – может играть роль как донора, так и акцептора электронов.
Поэтому А. о. такого типа вступают в р-ции электроф. и нуклеоф. замещения
легче, чем соответствующие амины. Ацилирование гетероциклич. А. о. происходит
след. образом: –О – может играть роль как донора, так и акцептора электронов.
Поэтому А. о. такого типа вступают в р-ции электроф. и нуклеоф. замещения
легче, чем соответствующие амины. Ацилирование гетероциклич. А. о. происходит
след. образом:

N‑Оксиды
пиридина и его гомологов, производных хинолина нитруются до 4‑нитропроизводных.
При р-ции с РОС13, РС15, SOC12 образуются 1- и
4‑хлорпроизводные, с ангидридами и галогенангидридами к-т‑2‑ацилоксипроизводные
с металлоорг. соед. – 2‑алкилпроизводные, с анионом CN- в
присут. хлористого бензоила‑4‑цианпиридин.
Общий
метод получения А.о.-окисление третичных аминов действием Н2О2
в нейтральной (алифатич. амины) или кислой (ароматич. амины) средах, реже – озоном
или надкислотами (азотистые гетероциклы). Применяется также исчерпывающее
алкилирование гидроксиламина и его производных, циклизация нитро- и нитрозосоединений.
Методы анализа А. о. основаны на восстановлении группы – О –
(потенциометрия). – О –
(потенциометрия).
Алифатич.
А.о.-ПАВ в космети-ке и парфюмерии, коагулирующие и желатинизирующие агенты, ингибиторы
полимеризации, р-рители целлюлозы. Нек-рые А. о. обладают противомикробной и
противогрибковой активностью.
|