Реферат: Кислотные дожди
Реферат: Кислотные дожди
СОДЕРЖАНИЕ
Введение
I.
Понятие кислотности
II.
Механизм
образования и выпадения кислотных осадков
III.
Влияние кислотных
дождей на экосистемы и людей
Заключение
Список используемой литературы
ВВЕДЕНИЕ
Актуальность
изучения данной темы непосредственно связана с все более ухудшающейся экологической
ситуацией, как в нашей стране, так и непосредственно во всем мире.
Подчеркивая
данное обстоятельство, необходимо отметить, что несколько лет назад выражения «кислотные осадки» и
«кислотные дожди» были известны лишь исключительно ученым, посвященным в
определенных, специализированных областях экологии и химии атмосферы. За
последние несколько лет эти выражения стали повседневными, вызывающими
беспокойство словами во многих странах во всем мире [2, с. 3].
Кислотные
осадки являются проблемой, которая в случае ее бесконтрольного развития, может
вызвать в результате существенные экономические и социальные издержки.
Окисление
почв и вод – это комплекс причин, исходных условий и следующих один за другим
процессов в химической и биологической системах, которые мы обобщенно называем
нашей окружающей средой [2, с. 3].
Часть
процессов окисления является природной, но данные изменения кислотности в
системах почвы и воды, ни по скорости, ни по общему охвату, не могут быть
сравнены с окислением, ставшим результатом собственной деятельности человека в
промышленной и энергетической областях, а также в определенной части
современного использования земли.
Предмет
исследования – процесс образования и выпадения кислотных осадков.
Объект
исследования – кислотные осадки.
Исходя
из всего вышеизложенного, целью данной работы является необходимость
охарактеризовать сущность понятия «кислотный дождь», а также описать влияние
этого явления на экосистемы и людей.
Достижение
данной цели предполагает решение ряда следующих актуальных задач:
1.
Определить
понятие «кислотность».
2.
Охарактеризовать
механизм образования и выпадения кислотных осадков.
3.
Выделить основные
особенности влияния кислотных дождей на экосистему и людей.
В
процессе написания данной работы нами были использованы следующие методы:
1.
Анализ источников и используемой литературы.
2.
Сравнительный метод.
Данная
работа была написана с использованием учебной и монографической литературы.
1 Понятие кислотности
Чтобы
более полно охарактеризовать понятие «кислотный дождь», на наш взгляд,
необходимо определиться с терминологией. На необходимо отметить, что, несмотря
на «постиндустриальное» звучание, этому термину уже более ста лет.
Впервые
он был употреблен в 1872 году англичанином Ангусом Смитом, изучавшим эффекты
смога в Манчестере, однако тогдашние ученые коллегу не поддержали и к теории
кислотных дождей отнеслись скептически. Сегодня же в их существовании нет
никаких сомнений [7, с. 70].
В
силу этого, нам необходимо рассмотреть само понятие «кислотность».
Термин
«кислотность водного раствора» - это химический термин. Кислотность водного
раствора определяется присутствием в нем положительных водородных ионов Н+ и
характеризуется концентрацией этих ионов в одном литре раствора C(H+) (моль/л
или г/л). Щелочность водного раствора определяется присутствием гидроксильных
ионов ОН– и характеризуется их концентрацией C(ОН–) [7, с. 70].
Как
показывают расчеты, для водных растворов произведение молярных концентраций
водородных и гидроксильных ионов – величина постоянная, равная C(H+)·C(OH–) =
10–14, другими словами, кислотность и щелочность взаимосвязаны: увеличение
кислотности приводит к снижению щелочности, и наоборот.
Раствор
является нейтральным, если концентрации водородных и гидроксильных ионов
одинаковы и равны (каждая) 10–7 моль/л. Такое состояние характерно для
химически чистой воды.
Из
сказанного следует, что для кислых сред выполняется условие:
10–7
< C(H+) ≤ 100, а для щелочных сред: 10–14 ≤ C(H+) < 10–7.
В
1909 г. Сорензеном было предложено применять вместо подлинных значений C(H+) и
C(ОН–) их отрицательные логарифмы, чтобы избавиться от отрицательных степеней в
значениях C(H+) и C(ОН–). Отрицательный десятичный логарифм концентрации
водородных ионов называется водородным показателем и обозначается pH: pH = – lg
C(H+).
Шкала
кислотности идет от pH = 0 (крайне высокая кислотность) через pH = 7
(нейтральная среда) до pH = 14 (крайне высокая щелочность). Показатель
кислотности pH различных веществ, встречающихся в повседневной жизни [7, с.
70].
Изменение
значения pH на единицу соответствует изменению концентрации ионов водорода в 10
раз.
Чистая
дождевая вода имеет слабокислый показатель водорода, так как в ней присутствуют
катионы щелочных элементов (Na+, K+) и анионы, такие как HCO 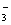 , CO , CO 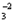 , Cl– и др. В дождевой
воде практически нет щелочноземельных элементов (Ca+2, Mg+2), поэтому она
мягкая (требуется большое количество этой воды, чтобы смыть мыло или шампунь). , Cl– и др. В дождевой
воде практически нет щелочноземельных элементов (Ca+2, Mg+2), поэтому она
мягкая (требуется большое количество этой воды, чтобы смыть мыло или шампунь).
Таким
образом, в заключение данного параграфа, мы непосредственно можем сделать
следующий вывод, о том, что согласно учению о кислотности, широко
распространенный термин «кислотные дожди» обозначает осадки с pH меньше 5,7.
Виной
таким изменениям — оксиды серы и азота, в промышленных масштабах выбрасываемые
в атмосферу автомобилями, электростанциями, металлургическими заводами. В
воздушной среде на частицах сульфатов и нитратов конденсируются молекулы воды,
образуются облачные капельки, которые при определенных погодных условиях становятся
частью дождевых капель или снежинок. Если концентрация сульфатов и нитратов в
атмосфере велика, то дождь или снег получается значительно закисленным [1, с.
198].
II. Механизм
образования и выпадения кислотных осадков
По
ряду показателей, в первую очередь по массе и распространенности вредных
эффектов, атмосферным загрязнителем номер один считают диоксид серы [1, с. 129]
Диоксид
серы, попавший в атмосферу, претерпевает ряд химических превращений, ведущих к
образованию кислот. Частично диоксид серы в результате фотохимического
окисления превращается в триоксид серы (серный ангидрид) SО3, который реагирует
с водяным паром атмосферы, образуя аэрозоли серной кислоты: 2SО2 + О2 = 2SО3,
SО3 + Н2О=Н2SО4. Основная часть выбрасываемого диоксида серы во влажном воздухе
образует кислотный полигидрат SО2 o nН2О, который часто называют сернистой
кислотой и изображают условной формулой Н2SО3: SО2 + Н2О=Н2SО3. Сернистая
кислота во влажном воздухе постепенно окисляется до серной: 2Н2S03 + 02=
2Н2S04.
Аэрозоли
серной и сернистой кислот приводят к конденсации водяного пара атмосферы и
становятся причиной кислотных осадков (дожди, туманы, снег). При сжигании
топлива образуются твердые микрочастицы сульфатов металлов (в основном при
сжигании угля), легко растворимые в воде, которые осаждаются на почву и
растения, делая кислотными росы. Аэрозоли серной и сернистой кислот составляют
около 2/3 кислотных осадков, остальное приходится на долю аэрозолей азотной и
азотистой кислот, образующихся при взаимодействии диоксида азота с водяным
паром атмосферы: 2NО2 + Н2О=НNО3 + НNО2.
Существуют
еще два вида кислотных дождей, которые пока не отслеживаются мониторингом
атмосферы [1, с. 129].
Находящийся
в атмосфере хлор (выбросы химических предприятий; сжигание отходов;
фотохимическое разложение фреонов, приводящее к образованию радикалов хлора)
при соединении с метаном (источники поступления метана в атмосферу:
антропогенный – рисовые поля, а также результат таяния гидрата метана в вечной
мерзлоте вследствие потепления климата) образует хлоро-водород, хорошо
растворяющийся в воде с образованием аэрозолей соляной кислоты:
СL.
+ СН4 =СH.3 + НС1, СH3. + С12= СН3С1 + СL.
Поступление
в атмосферу больших количеств SO2 и окислов азота приводит к заметному
снижению рН атмосферных осадков. Это происходит из-за вторичных реакций в
атмосфере, приводящих к образованию сильных кислот – серной и азотной. В этих
реакциях участвуют кислород и пары воды, а также частицы техногенной пыли в
качестве катализаторов:
2SO2 + О2 + 2Н2О ¾® 2H2SO4;
4NO2 + 2Н2O + О2 ¾®4HNO3.
В
атмосфере оказывается и ряд промежуточных продуктов указанных реакций.
Растворение кислот в атмосферной влаге приводит к выпадению «кислотных дождей».
Показатель
рН осадков в ряде случаев снижается на 2 – 2,5 единицы, то есть, вместо,
нормальных 5,6 – 5,7 до 3,2 – 3,7 [1, с. 130].
Следует
напомнить, что рН – это отрицательный логарифм концентрации водородных ионов,
и, следовательно, вода с рН = 3,7 в сто раз «кислее» воды с рН = 5,7. В
промышленных районах и в зонах атмосферного заноса окислов серы и азота рН
дождевой воды колеблется от 3 до 5 [1, с. 130].
Впервые
кислотные дожди были отмечены в Западной Европе, в частности в Скандинавии, и
Северной Америке в 1950-х гг. Сейчас эта проблема существует во всем
индустриальном мире, и приобрела особое значение в связи с возросшими
техногенными выбросами оксидов серы и азота. За несколько десятилетий размах
этого бедствия стал настолько широк, а отрицательные последствия столь велики,
что в 1982 г. В Стокгольме состоялась специальная международная конференция по
кислотным дождям, в которой приняли участие представители 20 стран и ряда
международных организаций [6, с. 53].
До
сих пор острота этой проблемы сохраняется, она постоянно в центре внимания
национальных правительств и международных природоохранных организаций. В
среднем кислотность осадков, выпадающих в основном в виде дождей в Западной
Европе и Северной Америке на площади почти 10 млн. км2, составляет
5-4,5, а туманы здесь нередко имеют рН, равный 3-2,5. В последние годы
кислотные дожди стали наблюдаться в промышленных районах Азии, Латинской
Америки и Африки. Например, в Восточном Трансваале (ЮАР), где вырабатывается
4/5 электроэнергии страны, на 1 км2 выпадает около 60 т серы в год в
виде кислотных осадков [5, с. 49].
В
тропических районах, где промышленность практически неразвита, кислотные осадки
вызваны поступлением в атмосферу оксидов азота за счет сжигания биомассы. В
России наиболее высокие уровни выпадений окисленной серы и оксидов азота (до
750 кг/км2 в год) на значительных по площади ареалах (несколько тыс.
км2) наблюдаются в густонаселенных и промышленных регионах страны – в
Северо-Западном, Центральном, Центрально-Черноземном, Уральском и других
районах; на локальных ареалах (площадью до 1 тыс. км2) – в ближнем
следе металлургических предприятий, крупных ГРЭС, а также больших городов и
промышленных центров (Москва, Санкт-Петербург, Омск, Норильск, Красноярск,
Иркутск и др.), насыщенных энергетическими установками и автотранспортом.
Минимальные значения рН осадков в этих местах достигают 3,1-3,4 [5, с. 49].
Специфическая
особенность кислотных дождей – их трансграничный характер, обусловленный
переносом кислотообразующих выбросов воздушными течениями на большие расстояния
– сотни и даже тысячи километров. Этому в немалой степени способствует принятая
некогда «политика высоких труб» как эффективное средство против загрязнения
приземного воздуха.
Почти
все страны одновременно являются «экспортерами» своих и «импортерами» чужих
выбросов. Наибольший вклад в трансграничное подкисление природной среды России
соединениями серы вносят Украина, Польша, Германия.
В
свою очередь, из России больше всего окисленной серы направляется в страны
Скандинавии. Соотношения здесь такие: с Украиной – 1:17, с Польшей – 1:32, с
Норвегией – 7:1 [5, с. 50].
Экспортируется
«мокрая» часть выбросов (аэрозоли), сухая часть загрязнений выпадает в
непосредственной близости от источника выброса или на незначительном удалении
от него. Обмен кислотообразующими и другими загрязняющими атмосферу выбросами
характерен для всех стран Западной Европы и Северной Америки. Великобритания,
Германия, Франция больше направляют окисленной серы к соседям, чем получают от
них. Норвегия, Швеция, Финляндия больше получают окисленной серы от своих
соседей, чем выпускают через собственные границы (до 70% кислотных дождей в
этих странах – результат «экспорта» из Великобритании и Германии).
Трансграничный перенос кислотных осадков – одна из причин конфликтных
взаимоотношений США и Канады.
3. Влияние кислотных дождей на
экосистемы и людей
Выпадение
кислотных осадков на современном этапе биосферы представляет собой достаточно
насущную проблему и оказывает достаточно негативное воздействие на биосферу.
Причем
негативное влияние кислотных дождей наблюдается в экосистемах многих стран.
Особенно
негативное воздействие от выпадения «кислотных дождей» ощутила на себе
Скандинавия.
В
70-х годах в реках и озерах скандинавских стран стала исчезать рыба, снег в
горах окрасился в серый цвет, листва с деревьев раньше времени устлала землю.
Очень скоро те же явления заметили в США, Канаде, Западной Европе. В Германии
пострадало 30%, а местами 50% лесов [3, с. 67]. И все это происходит вдали от
городов и промышленных центров. Выяснилось, что причина всех этих бед —
кислотные дожди.
Показатель
рН меняется в разных водоемах, но в ненарушенной природной среде диапазон этих
изменений строго ограничен. Природные воды и почвы обладают буферными
возможностями, они способны нейтрализовать определенную часть кислоты и
сохранить среду. Однако очевидно, что буферные способности природы не
беспредельны.
В
водоемы, пострадавшие от кислотных дождей, новую жизнь могут вдохнуть небольшие
количества фосфатных удобрений; они помогают планктону усваивать нитраты, что
ведет к снижению кислотности воды. Использование фосфата дешевле, чем извести,
кроме того, фосфат оказывает меньшее воздействие на химию воды.
Земля
и растения, конечно, тоже страдают от кислотных дождей: снижается
продуктивность почв, сокращается поступление питательных веществ, меняется
состав почвенных микроорганизмов.
Огромный
вред наносят кислотные дожди лесам. Леса высыхают, развивается суховершинность
на больших площадях. Кислота увеличивает подвижность в почвах алюминия, который
токсичен для мелких корней, и это приводит к угнетению листвы и хвои, хрупкости
ветвей. Особенно страдают хвойные деревья, потому что хвоя сменяется реже, чем
листья, и поэтому накапливает больше вредных веществ за один и тот же период.
Хвойные деревья желтеют, у них изреживаются кроны, повреждаются мелкие корни.
Но и у лиственных деревьев изменяется окраска листьев, преждевременно опадает
листва, гибнет часть кроны, повреждается кора. Естественного возобновления
хвойных и лиственных лесов не происходит.
Все
больший ущерб кислотные дожди наносят сельскохозяйственным культурам:
повреждаются покровные ткани растений, изменяется обмен веществ в клетках,
растения замедляют рост и развитие, уменьшается их сопротивляемость к болезням
и паразитам, падает урожайность.
Специалисты
американского университета штата Северная Каролина изучили воздействие,
оказываемое кислотными дождями на растения в период их максимальной
восприимчивости к факторам внешней среды. Под влиянием кислотных дождей
непосредственно после опыления в початках кукурузы формировалось меньше зерен,
чем при орошении чистой водой. Причем чем больше в дождевой воде содержалось
кислоты, тем меньше зерен образовывалось в початках. Вместе с тем выяснилось,
что кислотные дожди, прошедшие до опыления, не оказывали заметного влияния на
формирование зерен.
Проведены
исследования степени восприимчивости к кислотным дождям 18 видов
сельскохозяйственных культур и 11 видов декоративных растений на ранних стадиях
роста. Наиболее подвергнутыми вредоносному воздействию оказались листья
томатов, сои, фасоли, табака, баклажанов, подсолнечника и хлопчатника. Наименее
восприимчивыми — озимая пшеница, кукуруза, салат, люцерна и клевер [3, с. 67].
Кислотные
дожди не только убивают живую природу, но и разрушают памятники архитектуры.
Прочный, твердый мрамор, смесь окислов кальция (СаО и СО2),
реагирует с раствором серной кислоты и превращается в гипс (СаSО4).
Смена
температур, потоки дождя и ветер разрушают этот мягкий материал. Исторические
памятники Греции и Рима, простояв тысячелетия, в последние годы разрушаются
прямо на глазах. Такая же судьба грозит и Тадж-Махалу — шедевру индийской
архитектуры периода Великих Моголов, в Лондоне — Тауэру и Вестминстерскому
аббатству. На соборе Св. Павла в Риме слой портлендского известняка разъеден на
2,5 см. В Голландии статуи на соборе Св. Иоанна тают, как леденцы. Черными
отложениями изъеден королевский дворец на площади Дам в Амстердаме.
Более
100 тыс. ценнейших витражей, украшающих соборы в Шатре, Контербери, Кёльне,
Эрфурте, Праге, Берне, в других городах Европы могут быть полностью утрачены в
ближайшие 15— 20 лет.
Изучив
новые данные о кислотности осадков, выпадающих в различных регионах Западной
Европы, и о воздействии их на здания и сооружения, сотрудники Дублинского
университета (Ирландия) выявили, что самое катастрофическое положение сложилось
в центре Манчестера (Великобритания), где за 20 месяцев кислотные осадки
растворили более 120 г на 1 м2 камня (песчаника, мрамора или известняка).
Город
пострадал очень сильно, хотя общее количество осадков в наблюдаемый отрезок
времени там было крайне низким. Очевидно, слишком высока была степень их
кислотности.
За
Манчестером следует Липхун (графство Гэмпшир в Великобритании) и Антверпен (Бельгия),
где каждый камень под открытым небом потерял 100 г с 1 м2. Даже
такие известные загрязненностью атмосферы города, как Афины, Копенгаген и
Амстердам, подверглись кислотному разрушению в значительно меньшей степени.
Страдают
от кислотных дождей и люди, вынужденные потреблять питьевую воду, загрязненную
токсическими металлами — ртутью, свинцом, кадмием.
Спасать
природу от закисления необходимо. Для этого придется резко снизить выбросы в
атмосферу окислов серы и азота, но в первую очередь сернистого газа, так как
именно серная кислота и ее соли на 70—80% обусловливают кислотность дождей,
выпадающих на больших расстояниях от места промышленного выброса.
Наблюдения
за химическим составом и кислотностью осадков в России ведут 131 станция,
отбирающие на химический анализ суммарные пробы, и 108 пунктов, на которых в
оперативном порядке измеряют только величину рН. Пробы осадков на содержание
от 11 до 20 компонентов анализируются в пяти кустовых лабораториях [1, с. 132].
Система
контроля загрязнения снежного покрова на территории России осуществляется на
625 пунктах, обследующих площадь в 15 млн. км2. Пробы забирают на
наличие ионов сульфата, нитрата аммония, тяжелых металлов, определяют значение
рН [1, с. 132].
Природные
осадки имеют разную кислотность, но в среднем рН=5,6. Кислотные осадки с рН
< 5,6 представляют серьезную угрозу, особенно если величина рН падает ниже
5,1.
Ниже
нами перечисляются основные последствия выпадения кислотных осадков.
- Повреждение
статуй, зданий и отделки автомобилей.
- Гибель
рыб, водных растений и микроорганизмов в озерах и реках.
- Понижение
способности к воспроизводству лососей и форели при рН < 5,5.
- Гибель
и понижение продуктивности многих видов фитопланктона, когда рН<6 — 8.
- Разрыв
азотного цикла в озерах, когда величина рН колеблется от 5,4 до 5,7.
- Ослабление
или гибель деревьев, особенно хвойных пород, произрастающих на больших высотах,
из-за вымывания из почвы кальция, натрия и других питательных веществ.
- Повреждение
корней деревьев и гибель многих видов рыб из-за высвобождения из почв и донных
осадков ионов алюминия, свинца, ртути и кадмия.
- Ослабление
деревьев и усиление их подверженности болезням, насекомым, засухам, грибам и
мхам, которые процветают в кислой среде.
- Замедление
роста культурных растений, таких, как помидоры, соя, фасоль, табак, шпинат,
морковь, капуста-брокколи и хлопок.
- Рост
популяции 81агола, простейшего, вызывающего серьезную кишечную инфекцию,
которая поражает скалолазов и альпинистов, пьющих воду из, казалось бы, чистых
горных ручьев.
- Возникновение
и обострение многих болезней дыхательной системы человека, преждевременная
гибель людей.
Кислотные
осадки иллюстрируют пороговый эффект. Большинство почв, озер и рек содержат
щелочные химические вещества, которые могут взаимодействовать с некоторым
количеством кислот, нейтрализуя их. Однако регулярное многолетнее воздействие
кислот истощает большинство из этих сдерживающих закисление веществ. Затем как
бы внезапно начинается массовая гибель деревьев и рыб в озерах и реках. Когда
это происходит, какие-либо меры по предотвращению серьезного ущерба
предпринимать уже поздно. Опоздание составляет 10 — 20 лет.
Кислотные
осадки уже являются серьезной проблемой в Северной и Центральной Европе, на
северо-востоке Соединенных Штатов, на юго-востоке Канады, в некоторых районах
Китая, Бразилии и Нигерии. Все большую угрозу они начинают представлять в
промышленных регионах Азии, Латинской Америки и Африки и в некоторых местах на
западе Соединенных Штатов (главным образом из-за сухих осадков). Выпадают кислотные
осадки и в ряде тропических районов, где промышленность практически не развита,
главным образом из-за выделения оксидов азота при сжигании биомассы. Большая
часть кислотообразующих веществ, произведенных в одной стране, переносится
преобладающими приземными ветрами на территорию другой. Более трех четвертей
кислотных осадков в Норвегии, Швейцарии, Австрии, Швеции, Нидерландах и
Финляндии приносится в эти страны ветром из промышленных районов Западной и
Восточной Европы.
Свыше
половины кислотных осадков в густонаселенных районах юго-восточной Канады и
востока Соединенных Штатов обусловлены выбросами крайне сконцентрированных
предприятий угольной и нефтяной энергетики и промышленных предприятий в семи
штатах Центра и верхнего Среднего Запада – Огайо, Индианы, Пенсильвании,
Иллинойса, Миссури, Западной Виргинии и Теннеси. Степень кислотности осадков
над большей частью Востока Северной Америки составляет 4,0-4,2.
Это
в 30-40 раз больше, чем кислотность нормальных осадков, которые выпадали в этих
местах несколько десятилетий назад. Штатами, которые выбрасывают наибольшее
количество кислотообразующих веществ, являются Калифорния, Индиана, Огайо и
Техас.
Около
75% кислотных осадков, выпадающих в Канаде, приносится ветрами из Соединенных
Штатов, и только 15% кислотных осадков, выпадающих в северо-восточных штатах,
обусловлено выбросами на территории самой Канады [1, с. 133].
Такой
большой положительный баланс переноса кислотных осадков между Соединенными
Штатами и Канадой привел к обострению отношений между двумя странами.
Канадские
ученые и чиновники и многие ученые США критиковали правительство США за
недостаточно оперативные действия по уменьшению вредных выбросов промышленных
предприятий и электростанций по крайней мере на 50%. По оценкам Министерства
окружающей среды провинции Онтарио, кислотные осадки угрожают 48 тыс. канадских
озер с их индустрией спортивного рыболовства (1,1 млрд. долларов в год) и
туризма (10 млрд. долларов в год). Канадцы также обеспокоены тем, что кислотные
осадки вредят лесному хозяйству и связанным с ним отраслям, которые дают работу
каждому десятому жителю страны и приносят 14 млрд. долларов в год [1, с. 133].
По
оценке Национальной академии наук, ущерб от кислотных осадков в Соединенных
Штатах уже составляет, по крайней мере, 6 млрд. в год и будет резко возрастать,
если не предпринять немедленных действий. Стоимость сокращения объема этих
загрязнителей составит от 1,2 млрд. до 20 млрд. долларов в зависимости от
степени очистки и технологии, которая будет использована.
В
некоторых областях почвы содержат известняк и другие щелочные вещества, которые
могут нейтрализовать кислоты. Однако кислые почвы в других районах практически
не способны к нейтрализации кислот. Кроме того, повторное воздействие на любые
почвы кислотных осадков может в принципе истощить содержащиеся в них вещества,
нейтрализующие кислоты. Кислотный речной сток может погубить многие формы жизни
в озерах и реках. Так же как и почвы, некоторые озера и реки особенно
чувствительны к воздействию кислоты из-за низкого содержания щелочей (особенно
иона бикарбоната), которые могли бы способствовать нейтрализации поступающих в
них кислот.
ЗАКЛЮЧЕНИЕ
Таким
образом, подводя итог всему вышесказанному, необходимо сделать ряд следующих
выводов.
Несмотря
на «постиндустриальное» звучание, термину «кислотные дожди» уже более ста лет.
Впервые он был употреблен в 1872 году англичанином Ангусом Смитом, изучавшим
эффекты смога в Манчестере, однако тогдашние ученые коллегу не поддержали и к
теории кислотных дождей отнеслись скептически. Сегодня же в их существовании
нет никаких сомнений.
Современная
химия измеряет кислотность растворов в единицах рН. Значение отдельной такой
единицы, равное 7, считается нейтральным, более высокие соответствуют щелочной
среде, более низкие — кислой. Изменение значения рН на один пункт соответствует
изменению кислотности в десять раз.
Расхожее
выражение «кислотные дожди» обозначает осадки с показателем рН меньше, чем 5,7.
Виной
таким изменениям — оксиды серы и азота, в промышленных масштабах выбрасываемые
в атмосферу автомобилями, электростанциями, металлургическими заводами. В
воздушной среде на частицах сульфатов и нитратов конденсируются молекулы воды,
образуются облачные капельки, которые при определенных погодных условиях
становятся частью дождевых капель или снежинок. Если концентрация сульфатов и
нитратов в атмосфере велика, то дождь или снег получается значительно
закисленным.
Косвенным
свидетельством кислотности осадков может быть измерение рН в озерах и водоемах
— их аномальная кислотность уже устойчиво сказывается на флоре и фауне.
Доказано, что в сотнях озер Скандинавии по этой причине пропала рыба. Кроме
того, «кислая вода» способствует лучшей растворимости в ней таких опасных
металлов, как алюминий, кадмий, ртуть, свинец, из почв и донных отложений, а
это ведет к болезням людей, пьющих эту воду.
Растения
на суше также страдают от кислотных дождей, хотя эта проблема менее изучена.
Размеры ущерба, причиненного ими, не поддаются точным измерениям, но даже
локальные исследования дают цифру с девятью нулями.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1.
Акимова, Т. А.,
Кузьмин А. П., Хаскин В. В., Экология. Природа – Человек – Техника: Учебник для
вузов.- М.: ЮНИТИ – ДАНА, 2001.- 343с.
2.
Вронский, В. А.
Кислотные дожди: экологический аспект//Биология в школе.- 2006.- №3.- с. 3-6
3.
Исаев, А. А.
Экологическая климатология.- 2-е изд. испр. и доп.- М.: Научный мир, 2003.-
470с.
4.
Найдыш, В. М.
Концепции современного естествознания: Учебник.- Издание 2-е перераб. и доп.-
М.: Альфа –М; Инфра –М, 2004.- 622с.
5.
Николайкин, Н.
И., Николайкина Н. Е., Мелехова О. П. экология.- 3-е изд. перераб. и доп.- М.:
Дрофа, 2004.- 624с.
6.
Новиков, Ю. В.
Экология, окружающая среда, человек: Учебное пособие.- М.: Гранд: Фаир - пресс,
2000.- 316с.
7.
Откуда берутся «кислотные
дожди»//Вокруг света.- 2005.- №6.- с. 70
|