Реферат: Аминокислоты
Реферат: Аминокислоты
Содержание:
Введение
Классификация аминокислот
Виды изомерии аминокислот
Двухосновные моноаминокислоты
Одноосновные диаминокислоты
Оксиаминокислоты
Серосодержащие аминокислоты
Гетероциклические аминокислоты
Способы получения аминокислот
Химические свойства аминокислот:
А) Свойства аминокислот, зависящие от
наличия карбоксила.
Б) Свойства аминокислот, зависящие от
наличия аминогруппы.
В) Свойства аминокислот, зависящие от
совместного наличия карбоксильной и аминогруппы
Окислительно-восстановительные процессы,
протекающие с участием аминокислот.
Связывание минерального азота
аминокислотами.
Список использованной литературы
Введение
Аминокислоты - такие
кислоты, которые помимо карбоксильной группы содержат аминогруппу NH2.
Классификация
аминокислот
1) по углеводородному
радикалу (предельные, непредельные, ароматические, циклические, гетероциклические.)
2) по числу карбоксильных
групп (одноосновные, двухосновные и тд.)
3) по числу аминогрупп
(моноамино, диамино и тд.)
4) по наличию других
функциональных групп (оксиаминокислоты, серосодержащие аминокислоты)
Виды изомерии
аминокислот
1) изомерия углеродного
скелета
2) изомерия положения
аминогруппы: 2,β, γ и α
В природных условиях,
как правило, встречаются α-аминокислоты. Они образуют мономерные звенья
белковых молекул, то есть входят в состав белка.
3) оптическая изомерия.
Аминокислоты, которые встречаются в природе L-ряда.
Рассмотрим оптическую изомерию на примере α-аминопропионовой кислоты.
  СH3
– *CH – C
= O α-аминопропионовая кислота,
или аланин. СH3
– *CH – C
= O α-аминопропионовая кислота,
или аланин.
NH2
OH
Оптические изомеры:
  ОН OH
ОН OH
  С = О C
= O
С = О C
= O
  Н
– С – NH2 H2N
– C – H Н
– С – NH2 H2N
– C – H
CH3
CH3
D-изомер(-) L-
изомер (+)
L
– изомеры отличаются от D
– изомеров вкусом. D-изомеры
сладкие, а L- изомеры горькие или
безвкусные. Природные аминокислоты это L-
изомеры. В биологическом отношении аминокислоты очень важные соединения, так
как из их остатков строятся белковые молекулы. В состав белков входят 20-25
аминокислот. Это следующие:
  1)
СH2
– C = O
аминоуксусная кислота, или глицин 1)
СH2
– C = O
аминоуксусная кислота, или глицин
NH2
OH
  2)CH3
– CH – C
= O α-
аминопропионовая кислота, аланин 2)CH3
– CH – C
= O α-
аминопропионовая кислота, аланин
NH2
OH
   3)
СH3
– CH – CH – C = O валин 3)
СH3
– CH – CH – C = O валин
CH3 NH2
OH
   4)
CH3 – CH – CH2 – CH – C = O лейцин 4)
CH3 – CH – CH2 – CH – C = O лейцин
CH3
NH2 OH
   5)
CH3 – CH2 – CH – CH – C = O изолейцин 5)
CH3 – CH2 – CH – CH – C = O изолейцин
CH3
NH2 OH
  6)
C6H5 – CH2 – CH – C = O фенилаланин 6)
C6H5 – CH2 – CH – C = O фенилаланин
NH2
OH
Двухосновные
моноаминокислоты
   1) O
= C – CH
– CH2
– C = O
аспарагиновая кислота 1) O
= C – CH
– CH2
– C = O
аспарагиновая кислота
HO
NH2
OH
Амид этой кислоты
называется аспарагин. Причем на аминогруппу замещается гидроксил наиболее
удаленный от аминогруппы:
   O
= C – CH
– CH2
– C = O
- аспарагин O
= C – CH
– CH2
– C = O
- аспарагин
HO
NH2
NH2
   2) O
= C – CH
– CH2
– CH2
– C = O
- глутаминовая кислота 2) O
= C – CH
– CH2
– CH2
– C = O
- глутаминовая кислота
HO
NH2
OH
   O
= C – CH
– CH2
– CH2
– C = O
– глутамин (амид глутаминовой кислоты) O
= C – CH
– CH2
– CH2
– C = O
– глутамин (амид глутаминовой кислоты)
HO
NH2
NH2
Одноосновные
диаминокислоты
   1) CH2
– CH2
– CH2
– CH – C
= O - орнитин 1) CH2
– CH2
– CH2
– CH – C
= O - орнитин
NH2
NH2 OH
   2)
CH2 – CH2 – CH2 – CH2 – CH – C = O
- лизин 2)
CH2 – CH2 – CH2 – CH2 – CH – C = O
- лизин
NH2
NH2
OH
   3) NH
= C – NH
– CH2
– CH2 -
CH2
– CH – C
= O -аргинин, в процессе обмена преобразуется
в к-ту цитруллин 3) NH
= C – NH
– CH2
– CH2 -
CH2
– CH – C
= O -аргинин, в процессе обмена преобразуется
в к-ту цитруллин
NH2
NH2 OH
    4)
NH2 – C – NH – CH2 – CH2 – CH2 – CH
– C = O -цитруллин 4)
NH2 – C – NH – CH2 – CH2 – CH2 – CH
– C = O -цитруллин
O NH2
OH
Оксиаминокислоты
   1)
СH2
– CH – C = O - серин 1)
СH2
– CH – C = O - серин
OH NH2 OH
   2)
CH3 – CH – CH – C = O - треонин 2)
CH3 – CH – CH – C = O - треонин
OH NH2
OH
  3)
HO –C6H4 – CH2 – CH – C = O – оксифенилаланин
или
тирозин 3)
HO –C6H4 – CH2 – CH – C = O – оксифенилаланин
или
тирозин
NH2
OH
Серосодержащие
аминокислоты
   1)
CH2 – CH – C = O - цистеин 1)
CH2 – CH – C = O - цистеин
SH NH2 OH
   2)
CH2 – CH – C = O - цистин 2)
CH2 – CH – C = O - цистин
 S NH2 OH
S NH2 OH
 S
S
  CH2 – CH – C = O
CH2 – CH – C = O
NH2 OH
  3)
CH3 – S – CH2 – CH2 –CH – C = O метионин 3)
CH3 – S – CH2 – CH2 –CH – C = O метионин
NH2
OH
Гетероциклические
аминокислоты
      1)
H2C CH2
2) OH – HC CH2 1)
H2C CH2
2) OH – HC CH2
 OH
OH
     H2C CH – C =
O H2C CH –
C =O
H2C CH – C =
O H2C CH –
C =O
NH
OH NH
пролин
оксипролин
             3)
N C – CH2 – CH – C = O 4)
CH NH2 OH 3)
N C – CH2 – CH – C = O 4)
CH NH2 OH
    NH2 OH HC C C – CH2
– CH – C = O
NH2 OH HC C C – CH2
– CH – C = O
   HC CH
HC C CH
HC CH
HC C CH
NH
CH NH
гистидин
триптофан
Среди всех аминокислот
9 являются незаменимыми, то есть они в тканях синтезироваться не могут и должны
поступать с пищей. Это кислоты:
1)
Валин;
2)
Лейцин;
3)
Изолейцин;
4)
Фенилаланин;
5)
Лизин;
6)
Треонин;
7)
Метионин;
8)
Гистидин;
9)
Триптофан.
Способы получения
аминокислот
1.Аминокислоты
получаются при гидролизе белка, который протекает при
нагревании белковых веществ при температуре равной 1000С , в
присутствии серной кислоты в течении 24-48 часов. Этот способ применяется при
количественном и качественном определении аминокислот в белке, как правило,
методом хроматографии.
2.Действие аммиака на
галогенкислоты:
     CH2
– C = O
+ NH3
HCL + CH2
– C = O CH2
– C = O
+ NH3
HCL + CH2
– C = O
CL
OH
NH2
OH
хлоруксусная
глицин
кислота
3. Присоединение аммиака к непредельным
кислотам (таким способом получают β-аминокислоты).
    CH2
= CH – C = O + HNH2 CH2 – CH2
– C = O CH2
= CH – C = O + HNH2 CH2 – CH2
– C = O
OH
NH2
OH
акриловая к-та β –
оксипропионовая к-та
Присоединение водорода идет против
правила Марковникова, так как сопряженные двойные связи.
4.Восстановительное аминирование.
Протекает в растительных и животных организмах. Это способ связан с введением
аминогруппы в кетокислоту. Протекает в два этапа:
   ОН
OH ОН ОН
OH ОН
     С = О +NH3
C = O
+2H.
С = O С = О +NH3
C = O
+2H.
С = O
   С = О -H2O
C = NH
СH – NH2 С = О -H2O
C = NH
СH – NH2
СН3 CH3
CH3
пировино-
иминокислота аланин
градная
к-та
Химические свойства аминокислот:
Они зависят от наличия:
1)карбоксильной группы
2)аминогруппы
3)от совместного наличия двух этих
групп.
А) Свойства аминокислот, зависящие от
наличия карбоксила.
Аминокислоты, как и любые кислоты,
способны образовывать: а)соли; б)галогенангидриды; в)сложные эфиры; г)амиды;
д)ангидриды; е)подвергаются декарбоксилированию.
  R – CH – C = O + H2O - соль
R – CH – C = O + H2O - соль
   NH2 ONa NH2 CL
NH2 ONa NH2 CL
 R – CH – C = O –хлорангидрид
R – CH – C = O –хлорангидрид
       R
– CH – C = O R – CH – C =
O + H2O R
– CH – C = O R – CH – C =
O + H2O
NH2
OH NH2
O – CH3 – сложный эфир
  R – CH – C = O + H2O
R – CH – C = O + H2O
NH2 NH2 – амид
 R – CH2
-
амин
R – CH2
-
амин
NH2
Реакция
декарбоксилирования аминокислот протекает в присутствии ферментов
декарбоксилаз, а также при разложении белковых соединений, в результате таких
реакций образуются амины (низшие амины содержатся в кишечных газах и имеют
неприятный запах).
   NH2
– CH2 – CH2 – CH2 – CH2 – CH – C =
O -CO2 NH2 – (CH2)5 –
NH2 NH2
– CH2 – CH2 – CH2 – CH2 – CH – C =
O -CO2 NH2 – (CH2)5 –
NH2
лизин
NH2
OH диамин
пептаметилендиамин (кадаверин)
Б) Свойства
аминокислот, зависящие от наличия аминогруппы.
1) Реакции ацилирования
(ацил- радикал кислоты). По этой реакции один водород аминогруппы замещается на
радикал кислоты – ацил. Примером может служить реакция обезвреживания бензойной
кислоты в организме животных:
     C6H5
– C = O + HNH2 – CH2 – C = O C6H5
– C = O OH C6H5
– C = O + HNH2 – CH2 – C = O C6H5
– C = O OH
OH
OH NH
– CH2
– C = O
бензойная к-та глицин
гиппуровая к-та
2) Реакция аминирования
(амин- углеводородный радикал). По этой реакции один водород аминогруппы
замещается на углеводородный радикал – амин (такие реакции проводятся в лаборатории,
когда надо протитровать аминокислоту, то есть количественно определить
аминокислоту).
 OH
OH
    CH3
– CH – C = O + CH3 – I HI + CH3 – CH – C = O CH3
– CH – C = O + CH3 – I HI + CH3 – CH – C = O
NH2
OH
NH – CH3
аланин
пористый
метил
По этой реакции
аминогруппа как бы зажимается в тиски, блокируется и становится нереакционноспособной.
Реакционноспособной становится только карбоксильная группа.
3) Реакции
дезаминирования. Дезаминирование- это отщепление
аминогруппы в виде аммиака. Такие реакции протекают в обменных процессах, а
часто и при нарушении обмена. Они ведут к распаду аминокислот. Различают четыре
вида дезаминирования:
а) окислительное
дезаминирование.
   OH
OH OH OH
OH OH
     C
= O +O C = O +H2O C
= O + NH3 C
= O +O C = O +H2O C
= O + NH3
   CH
– NH2 ОКИСЛЕНИЕ
C = NH
C = O CH
– NH2 ОКИСЛЕНИЕ
C = NH
C = O
CH3
CH3 CH3
аланин иминокислота кетокислота
(пировиноградная)
Окислительное дезаминирование – процесс,
обратный восстановительному аминированию.
б) восстановительное дезаминирование.
Протекает под действием водорода:
  OH
OH OH
OH
   C
= O +2H C = O + NH3 C
= O +2H C = O + NH3
  CH
– NH2
CH2 CH
– NH2
CH2
CH3 CH3
аланин пропионовая(предельная) к-та
в) гидролитическое
дезаминирование. Протекает под действием воды. При этом
из аминокислоты образуются оксикислоты:
  OH
OH OH
OH
   C
= O +HOH
C = O
+ NH3 C
= O +HOH
C = O
+ NH3
  CH
– NH2 CH – OH CH
– NH2 CH – OH
CH3 CH3
аланин оксикислота (молочная)
г) внутримолекулярное дезаминирование:
  R
R R
R
   CH2
CH CH2
CH
   CH
– NH2
ПРОТЕКАЕТ В ОСНОВНОМ В МИКРООРГАНИЗМАХ CH
+ NH3 CH
– NH2
ПРОТЕКАЕТ В ОСНОВНОМ В МИКРООРГАНИЗМАХ CH
+ NH3
  C
= O
C = O C
= O
C = O
OH
OH
непредельная к-та
Основной путь
дезаминирования – это окислительное дезаминирование. Этот вид дезаминирования
преобладает у животных, растений и большинства микроорганизмов. Происходит под
действием ферментов дегидрогеназ. Однако, активность дегидрогеназы тканей
животных для большинства аминокислот очень низкая. Активна только дегидрогеназа
глутаминовой кислоты. Поэтому большинство аминокислот в организме животных
дезаминируются непрямым путем. Непрямое окислительное дезаминирование характеризуется
предварительным переаминированием аминокислот с α- кетоглутаровой
кислотой:
  COOH COOH
COOH COOH
    R
CH2 R
CH2 R
CH2 R
CH2
      CH
– NH2 + CH2
C = O + CH2 CH
– NH2 + CH2
C = O + CH2
  COOH
C = O COOH CH – NH2 COOH
C = O COOH CH – NH2
COOH
COOH
амино-
α-кетоглутаровая кетокис- глутаминовая
кислота
к-та лота кислота
Образующаяся при этом
глутаминовая кислота затем дезаминируется под действием глутаматдегидрогеназы
до α-кетоглутаровой кислоты, которая может снова участвовать в непрямом
дезаминировании других аминокислот.
   COOH
COOH COOH COOH
COOH COOH
   CH2
CH2
CH2 CH2
CH2
CH2
     CH2
-2H CH2 +H2O
CH2 + NH3 CH2
-2H CH2 +H2O
CH2 + NH3
   CH
– NH2 C = NH C
= O CH
– NH2 C = NH C
= O
COOH COOH
COOH
глутаминовая иминокислота
α-кетоглутаовая к-та
к-та
В) Свойства аминокислот,
зависящие от совместного наличия карбоксильной и аминогруппы
1)Амфотерные
свойства одноосновных моноаминокислот. Реакция водных растворов таких
аминокислот на лакмус нейтральна. Это объясняется тем, что карбоксильная группа
обладает кислотными свойствами, а аминогруппа – основными. Эти группы
взаимодействуют с образованием, так называемых внутренних солей. Внутренние
соли – это соли, образующиеся в результате взаимодействия кислотных и основных
групп, находящихся в пределах одной и той же молекулы. При образовании
внутренних солей аминокислот ион водорода отщепляется от карбоксильной группы и
присоединяется к аминогруппе, которая превращается как бы в ион замещенного аммония.
Например, для аланина:
     CH3
– CH – C
= O CH3
– CH – C
= O - CH3
– CH – C
= O CH3
– CH – C
= O -
NH2
OH +NH3
O
 внутренняя соль (имеет два полюса + и -).
внутренняя соль (имеет два полюса + и -).
ОН
Такие аминокислоты ( с
одной – С = О и одной NH2)
обладают амфотерными свойствами, они могут реагировать как с кислотами, так и с
основаниями, образуя при этом комплексные соли. Взаимодействие аминокислоты с
кислотой:
     CH3
– CH – C = O + H+CL- CH3
– CH – C = O + CH3
– CH – C = O + H+CL- CH3
– CH – C = O +
  +NH3
O-
NH3
OH CL-
+NH3
O-
NH3
OH CL-
комплексная соль, где аминокислота является катионом
    Взаимодействие
со щелочью: Взаимодействие
со щелочью:
     CH3
– CH – C
= O + NaOH
CH3
– CH – C
= O – CH3
– CH – C
= O + NaOH
CH3
– CH – C
= O –
  +NH3
O-
NH2
O-
Na+
+ H2O
+NH3
O-
NH2
O-
Na+
+ H2O
комплексная соль, где аминокислота является анионом
2) Образование ди- три
и полипептидов. Эта реакция протекает в организме под
действием ферментов пептидаз. Она ведет к образованию первичной структуры
белка. При образовании дипептида две аминокислоты связываются пептидной связью.
При этом одна аминокислота реагирует карбоксильной группой , а другая –
аминогруппой.
        CH3
– CH – C = O + HNH – CH2 – C = O -H2O CH3
– CH – C – NH – CH2 – C = O CH3
– CH – C = O + HNH – CH2 – C = O -H2O CH3
– CH – C – NH – CH2 – C = O
NH2
OH OH NH2
O OH
аланин
глицин дипептидаланинглицин
 – С = О
-пептидная связь – С = О
-пептидная связь
NH
Та аминокислота, от
которой уходит гидроксил карбоксильной группы, то есть остается кислотный
радикал – ацил, меняет окончание «ин» на «ил».
3) Особое поведение
аминокислот при нагревании, в присутствии водоотнимающих
веществ.
а) α- аминокислоты
при нагревании образуют циклические амиды –
дикетопиперазины. взаимодействуют две молекулы :
  H3C
H3C H3C
H3C
    CH – C = O CH – C = O
CH – C = O CH – C = O
   H2N
OH -2H2O NH NH H2N
OH -2H2O NH NH
   HO
NH2 O = C – HC HO
NH2 O = C – HC
 O
= C – CH
CH3 O
= C – CH
CH3
CH3
дикетопиперазин (2, 5 –диметил – 3, 6 дикетопиперазин)
Для разных кислот
радикалы при группе – СН могут быть разными, а ядро дикетопиперазина одно и то
же. По мнению русских ученых Землинского, Садикова дикетопиперазины содержатся
в полипептидных цепях. Они связывают остатки аминокислот также, как и пептидные
связи.
б) β-аминокислоты
при нагревании теряют молекулу аммиака и превращаются в непредельные кислоты.
    CH3
– CH – CH2 – C = O -NH3 CH3 – CH
= CH – C = O CH3
– CH – CH2 – C = O -NH3 CH3 – CH
= CH – C = O
NH2
OH
OH
Β-аминомасляная к-та
кротоновая к-та
в) γ-аминокислоты
при нагревании, выделяя воду , образуют внутримолекулярные циклические амиды,
так называемые лактамы:
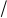 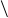    CH2
– CH2 – CH2 – C = O H2C
– CH2 CH2
– CH2 – CH2 – C = O H2C
– CH2
  NH2
OH H2C
C
= O - лактам γ-аминомасляной
к-ты NH2
OH H2C
C
= O - лактам γ-аминомасляной
к-ты
γ-аминомасляная
к-та NH
Лактам капроновой
кислоты при полимеризации образует волокно-капрон.
Окислительно-восстановительные
процессы, протекающие с участием аминокислот.
Эти процессы протекают
в организмах растений и животных. Имеются такие соединения, которые способны
либо выделять водород, либо поглощать его (присоединять). При биологическом
окислении идет отщепление двух атомов водорода, а при биологическом
восстановлении – присоединение двух томов водорода. Рассмотрим это на примере
цистеина и цистина.
      CH2
– CH – C
= O CH2
– CH – C
= O CH2
– CH – C
= O CH2
– CH – C
= O
  HS
NH2 OH -2H S NH2
OH HS
NH2 OH -2H S NH2
OH
       HS
NH2 OH +2H S NH2
OH HS
NH2 OH +2H S NH2
OH
CH2 – CH – C =
O CH2 – CH – C = O
цистеин
цистин
восстановленная форма окисленная форма
Две молекулы цистина,
теряя два атома водорода, образуют окисленную форму – цистеин. Этот процесс
обратимый, при присоединении двух атомов водорода к цистину образуется цистеин
- восстановленная форма. Аналогично протекает процесс окислительно-
восстановительный на примере трипептида – глутатиона, который состоит из трех
аминокислот: глутаминовой, глицина и цистеина.
 цистеин
цистеин
      O
= C – NH – CH – CH2 – SH O = C –
NH – CH – CH2 – S – S –CH2 – CH – NH – C = O O
= C – NH – CH – CH2 – SH O = C –
NH – CH – CH2 – S – S –CH2 – CH – NH – C = O
     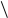  CH2 C = O -2Н
CH2 C = O C =
O CH2
CH2 C = O -2Н
CH2 C = O C =
O CH2
     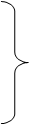   CH2 NH +2Н
CH2 NH
NH CH2
CH2 NH +2Н
CH2 NH
NH CH2
      CH – NH2 CH2 глицин
CH – NH2 CH2 CH2
CH – NH2
CH – NH2 CH2 глицин
CH – NH2 CH2 CH2
CH – NH2
      C = O C = O C
= O C = O C = O C = O
C = O C = O C
= O C = O C = O C = O
OH OH
OH OH OH OH
(2 молекулы)
трипептид восстановленная форма гексапептид
– окисленная форма
При окислении
отщепляется 2 атома водорода и соединяются две молекулы глутатиона и трипептид
превращается в гексапептид, то есть окисляется.
Связывание минерального
азота аминокислотами.
У растений при избытке
азота в почве аминокислоты (аспарагиновая и глутаминовая) способны связывать
его в виде аммиака с образованием амидов – глутамина и аспарагина.
  OH
NH2 OH
NH2
  C
= O C = O C
= O C = O
  CH2
CH2 CH2
CH2
   CH2
+ NH3 CH2 CH2
+ NH3 CH2
  CH
– NH2 CH – NH2 CH
– NH2 CH – NH2
  C
= O C
= O C
= O C
= O
OH
OH
глутаминовая к-та глутамин
Аналогично идет образование
аспарагина. В организмах животных также образуются амиды аспарагиновой и глутаминовой
кислот, которые являются резервом (депо) азота.
Аммиак, который
образуется при дезамиировании аминокислот, может связываться аспарагиновой и
глутаминовой кислотами. При этом образуются амиды аспарагин и глутамин.
Список
использованной литературы:
1) Овчинников Ю.А. Биоорганическая химия / Ю.А.
Овчинников. – М.: Просвещение, 1987.
2)
Яковишин Л.А. Избранные главы
биоорганической химии / Л.А. Яковишин. – Севастополь: Стрижак-пресс, 2006.
3)
Филиппович Ю.В. Основы биохимии. - М., 2007
4)
Нейланд О.Я. Органическая химия.- М., 1990
|