Курсовая работа: Получение серной кислоты путем переработки отходов производства диоксида титана
Курсовая работа: Получение серной кислоты путем переработки отходов производства диоксида титана
ВВЕДЕНИЕ
Сернокислотный метод
производства диоксида титана из ильменита и титановых шлаков имеет ряд
существенных недостатков — сложная многостадийная схема, высокий расход серной
кислоты, значительное количество которой непроизводительно расходуется на
образование больших количеств отходов — сульфата железа (>3 т семиводного
продукта на 1 т TiO2), а также разбавленной 20 — 22%-ной и загрязненной
примесями гидролизной серной кислоты. По этой причине в настоящее время все
большее значение приобретает другой — хлорный метод.
Глава
1. ПРОИЗВОДСТВО ДИОКСИДА ТИТАНА
Чистый диоксид титана
(TiO2) - это бесцветное твердое кристаллическое вещество. Несмотря на
бесцветность, в больших количествах диоксид титана чрезвычайно эффективный
белый пигмент, если он хорошо очищен. TiO2 практически не поглощает никакого
падающего света в видимой области спектра.
Свет или передается, или
преломляется через кристалл или же отражается на поверхностях. TiO2 - это
стабильное (самый стабильное из всех известных белых пигментов), нелетучее,
нерастворимое в кислотах, щелочах и растворах при нормальных условиях вещество.
Диоксид титана отличается высокой реакционной устойчивостью к различным
соединениям, в том числе и к токсичным, содержащимся в воздушной среде. Из-за
своей инертности, диоксид титана не токсичен и, в общем, считается очень
безопасным веществом. Он может контактировать с продуктами в упаковке, а в
определенных концентрациях его можно использовать и как пищевой краситель.
TiO2 - полиморфен и
встречается в трех основных кристаллических формах. Существуют три формы,
анатаз (октаэдрит), рутил и брукит, последний в природе встречаются редко и,
хотя эту форму и готовят в лабораториях, коммерческого интереса она не
представляет.
Рутильный диоксид примерно на 30% лучше рассеивает свет (укрывистость), чем
анатазный, поэтому последний используется гораздо реже. К тому же, анатаз менее
атмосферостоек, чем рутил. Анатаз гораздо хуже работает в защите полимера
(акрилата, пластмассы) от УФ лучей и приводит к фотокатализу и потере свойств
полимера (происходит деструкция, выцветание, меление и т.д.).
Рассеивающая
способность –
способность пигмента к отражению света видимой части спектра определенных длин
волн. Этот показатель у диоксида титана напрямую зависит от диаметра частиц
TiO2. При размере частиц 0,2 мкм сумма рассеянного света для всех длин волн
максимальна. При увеличении размера частицы от 0,25 до 0,3 мкм рассеивание
голубого света быстро понижается. Но рассеивание зеленого и красного
практически не меняется. Тем не менее, при диаметре частиц 0,15 мкм наблюдается
максимальное рассеивание синего, в то время, как рассеивание красного и
зеленого значительно ниже.
Маслоемкость – это способность частиц пигмента
удерживать на своей поверхности определенное количество масла. Выражается она в
граммах на 100 грамм пигмента и колеблется обычно от 10 до 20.
Укрывистостью называют способность пигмента при
равномерном распределении в объеме делать невидимым цвет исходного материала.
Укрывистость выражается в граммах пигмента, необходимого для того, чтобы
сделать невидимым цвет поверхности площадью 1 м2. Белые пигменты обеспечивают укрывистость путем рассеивания световой волны любой длины видимого
спектра. Чем меньше будет этот показатель, тем ниже расходная норма диоксида
титана в композиции.
Цвет
– свойство тел
вызывать определенное зрительное ощущение в соответствии со спектральным
составом и интенсивностью отражаемого или испускаемого ими видимого излучения.
Сухой диоксид титана характеризуется высокой яркостью, белизной и его
отражающая способность близка к отражающей способности идеального диффузора.
Светостойкость
– свойство
материала сохранять свой цвет под воздействием световых лучей. В процессе
эксплуатации изделия, особенно наружного применения, изменяют свой
первоначальный цвет под воздействием ультрафиолетовых лучей естественного света
и источников искуственного освещения, излучающих ультрафиолетовые лучи.
Атмосферостойкость – свойство полимерных композиций
сопротивляться разрушающему действию солнечных лучей, дождя, мороза, снега,
ветра и других атмосферных факторов (например, газов и пыли, загрязняющих
нижние слои атмосферы).
Обработка
поверхности
необходима для увеличения устойчивости к внешним воздействиям. Неорганическая
(Al2O3, SiO2) увеличивает стойкость частиц диоксида титана к кислотному
воздействию, которое может приводить к разрушению частиц пигмента. Органическая
обработка улучшает распределение частиц пигмента в объеме композиции.
Области применения
диоксида титана
| Области применения |
Цель применения |
Продукция |
| Лакокрасочные материалы |
для отбеливания и для улучшения
укрывистости, для защиты покрытий от вредных ультрафиолетовых лучей, для
предотвращения старения плёнки и пожелтения покрашенных поверхностей |
декоративные, архитектурные краски;
эмульсионные полуматовые краски; эмульсионные глянцевые краски; грунтовки,
подложки, шпаклевки; краски на основе растворителя – глянцевые; штукатурные
растворы; силикатные краски; покрытия для древесных материалов; цементный
штукатурный раствор; краски промышленного назначения; штукатурка на основе
синтетических смол; полимерные покрытия; краски для ремонтных работ;
мелкозернистые порошковые краски; уф / uv - отверждаемые краски; краски,
отверждаемые кислотным отвердителем; порошковые покрытия; полиуретановые
покрытия; эпоксидные покрытия; краски для дорожной разметки; краски для
судовых покрытий; высоконаполненные краски; электроосаждаемые краски;
печатные краски. |
| Пластики |
для обеспечения высокой белизны и
интенсивности цвета, защита от старения и пожелтения материала, для улучшения
сопротивляемости пластика к вредным воздействиям. |
высокопрочный поливинилхлорид (для
помещений); резина; термопластмасса; термореактивный пластик; пластмассы на
основе ненасыщенных полиэфиров; эластомеры, каучук; покрытия для пола
(линолеум) |
| Бумага и картон |
как прямое средство для отбеливания
и улучшения укрывистости бумажной пульпы, так и при производстве покрывающих
бумагу средств |
бумажные покрытия; обои;
парафиновая бумага; цветная бумага |
| Синтетические волокна / ткани |
для матирования скрученного волокна |
|
| Косметика |
для защиты от ультрафиолетовой
радиации в солнцезащитных кремах, для придания высокого отбеливающего и
укрывистостного заглушающего эффекта зубной пасте, мылу и т.д |
зубная паста, мыло и пр. |
| Пищевая промышленность |
для придания высокого отбеливающего
и укрывистостного эффекта продуктам, для защиты цвета и упаковки (пластик)
продуктов от ультрафиолетового излучения. |
карамель, жевательная резинка,
сахар пудра и рафинад, лягушачьи лапки, курица, свиные и говяжьи языки,
молочные поросята, мука, тесто, сахарная глазурь, джемы, молочные коктейли,
брынза, сыворотка, сгущенное молоко, любая рыбо- и морепродукция и т.д. |
| Фармацевтическая промышленность |
пигментный диоксид титана, высокой
химической чистоты, для придания высокого отбеливающего и укрывистосного
эффекта в фармацевтике. |
|
| Печатная краска |
для повышения стойкости покрытий к
атмосферным воздействиям |
|
| Катализатор |
диоксид титана может быть
использован как катализатор, как фотокатализатор и как инертный базовый
керамический материал для активных компонентов. |
|
| Другие сферы использования |
предохранение древесины (повышение
атмосферостойкости с помощью оптической фильтрации вредной для древесины
солнечной радиации), наполнение резины, стеклянных эмалей, стекла и
стеклянной керамики, электрокерамики, очистка воздуха, сварочные флюксы,
твердые сплавы, химические промежуточные соединения, материалы, содержащие
диоксид титана, подходящих для использования при высоких температурах
(например, противопожарная защита печей с форсированной тягой), аналитическая
и опытная хроматография жидкостей, декоративный бетон (для придания белизны
цементной краске) |
Отдельно следует отметить
Диоксид титана чистотой 99,999% Марки ОСЧ 7-5 (ТУ-б-09-01-640-84), который
применяется в качестве эталона чистоты, в производстве оптически прозрачных
стекол, в волоконной оптике, радиоэлектронике, для пьезокерамики, в медицинской
промышленности и т.д. Это особо чистое химическое вещество, полученное методом
термического гидролиза.
Технология
производства диоксида титана
Пигменты диоксида титана
существует в двух формах – анатазная и рутильная и производятся по двум
технологическим схемам: сульфатный и хлорный способы. Обе, анатазная и
рутильная формы диоксида титана, могут быть произведены любым из способов.
Сульфатный способ был внедрен в промышленность в 1931 г., для производства анатазной формы диоксида титана, а позже, в 1941 г. – рутильной. В этом способе руда, содержащая титан (ильменит и др.), растворяется в серной
кислоте, образуя растворы сульфатов титана, железа и других металлов. Затем, в
ряде химических реакций, включающих в себя химическое восстановление, очистку,
осаждение, промывание и кальцинацию, образовывая базовый диоксид титана с
необходимым размером частиц. Строение кристаллов (анатазная или рутильная
форма) контролируется в процессе ядрообразования и кальцинации.
Хлорный способ был
изобретен компанией DuPont в 1950 г. для производства рутильной формы диоксида
титана. Этот способ включает в себя высокотемпературные фазовые реакции.
Титансодержащая руда вступает в реакцию с хлорным газом при пониженном
давлении, в результате чего образуется тетрахлорид титана TiCl4 и примеси
хлоридов других металлов, которые впоследствии удаляются. TiCl4 высокой степени
чистоты затем окисляют при высокой температуре, в результате чего образуется
диоксид титана.
По сравнению с сульфатным
хлоридный способ является более экологически чистым и совершенным благодаря
возможности осуществлять процесс в непрерывном режиме, что предполагает полную
автоматизации производства. Однако он избирателен к сырью, а в связи с
использованием хлора и высоких температур требует применения
коррозионностойкого оборудования.
Сульфатный
метод
Технология производства
состоит из трёх этапов:
(1) получение растворов
сульфата титана (путём обработки ильменитовых концентратов серной кислотой). В
результате получают смесь сульфата титана и сульфатов железа (II) и (III),
последний восстанавливают металлическим железом до степени окисления железа +2.
После восстановления на барабанных вакуум-фильтрах отделяют растворов сульфатов
от шлама. Сульфат железа(II) отделяют в вакуум-кристаллизаторе.
(2) гидролиз раствора
сульфатных солей титана. Гидролиз проводят методом введения зародышей (их
готовят осаждая Ti(OH)4 из растворов сульфата титана гидроксидом натрия). На
этапе гидролиза образующиеся частицы гидролизата (гидратов диоксида титана)
обладают высокой адсорбционной способностью, особенно по отношению к солям
Fe3+, именно по этой причине на предыдущей стадии трёхвалентное железо
восстанавливается до двухвалентного. Варьируя условия проведения гидролиза
(концентрацию, длительность стадий, количество зародышей, кислотность и т. п.)
можно добиться выхода частиц гидролизата с заданными свойствами, в зависимости
от предполагаемого применения.
(3) термообработка
гидратов диоксида титана. На этом этапе, варьируя температуру сушки и используя
добавки (такие, как оксид цинка, хлорид титана и используя другие методы можно
провести рутилизацию (то есть перестройку оксида титана в рутильную
модификацию). Для термообработки используют вращающиеся барабанные печи длиной
40—60 м. При термообработке испаряется вода (гидроксид титана и гидраты оксида
титана переходят в форму диоксида титана), а также диоксид серы.
Производство диоксида
титана сульфатным методом
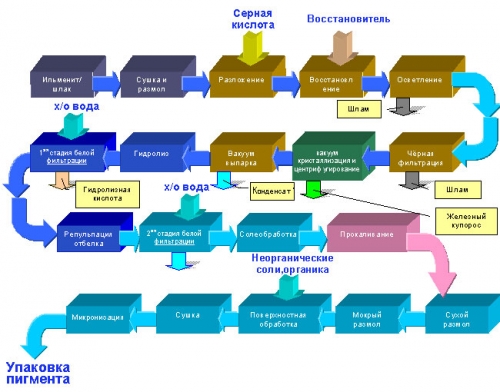 ” ”
Известны три варианта
периодического процесса разложения ильменита серной кислотой — жидкофазный,
среднефазный и твердофазный, различающиеся по концентрации используемой серной
кислоты и характеру образующихся продуктов разложения. Однако в промышленной
практике наибольшее применение получил твердофазный метод, позволяющий наиболее
быстро и полно вскрывать концентраты и получать растворы большей основности,
что облегчает проведение I гидролиза и получение готового продукта повышенного
качества. Для разложения ильменита по данному методы применяют
концентрированную серную кислоту, благодаря чему температуру реакционной смеси
можно быстро довести до 190—220 °С (резко повысить температуру удается
добавлением к концентрированной кислоте воды или гидролизной кислоты), что
обеспечивает быстрое протекание процесса и высокую степень разложения
концентрата — 96-97%. После выщелачивания получаемые растворы сульфата титана
имеют низкий (~1,8) кислотный фактор. Кроме периодического существуют и
непрерывный способы разложения ильменита.
Гидролиз в целях его
ускорения и улучшения качества (дисперсности) получаемых гидратов ведут
кипячением в присутствии затравки (зародышей) из растворов сульфата титана с
концентрацией TiO2 не менее 190—200 г/л при кислотном факторе >2. Не приводя
здесь технологический режим гидролиза и механизм процесса, который сложен,
отметим, что при этой операции, протекающей по суммарному уравнению
TiOSО4 + 2Н2О = Н2ТiO3 +
Н2SО4,
образуется большое
количество (в пересчете на моногидрат ~2 т на 1 т ТiO2) разбавленной 2%—22%-ной
гидролизной серной кислоты, загрязненной сульфатом железа, 1—2% титанилсульфата
и несколькими процентами других сульфатов. Эта кислота является отходом
производства, однако возврат ее затруднен. Возможное направление утилизации
гидролизной кислоты - упаривание до концентрации 55% с последующим ее
использованием для производства суперфосфата.
При гидролизе в осадок
выделяется до 95—96% титана, причем образующаяся метатитановая кислота
сорбирует значительное количество SО3. Метатитановую кислоту затем промывают,
сушат и прокаливают, в результате чего из нее удаляется вначале вода (при
200-300 °С), затем SО3 (при 500-800 °С) и при 850-900 °С получается нейтральный
(рН 7) продукт - диоксид титана.
Побочный продукт
производства (семиводный железный купорос) прокаливают до получения одноводного
(FeSО4 · Н2О) и измельчают.
Примерный расход основных материалов на производство из ильменитовых
концентратов сернокислотным методом 1 т диоксида титана составляет, т:
ильменитового концентрата, содержащего 42% TiO2 -3,1; серной кислоты
(моногидрат) — 4,0—4,5; железной стружки — 0,24.
Как указано выше,
источником для получения TiO2 могут служить также получаемые при
рудовосстановительной плавке ильменитовых концентратов титановые шлаки. На
шлаках (70% TiO2), в частности, работает завод большой производительности в
Канаде (провинция Квебек, близ Сореля).
При получении диоксида
титана из шлаков сернокислотным методом растворы после выщелачивания сульфата
титана, содержащие 190 г/л TiO2 и малое количество железа, гидролизуются легче,
чем при переработке ильменитовых концентратов. Получаемая гидролизная кислота
содержит ~9 г/л железа, что облегчает ее регенерацию.
Сернокислотный метод
производства диоксида титана из ильменита и титановых шлаков имеет ряд
существенных недостатков — сложная многостадийная схема, высокий расход серной
кислоты, значительное количество которой непроизводительно расходуется на
образование больших количеств отходов — сульфата железа (>3 т семиводного
продукта на 1 т TiO2), а также разбавленной 20—22%-ной и загрязненной примесями
гидролизной серной кислоты. По этой причине в настоящее время все большее
значение приобретает другой — хлорный метод.
Хлорный
метод
Хлорный метод получения
диоксида титана заключается в том, что исходным сырьем (полуфабрикатом) служит
тетрахлорид титана. Из него диоксид титана можно получать методом гидролиза или
сжиганием при высокой температуре. Тетрахлорид титана гидролизуется при
нагревании водных растворов, либо в газовой фазе под действием паров воды.
Промышленные методы
производства титановых пигментов методом гидролиза еще не разработаны. Общий
недостаток их — неудовлетворительное решение проблемы использования
образующихся при гидролизе хлорида водорода или соляной кислоты, которые не
удается вернуть для повторного использования в производстве диоксида титана.
Гидролиз тетрахлорида
титана парами воды при 25—75 °С на воздухе приводит к образованию вязкой
жидкости, затвердевающий при Длительной выдержке в белую массу. Парофазный
гидролиз при 1000-1200 °С позволяет получать диоксид титана с пигментными
свойствами, поэтому его можно использовать при условии нахождения эффективного
метода утилизации хлорида водорода.
Сжигание тетрахлорида
титана кислородом протекает по реакции:
TiCl4 + O2= TiO2 + 2С12.
Выделяющийся хлор может
быть возвращен в производство для получения тетрахлорида титана, поэтому метод
сжигания уже применяют в промышленном производстве.
Важнейшей операцией в
производстве пигментного диоксида титана хлорным методом является сжигание
тетрахлорида титана. Оно производится при 900—1000 °С на горелках специальной
конструкции, обеспечивающих поддержание температуры реакции в заданных пределах
и выдерживание продуктов сгорания в течение определенного времени.
Для получения монодисперсного продукта пребывание диоксида титана в зоне
высоких температур не должно превышать 0,01—5 с. В зависимости от условий
сжигания тетрахлорида титана диоксид титана имеет структуру рутила или анатаза.
Смешение исходных реагентов при 400 °С приводит к образованию анатаза с
размером частиц 0,5—1,0 мкм. Предварительное нагревание их до 1000 °С при
сжигании дает продукт, содержащий до 60% рутила. Сжигание тетрахлорида титана с
примесью тетрахлорида кремния (0,5—4,0%) приводит к уменьшению размеров частиц
диоксида титана. Тетрахлорид кремния способствует также снижению так называемой
фотоактивности диоксида титана. Добавка к продуктам сжигания еще и хлорида
алюминия (1—5%) ускоряет переход анатаза в рутил. Доля рутила в готовом
продукте зависит от концентрации зародышевых кристаллов, возникающих на первой
стадии реакции.
Титановые пигменты,
получаемые при сжигании тетрахлорида титана, содержат до 0,6% адсорбированного
хлора. Водная суспензия такого продукта имеет рН>7, и он не пригоден для
приготовления красок. Десорбцию хлора из пигмента можно осуществить
прокаливанием его при 300-900 °С, примесь хлора при этом понижается до 0,1%.
Такой продукт имеет рН водной вытяжки 5-6,8 и пригоден для изготовления красок
и эмалей, но нуждается в поверхностной обработке соединениями кремния и
алюминия.
Получение
диоксида титана из сфенового концентрата
В последнее время
разработан и опробован ряд новых вариантов технологии, предусматривающих
получение пигментных продуктов из сфена. Наиболее компактное решение для
производства диоксида титана приведено на рис. 3.4.
В данном варианте твердую
фазу суспензии отделяют от жидкой до наступления момента осаждения из нее соли
титана. При этом в осадке остаются сульфат кальция, кремнезем (SiO2) и
неразложившиеся минералы, а жидкая фаза представляет собой титансодержащий
раствор, пригодный для прямого выделения титановой соли – TiOSО4 · Н2О.
При термогидролизе раствора СТМ получается пигментный диоксид титана рутильной
модификации высших марок. Переработка титановой соли TiOSО4 · Н2О может
быть организована на месте ее получения. Титановую соль можно транспортировать
с целью переработки и в другие районы. Маточный раствор после выделения соли
полностью возвращается на сульфатизацию, вследствие чего существенно снижается
расход серной кислоты (до 3,5—4,5 т на 1 т диоксида титана).
Принципиальная схема
переработки сфенового концентрата
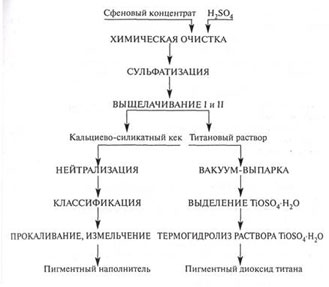
Глава 2.
ИЗВЛЕЧЕНИЕ СЕРНОЙ КИСЛОТЫ ИЗ ОТХОДОВ ПРОЦЕССА ПРОИЗВОДСТВА ДИОКСИДА ТИТАНА
Процесс, разработанный К. X. Дёрром предназначен для выделения серной кислоты из отработанной серной
кислоты, содержащей сульфат железа и из твердого сульфата железа, содержащего
значительные количества кристаллизационной воды. Процесс включает следующие
стадии:
1) концентрирование отработанной серной кислоты до получения
концентрации кислоты 25—55 % в расчете на суспензию;
2) смешение сконцентрированной кислоты со стадии 1 с возвратной
концентрированной серной кислотой, подаваемой со стадии 5, в результате чего
получается смесь с концентрацией кислоты 30—65 % в расчете на суспензию;
3) добавление твердого сульфата железа с высоким содержанием
кристаллизационной воды к смеси, полученной на стадии 2, в результате чего
получается сульфат железа с низким содержанием кристаллизационной воды;
4) отделение раствора серной кислоты от сульфатажелеза,
получаемого на стадии 3; концентрирование раствора серной кислоты, полученного
на стадии 4, до получения концентрации кислоты 45—70 % в расчете на кислоту, не
содержащую соли, и возврат части полученного раствора на стадию 2; 5)
термическое разложение сульфата железа, полученного на стадии 4, с получением
оксида железа и сернистого газа.
Отработанный
раствор кислоты из резервуара 2 по линии 2а подается в концентратор 3, где происходит удаление воды. Концентрированный раствор
серной кислоты выходит из концентратора по линии За и поступает в смеситель 4.
Сульфат
железа («зеленая соль») из резервуара / по линии 1а подается в зону дегидратации 5, в которую также по линии 4а из резервуара 4 поступает
кислотная смесь. Эта смесь состоит из сконцентрированной отработанной кислоты
из аппарата 3 и из сконцентрированного фильтрата из
аппарата 8.
В зоне
дегидратации 5 сульфат железа с высоким содержанием
кристаллизационной воды превращается в сульфат железа с пониженным содержанием
воды, где сульфат двухвалентного железа с пониженным содержанием воды
отделяется от раствора и по линии 66 поступает на
стадию термической диссоциации 7.
Фильтрат,
содержащий серную кислоту, выводится из зоны фильтрации б по линии 6а и подается в концентратор 8, в котором происходит удаление воды. Часть получаемой при этом
концентрированной кислоты по линии 8а подается в
смеситель 4, а другая часть выводится по линии 86 и может быть снова использована на стадии растворения ТЮ2
9.
В результате
растворения норвежского ильменита в серной кислоте на 1 т ТЮ2
получают 4 т зеленой соли и 8 т отработанной серной кислоты. В состав зеленой
соли входит 90 % FeS04-7H20, 5 %
адсорбированной влаги, остаток — гидраты сульфатов металлов. Отработанная
серная кислота имеет следующий примерный состав, %:
MeSO4 15; H2S04
21; Н20 64
Отработанная
серная кислота из резервуара 2 со скоростью
8000 кг/ч подается по трубопроводу 2а в
концентратор 3, где концентрация H2S04
повышается до 30,4 % в расчете на суспензию. Суспензия в количестве 5520 кг/ч
подается по трубопроводу на стадию смешения 4. Туда же в количестве 4480 кг/ч подается из концентратора 8 раствор отработанной кислоты, содержащий 65 % H2S04.
Со стадии
смешения по трубопроводу 4а выводят 10000
кг/ч серной кислоты с концентрацией 45,9%, которую подают на стадию
дегидратации 5; туда же из резервуара / по трубопроводу 1а поступает 4000 кг/ч зеленой соли. Таким образом, на стадию
дегидратации 5 поступает 14000 кг/ч сырья, представляющего собой кислотную
смесь и зеленую соль в соотношении 2,5 : 1. Образующаяся в результате суспензия
имеет концентрацию серной кислоты 32,8 %, в расчете на суспензию, и содержит AfeS04
в количестве 230 г/кг.
Суспензию
подают на стадию фильтрования 6. Твердый
остаток от фильтрования, образующийся в количестве 5200 кг/ч, содержит MeSOi-H20 и 30.% раствора серной кислоты с концентрацией H2S04
44,3 %. Остаток направляют на стадию диссоциации 7. Фильтрат в количестве 8800
кг/ч концентрируют в концентраторе 8 путем
упаривания до получения концентрации H2S04
65 %. Из общего количества фильтрата 6000 кг/ч по трубопроводу 8а на стадию смешения подают 4480 кг/ч. Оставшееся количество
(1520 кг/ч), содержащее ~990 кг/ч серкой кислоты, может быть использовано для
растворения ТЮ2. Такое количество кислоты составляет 50 % от
количества свободной кислоты, содержащейся в отработанной серной кислоте. На
стадии фильтрования температура повышается до 40—50 С.
ЛИТЕРАТУРА 1. Гальперин М.В. Экологические основы природопользования. – М.:Форум – ИНФРА-М, 2002. 2. Лозановская И.Н., Орлов Д.С., Садовникова Л.К. Экология и охрана биосферы при химическом загрязнении. – М.:Высшая школа, 1998. 3. Малышкина В. Занимательная химия. – Санкт-Петербург, 1998. 4. Хомченко И.Г. Общая химия. – М. Новая Волна, 2002. 5. Комплексный доклад "Гидрометеорология и мониторинг окружающей среды – на службе области" – Челябинский областной центр по гидрометеорологии и мониторингу окружающей среды.
|