Реферат: Кислотно-основные индикаторы
Реферат: Кислотно-основные индикаторы
Кислотно-основные индикаторы, ионно-хромофорная теория,
основные характеристики, правила выбора, индикаторные погрешности
кислотно-основного метода и их расчет
Рассчитанные параметры протолитических ТКТ (величина скачка
титрования, pH в ТЭ) позволяют подобрать наиболее подходящие для обнаружения
КТТ (МЭ) кислотно-основные индикаторы.
Кислотно-основные индикаторы в большинстве случаев
представляют собой растворимые сложные органические соединения, способные
изменять собственную окраску в зависимости от pH раствора. По химической
природе они являются слабыми кислотами или основаниями, частично
диссоциирующими в растворе по уравнению
HInd H++Ind - или
IndOH Ind++OH-.
Цветопеременность кислотно-основных индикаторов ионная
теория Оствальда объясняет различием цвета их недиссоциированных молекул и
образуемых ионов, а зависимость окраски от pH среды связывает со смещением
равновесия в реакции диссоциации с изменением кислотности среды, в результате
чего раствор приобретает окраску молекулярной или ионной формы индикатора.
Более современной хромофорной теорией изменение цвета
кислотно-основных индикаторов в зависимости от pH их раствора объясняется
происходящей при этом внутри молекулярной перегруппировкой с образованием
окрашенных форм. Своё название эта теория получила от названия особых атомных
групп (обычно с двойными связями) - хромофоров (от греческого
"цветонесущие"), наличию которых в молекулах приписывается окраска
органических соединений.
К хромофорам относят азогруппу - NN-, нитрогруппу - NO2,
нитрозогруппу - NO, карбонильную =CO, хиноидную = = = и др. Углублению окраски
способствуют другие группы - ауксихромы (от греческого "усиливающие
цвет"). К ним относят группы - NH2, - OH и их производные, содержащие
радикалы - OCH3, - N(CH3) 2, - N(C2H5) 2 и др.
Например, структурные изменения индикатора метилового
оранжевого с изменением pH можно представить схемой
Аналогично для фенолфталеина:
HInd - форма (бесцветная) Ind - форма (малиновая)
Ионная и хромофорная теории дополняют друг друга и вместе
образуют ионно-хромофорную.
Наблюдаемый переход окраски одной окрашенной формы кислотно-основного
индикатора в другую происходит не при строго определенном значении pH, а в
интервале изменения от pH1 до pH2, называемом интервалом перехода окраски
индикатора.
Границы этого интервала pH1 и pH2 можно рассчитать, зная
константу диссоциации индикатора K (HInd):
K(HInd) = 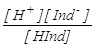 . .
Опытным путем установлено, что изменение окраски индикатора
становится визуально видимым (отличным) при соотношении 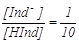 или или 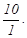 Подставив данное
соотношение в выражение для K(HJnd), получим Подставив данное
соотношение в выражение для K(HJnd), получим
K(HInd) = 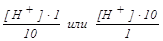 , ,
откуда [H+] = K(HInd) 10 или K(HInd) /10.
pH = pK(HInd) + 1 или pK(HInd) - 1.
Формула pH = pK(Ind) ± 1
используется для расчета границ интервала перехода окраски любого
кислотно-основного индикатора.
Значение pH, при котором индикатор наиболее отчетливо
изменяет свою окраску, называется показателем титрования и обозначается pT. Для
большинства практических случаев
pT=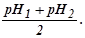
Момент окончания титрования соответствует достижению pH
титруемого раствора, равного pT, отличается от pH в момент эквивалентности: чем
ближе pT индикатора к pH в ТЭ,
тем точнее будет результат анализа. Поэтому правильный выбор индикатора является
одним из наиболее важных моментов в объемно-аналитических определениях.
Правильный выбор индикатора проводят по ТКТ. Он зависит от
типа ТКТ, pH в ТЭ, величины скачка титрования, а также природы и свойств
индикатора (pT, pH1pH2). При выборе следует руководствоваться
следующими правилами:
предпочтение следует отдавать индикатору, у которого pT
наиболее близок к рН в ТЭ;
величина интервала перехода окраски индикатора должна
полностью или частично входить в скачок титрования;
при титровании слабых кислот нельзя применять индикаторы с
интервалами перехода, лежащими в кислой области, а при титровании слабых
оснований - в щелочной;
при титровании сильных кислот и сильных оснований можно
применять практически любые индикаторы, однако при титровании разбавленных
электролитов с c(1/zX) <0,01 моль/дм3 следует придерживаться второго
правила: ток как скачок титрования становится малым.
Практически никогда не удается подобрать индикатор, у
которого рТ совпадал бы с рН в ТЭ, поэтому чаще всего изменение окраски
индикатора происходит до или после МЭ. В первом случае раствор будет
недотитрован, а во втором - перетитрован.
Это приводит к погрешностям, называемым индикаторными
погрешносттями титрования. Они выражают молярную долю неоттитрованной или
перетитрованной кислоты или основания. Классификация, причины и расчетные
формулы индикаторных погрешностей приведены в табл.1.8.1. Рассмотрим выводы
формул индикаторных погрешностей.
Таблица 1.8.1
Типы индикаторных погрешностей
| Тип погрешности |
Причина погрешности |
Расчетная формула погрешности,% |
| Водородная |
Избыток ионов Н+ вследствие недотитрования сильной кислоты или
перетитрования основания (сильного или слабого) сильной кислотой |
∆H+ = 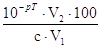
|
| Гидроксильная |
Избыток ионов ОН - вследсвие недотитрования сильного основания
или перетитрования кислоты (слабой или сильной) сильным основанием |
∆ОН-=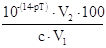
|
| Кислотная |
Избыток молекул слабой кислоты НА при её недотитровании |
∆НА = 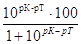
|
| Щелочная |
Избыток молекул слабого основания MOH при его недотитровании |
∆МОН= 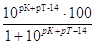
|
где V1 и V2 - объемы анализируемого раствора до и после
титрования; с - молярная концентрация эквивалента вещества анализируемого
раствора; рК - показатель константы диссоциации слабого электролита; рТ - показатель
титрования индикатора; V1/V2=2, если концентрации титранта и анализируемого
раствора равны.
1. Водородная погрешность (∆H+).
Пусть она является результатом недотитрования сильной
кислоты НА сильным основанием МОН в присутствии некоторого индикатора с
показателем титрования рТ.
По определению 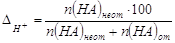 ,%, ,%,
где n(HA) неот и n(HA) от - количества вещества не
оттитрованной и оттитрованной кислоты в КТТ. Так как n(HA) от >> n(HA) неот,
то величиной n(HA) неот в знаменателе можно пренебречь, тогда
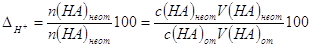 . .
В КТТ рН = рТ, т.е. [H+] = 10-pT, следовательно, в этот
момент c(HA) неот = [H+] КТТ = 10-pT; обозначим c(HA) от ≈ c(HA) исх =
с(HA), V(HA) неот = V(HA) исх+V(MOH) ККТ = V2, а V(HA) от≈V(HA) исх=V1.
Подставим полученное в формулу для ∆H+:
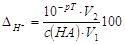 ,%. ,%.
Если c(HA) = c(MOH), то V2 = 2V1 и
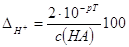 ,%. ,%.
2. Гидроксильная погрешность (∆ОН_).
Пусть она является результатом недотитрования сильного
основания MOH сильной кислотой НА в присутствии индикатора с показателем
титрования рТ.
По определению 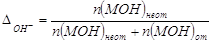 ,% ,%
В КТТ n(MOH) от >> n(MOH) неот, следовательно, n(MOH) неот
в знаменателе можно пренебречь тогда
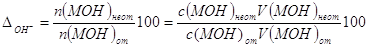 ,%. ,%.
В КТТ с(MOH) неот= [OH-] КТТ, а
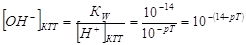
Так как с(MOH) от ≈ с(MOH) исх = с(MOH);
V(MOH) неот = V(MOH) исх + V(HА) КТТ = V2;
V(MOH) от = V(MOH) исх = V1, оттуда после подстановки
получим:
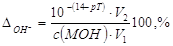 . .
Если с(MOH) = с(НА), то V2 = 2V1, следовательно,
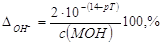 . .
3. Кислотная погрешность (∆НА).
Пусть она является результатом недотитрования слабой кислоты
НА сильным основанием МОН с индикатором с показателем титрования рТ, тогда 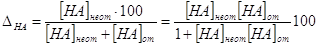 ,%. ,%.
В КТТ [HA] от = [MA] = [A-], следовательно,
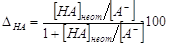 ,%. ,%.
Из выражения для К(НА) получим 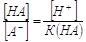 , но поскольку в КТТ [H+] = 10-pT,
а К(НА) = 10-pK, то , но поскольку в КТТ [H+] = 10-pT,
а К(НА) = 10-pK, то
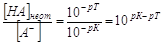 , ,
откуда после подстановки
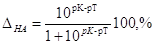 . .
4. Щелочная погрешность (∆МОН).
Пусть она является результатом недотитрования слабого
основания МОН сильной кислотой НА с индикатором с показателем рТ, тогда
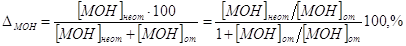 . .
В КТТ [МОH] от = [MA] = [М+], следовательно,
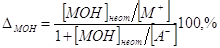 . .
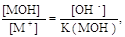
Из выражения для К(МОН) получим
но поскольку в КТТ
[H+] = 10-pT,
а 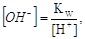 KW =10-14, K(MOH)
= 10-pK, KW =10-14, K(MOH)
= 10-pK,
то 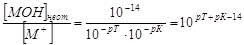 , ,
откуда после подстановки 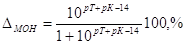 . .
Прямым титрованием в протолиметрии определяют концентрацию
кислоты или основания, или содержание элементов, образующих растворимые кислоты
и основания (например фосфора в виде фосфорной кислоты и т.п.). Обратным или
косвенным титрованием находят содержание некоторых солей. Например, для
определения содержания NH4+ в NH4Cl обратным титрованием можно добавить к
анализируемому раствору точно отмеренный избыток стандартного раствора NaOH,
нагреть смесь до полного удаления NH3, а затем остаток раствора NaOH
оттитровать кислотой в присутствии метилового оранжевого. Косвенный вариант титрования
NH4+ можно осуществить формальдегидным методом, заместив ионы NH4+
эквивалентным количеством Н+ - ионов реакцией раствора NH4Cl с избытком
формальдегида по реакции
NH4Cl + 6CH2O (CH2) 6N4 + HCl + 6H2O
Содержание NH4+ находят по результатам алкалиметрического
титрования заместителя, т.е. HCl.
Протолиметрическое титрование в основном проводят в водной
среде, но существует и неводный вариант. В последнем случае, подобрав
соответствующий растворитель, можно направленно изменять силу растворенных в нем
кислот и оснований, превращать соли в кислоты и основания и т.д. Например, HCN
в водном растворе - слабая кислота, а в среде сжиженного аммиака - сильная,
мочевина в растворе безводной СН3СООН - сильное основание, а в сжиженном
аммиаке - кислота и т.п. Поэтому применение неводного титрования делает
возможным титрование очень слабых кислот и оснований, различных смесей солей с
близкими свойствами, смесей солей с кислотами и основаниями, определение
нерастворимых в воде и разлагаемых ею соединений.
В зависимости от относительной силы кислот и оснований
различают четыре основных случая протолиметрического титрования, каждый из
которых моделируется соответствующей ТКТ: I - сильную кислоту титруют сильным
основанием; II - сильное основание титруют сильной кислотой; III - слабую
кислоту титруют сильным основанием; IV - слабое основание титруют сильной
кислотой.
Кислоты и основания с Кдис >10-2 считаются сильными, и
для них ТКТ рассчитывают по типу - , кроме точки
эквивалентности, в которой рН находят как для слабых кислот или оснований.
Титрование слабых кислот так же, как и титрование слабых
оснований, возможно только при условии, если их Кдис 10-7…10-8. При
Кдис 10-9 скачок титрования на ТКТ отсутствует и зафиксировать ТЭ в
реальном титровании невозможно.
Выбор индикатора и расчет индикаторной погрешности
рассмотрим на примере решения следующей задачи.
Задача: определите тип и величину индикаторной погрешности
при титровании муравьиной кислоты с с(НСООН) = 0,1 моль/дм3 раствором NaOH c
c(NaOH) = 0,1 моль/дм3 в присутствии метилового оранжевого и фенолфталеина. Сделайте
заключение о возможности применения данных индикаторов, если рНТЭ = 8,22, рТМ0
= 4, рТффт = 9, рК(НСООН) = 3,75.
Решение:
а) титрование с метиловым оранжевым.
Титруем кислоту, следовательно, в процессе титрования рН
раствора растет. Тип индикаторной погрешности определим с помощью графической
схемы титрования.
КТТ
4,0 8,22 рН
рТМО рНТЭ
Из схемы следует, что титрование с данным индикатором
закончим до ТЭ, недотитровав слабую кислоту. Это приведет к кислотной
погрешности титрования
∆НА = 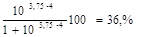
Вывод: погрешность с данным индикатором недопустимо велика,
индикатор метиловый оранжевый не пригоден для титрования.
б) титрование с фенолфталеином
КТТ
8,22 9,0 рН
рНТЭрТффт
Из схемы следует, что в КТТ раствор кислоты будет
перетитрован сильным основанием, т.е. будет содержать избыток ОН - ионов. Это
приведет к гидроксильной погрешности.
∆ОН - = 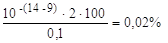
Вывод: индикаторная погрешность при титровании с
фенолфталеином меньше допустимой (0,1%), следовательно, данный индикатор можно
использовать.
|