Реферат: Окисно-відновні реакції і електрохімічні процеси в гальванічних елементах. Електродні потенціали
Реферат: Окисно-відновні реакції і електрохімічні процеси в гальванічних елементах. Електродні потенціали
Міністерство
ХХХХХХХХХХХХХХХХХ
ХХХХХХХХХХХХХХХХХХХХХХХХХХХХХХХХХХХХХХХХХ
Кафедра ХХХХХХХХХХХ
Реферат на тему:
«Окисно-відновні реакції і
електрохімічні процеси в гальванічних елементах. Електродні потенціали»
Виконавець:
Керівник:
Луганськ,
2004
ПЛАН
Вступ. 3
1. Окислювально-відновні
реакції 4
1.1. Напівреакції 4
2. Гальванічні
елементи. 4
3. Електрорушійна
сила (е.р.с.) гальванічного елементу. 6
3.1. Стандартні електродні потенціали. 7
3.2. Окислювачі і відновлювачи. 8
4. Мимовільність
і ступінь протікання окислювально-відновних реакцій. 9
4.1. Е.р.с. і зміна вільної енергії 9
4.2. Е.р.с. і константа рівноваги. 9
4.3. Е.р.с. і концентрація. 10
5. Гальванічні елементи, котрі застосовуються на практиці 11
5.1. Свинцева акумуляторна батарея. 11
5.2. Сухий елемент. 13
5.3. Ni-Cd батареї 13
5.4. Паливні елементи. 14
Висновки. 16
Список використаних джерел. 17
Вступ
Для проведення
багатьох важливих хімічних процесів необхідна електрична енергія, інші ж
процеси, навпаки, можуть дати її. Оскільки електрика відіграє важливу роль у
сучасній цивілізації, цікаво ознайомитися з тією областю хімії, що називається
електрохімією і розглядає взаємозв'язок, що існує між електрикою і хімічними
реакціями [1].
Електрохімія – це
розділ фізичної хімії, що вивчає властивості систем, що містять рухливі іони
(розчинів, розплавів чи твердих електролітів), а також явища, що виникають на
межі двох фаз (наприклад, металу і розчину електроліту) унаслідок переносу
заряджених часток (електронів та іонів). Електрохімія розробляє наукові основи
електролізу, електросинтезу, гальванотехніки, захисту металів від корозії,
створення хімічних джерел струму й ін. Електрохімічні процеси також відіграють
важливу роль у життєдіяльності організмів – передача нервових імпульсів – це
теж електрохімічний процес [11].
Знайомство з
електрохімією дозволяє одержати уявлення про такі різноманітні питання, як
будова і дія електричних батарей, мимовільність протікання хімічних реакцій,
електроосадження металів для одержання металевих покрить і корозія металів.
Оскільки електричний
струм зв'язаний з переміщенням електричних зарядів, зокрема електронів, в
електрохімії увага зосереджена на реакціях, у яких електрони переносяться від
однієї речовини до іншої. Такі реакції називаються окислювально-відновними [9].
1.
Окислювально-відновні реакції
Як відомо,
окислювання являє собою не щось інше, як підвищення ступеня окислювання
(відщіплення електронів), а відновлення як зменшення ступеня окислювання
(приєднання електронів). Якщо одна речовина приєднує електрони і тим самим
відновлюється, то інша речовина повинна віддавати електрони і, отже,
окислятися. Окислювання і відновлення повинні йти одночасно, одне з них не може
відбуватися без іншого. Розглянемо, наприклад, реакцію між залізом і хлоридною
кислотою:
0
+1–1 +2–1 0
Fe (тв.) + 2НCl
(м.)  FеСl2 (тв.) + Н2 (м.)
(1.1) FеСl2 (тв.) + Н2 (м.)
(1.1)
Ступінь окислювання
кожного елемента зазначена над його символом. Розглядаючи ступеня окислювання,
зазначені в рівнянні, ми переконуємося, що залізо окисляється, у той час як HCl
відновлюється.
Під час обговорення
окислювально-відновних реакцій прийнято вважати речовину, що викликає
окислювання, окислювачем. Окислювач має підвищену спорідненість до електронів і
викликає окислювання інших речовин, відщіпляючи від них електрони. Оскільки
окислювач приєднує електрони, він відновлюється. Аналогічна речовина, що
викликає відновлення, називається відновлювачем. У реакції (1.1) HCl – це
окислювач, a Fe – відновлювач. Речовина, відновлена в реакції, завжди є
окислювачем, а речовина, яка окисляється – відновлювачем [1, 2].
Хоча окислювання і
відновлення повинні відбуватися одночасно, часто зручно розглядати їх як окремі
процеси. Наприклад, реакцію окислювання іона Sn2+ іоном Fe3+
Sn2+ (водн.)
+ 2Fе3+ (водн.)  Sn4+ (водн.) + 2Fе2+ (водн.)
(1.2) Sn4+ (водн.) + 2Fе2+ (водн.)
(1.2)
можна уявити собі як сукупність двох процесів:
1) окислювання Sn2+, описуваного рівнянням (1.3), і 2) відновлення
Fe3+, описуваного рівнянням (1.4):
Окислювання: Sn2+(водн.)
 Sn4+ (водн.) + 2е–
(1.3) Sn4+ (водн.) + 2е–
(1.3)
Відновлення: 2Fе3+
(водн.) + 2е–  2Fе2+ (водн.) (1.4) 2Fе2+ (водн.) (1.4)
Такі рівняння, що
описують тільки окислювання чи тільки відновлення, називаються напівреакціями.
Як видно з рівнянь (1.3) і (1.4), число електронів, що втрачається в процесі
окислювання, тобто в окисній напівреакції, повинно дорівнювати числу
електронів, що здобуваються у відбудовній напівреакції. Якщо ця умова виконана
і напівреакції записані стехіометричними повними рівняннями, при їхньому
підсумовуванні виходить стехіометричне збалансоване повне рівняння
окислювально-відновної реакції [1, 5].
2.
Гальванічні елементи
Частіше енергію, що
виділяється в будь-якій мимовільній окислювально-відновній реакції, можна
безпосередньо використовувати для виконання електричної роботи. Це здійснено в
гальванічному елементі, що представляє собою пристрій, у якому перенос
електронів відбувається по зовнішньому шляху, а не безпосередньо між
реагентами.
Одна з таких
мимовільних реакцій відбувається, якщо шматочок цинку помістити в розчин, що
містить іони Cu2+. При протіканні цієї реакції блакитне фарбування
розчину, характерна для іонів Cu2+ (водн.), зникає, і на поверхні
цинку починає осаджуватися металева мідь. Одночасно відбувається розчинення
цинку. Ці перетворення, показані на мал. 2.1, описуються рівнянням: Zn (тв.) +
Cu2+ (водн.)  Zn2+ (водн.) + Cu (тв.) (2.1) Zn2+ (водн.) + Cu (тв.) (2.1)
На мал. 2.2
показаний гальванічний елемент, у якому використовується окислювально-відновна
реакція між Zn і Cu2+, описувана рівнянням (2.1). Хоча
експериментальний пристрій, показаний на мал. 2.2, складніше, ніж зображений на
мал. 2.1, важливо переконатися, що в обох випадках мова йде про одну і ту ж
саму хімічну реакцію. Головне розходження між цими двома експериментами полягає
в тому, що на мал. 2.2 металевий цинк і Cu2+ (водн.) не знаходяться
у безпосередньому контакті один з одним. Отже, Cu2+ може
відновлюватися тільки в результаті перетіканню електронів по дроту, що з'єднує
Zn і Cu (тобто по зовнішньому ланцюгу).
Два металевих
елементи, що з'єднані зовнішнім ланцюгом, називаються електродами. По
визначенню електрод, на якому відбувається окислювання, називається анодом, а
електрод, на якому відбувається відновлення, називається катодом. У
розглянутому прикладі Zn є анодом, а Cu – катодом:
Окислювання на аноді Zn (тв.)  Zn2+ (вoдн.) + 2е– Zn2+ (вoдн.) + 2е–
Відновлення на катоді Cu2+ (водн.) + 2е–  Cu (тв.) Cu (тв.)
Гальванічний елемент
можна розглядати як пристрій, котрий складається з двох напівелементів, один із
яких відповідає процесу окислювання, а інший – процесу відновлення.
При окислюванні металевого цинку на аноді виникають вільні електрони. Вони
перетікають по зовнішньому ланцюгу до катода, де відбувається їхнє поглинання в
процесі відновлення Cu2+ (водн.). Угода про вибір знаків для
електродів гальванічного елемента заснована на розгляді зовнішнього ланцюга.
Електрони мимовільно переміщаються від негативного електрода до позитивного,
отже, анод є негативним електродом, а катод – позитивним.
Під час роботи
гальванічного елемента, зображеного на мал. 2.2, окислювання Zn приводить до
появи додаткових іонів Zn2+ в анодному відділенні елемента. Якщо не
існує способу нейтралізації їхнього позитивного заряду,
подальше окислювання припиняється. Подібно
цьому відновленню Cu2+ викликає появу надлишкового негативного
заряду в розчині в катодному відділенні. Принцип електронейтральності
дотримується завдяки міграції іонів через «сольовий місток», що показаний на
мал. 2.2. Сольовий місток являє собою U-образну трубку, що містить розчин
якого-небудь електроліту, наприклад NaNO3 (водн.), іони якого не
реагують з іншими іонами в гальванічному елементі, а також з матеріалами, з
яких зроблені електроди. Кінці U-образної трубки закривають скловатою чи гелем,
просоченим електролітом, щоб при перевертанні трубки електроліт не вилився з
неї. При протіканні на електродах процесів окислювання і відновлення іони із
сольового містка проникають в анодне і катодне відділення гальванічного
елементу, щоб нейтралізувати заряди, що там утворяться. Аніони мігрують у
напрямку до анода, а катіони – у напрямку до катода. Частіше в зовнішньому
ланцюзі не протікає ніякого струму доти, поки іони не одержать можливість
мігрувати через розчин з одного електродного відділення в інше і тим самим
замикати електричний ланцюг [1, 9].
3.
Електрорушійна сила (е.р.с.) гальванічного елементу
Можна уявити собі,
що в гальванічного елемента існує «рушійна сила» (чи «електричний тиск»), що
переміщає електрони по зовнішньому ланцюгу елементу. Ця рушійна сила
називається електрорушійною силою (скорочено е.р.с.) елементу; е.р.с.
виміряється в одиницях електричної напруги (вольтах) і інакше називається
напругою, чи потенціалом, гальванічного елемента. Один вольт являє собою
е.р.с., необхідну для того, щоб заряд у 1 кулон придбав енергію в 1 Дж:
1 В = 1 Дж/Кл
Точний вимір е.р.с.
гальванічного елемента вимагає застосування спеціальних приладів. Ці виміри
варто виконувати таким чином, щоб через гальванічний елемент протікав мізерно
малий струм. Якщо допустити протікання значного струму, то напруга
гальванічного елемента знижується, тому що він має внутрішній опір, і, крім
того, навколо електродів відбуваються зміни концентрацій іонів у розчинах.
Гальванічний
елемент, зображений на мал. 2.2, при роботі в стандартних умовах створює е.р.с.
величиною 1,10 В. Нагадаємо, що стандартним умовам відповідають 1 М концентрації
реагентів і продуктів у розчинах і тиску в 1 атм. для газоподібних учасників
реакцій. У розглянутому прикладі гальванічний елемент повинний працювати при
[Cu2+] = [Zn2+] = 1 М. Е.р.с., створювана гальванічним
елементом, позначається буквою E. Якщо гальванічний елемент працює при
стандартних умовах, то він створює стандартну е.р.с., що позначається символом Е°:
Zn (тв.) + Cu2+
(водн.)  Zn2+ (водн.) + Cu (тв.) E° = 1,10 В (3.1) Zn2+ (водн.) + Cu (тв.) E° = 1,10 В (3.1)
Е.р.с. будь-якого
гальванічного елементу залежить від того, яка реакція в ньому здійснюється, а
також від концентрацій реагентів, продуктів і від температури гальванічного
елемента, що звичайно вважають рівною 25°С, якщо не зроблено особливого застереження
[1].
Точно так само як
повну реакцію, яка протікає в гальванічному елементі, можна представити у виді
суми двох напівреакцій, так і э.р.с. гальванічного елемента можна представити у
виді суми двох електродних потенціалів: один з них обумовлений відщіпленням
електронів на аноді (окисний потенціал Еокисн), а іншої –
приєднанням електронів на катоді (потенціал відновлення Евідн.):
Еелемента = Еокисн + Евідн
(3.2)
|
|
| Рис. 3.1. Гальванічний елемент із водневим
електродом |
Провести
безпосередній вимір окисного і відновлювального потенціалів по окремості
неможливо. Однак якщо, однієї напівреакції умовно приписати стандартний
електродний потенціал, то стандартні потенціали інших напівреакцій можна
визначати щодо цього умовного еталона. Як такий умовний еталон обрана
напівреакція, що відповідає відновленню Н+ з утворенням Н2.
Їй умовно приписується стандартний відбудовний потенціал, який у точності
дорівнює 0 В:
2Н+ (1М)
+ 2е–  Н2(1 атм) Е°відн = 0
В (3.3) Н2(1 атм) Е°відн = 0
В (3.3)
На мал. 3.1
схематично зображений гальванічний елемент, у якому використовується
окислювально-відновна реакція між Zn і Н+:
Zn (тв.) + 2Н+(водн.)
 Zn2+ (водн.) + Н2 (г.)
(3.4) Zn2+ (водн.) + Н2 (г.)
(3.4)
Окислювання цинку
відбувається в анодному, а відновлення Н+ – у катодному відділенні.
У цьому гальванічному елементі працюючий при стандартних умовах ([Н+]
= 1М и Рн2 = 1 атм) стандартний водневий електрод складається з
платинового дротика і шматочка платинової фольги, покритої тонко здрібненою
платиною, що служить інертною поверхнею для катодної реакції. Електрод
знаходиться у скляній трубці, у якій збирається газоподібний водень, що
виділяється над поверхнею платини. Описаний гальванічний елемент створює
стандартну э.р.с. Е° = 0,76 В. Використовуючи визначення стандартного
відбудовного потенціалу Н+ (E°відн = 0), можна обчислити
стандартний окисний потенціал Zn
Е°елемента
= Е°окисл + Е°відн
0,76 В = Е°окисл
+ 0
Таким чином, цинку
приписується стандартний окисний потенціал 0,76 В
Zn (тв.)  Zn2+ (водн.) + 2е– E°окисл
= 0,76 В (3.5) Zn2+ (водн.) + 2е– E°окисл
= 0,76 В (3.5)
Стандартні
потенціали інших електродних напівреакцій установлюються шляхом вимірів э.р.с.
гальванічних елементів подібним чином.
Електродний
потенціал будь-якої окисної напівреакції дорівнює по величині, але протилежний
за знаком потенціалу зворотної відбудовної напівреакції
Наприклад:
Zn2+
(водн.) + 2е–  Zn (тв.) Е°відн = – 0,76
В (3.6) Zn (тв.) Е°відн = – 0,76
В (3.6)
Відповідно до прийнятої
угоди, потенціали напівреакцій табулірують як стандартні відбудовні потенціали,
що часто називають просто електродні потенціали. Комбінуючи між собою
відповідні окисні і відбудовні реакції, можна по їхніх електродних потенціалах
обчислювати стандартні э.р.с. найрізноманітніших гальванічних елементів [8, 1].
Потенціали
напівреакцій показують, наскільки легко окислюються чи відновлюються відповідні
частки. Чим більш позитивна Е° для напівреакції, тим більше тенденція до
протікання цієї напівреакції в тому напрямку, у якому вона записана. Негативне
значення відновлювального потенціалу вказує, що відновлення відповідної частки
відбувається на трудніше, ніж відновлення іона Н+ (водн.), а
негативне значення окисного потенціалу вказує, що дана частка окисляється
трудніше, ніж Н2. Розглядаючи напівреакції можна переконатися, що
легше за все відновлюється F2, і, отже, він являє собою найбільш
сильний окислювач із усіх речовин
F2 (г.) +
2е–  2F– (водн.) Е°відн = 2,87
В (3.7) 2F– (водн.) Е°відн = 2,87
В (3.7)
Іон літію Li+
відновлюється трудніше за всі інші і, отже, є найбільш слабким окислювачем:
Li+
(водн.) + е–  Li (тв.) E°відн = – 3,05
В (3.8) Li (тв.) E°відн = – 3,05
В (3.8)
До найбільш
розповсюджених окислювачів відносяться галогени, кисень і такі оксіаніони, як,
наприклад, Mn4–, Cr2O72–
і NO3–, у яких центральний атом має високий позитивний
ступінь окислювання. Як окислювачі іноді також використовуються іони металів з
високими позитивними ступенями окислювання, наприклад Ce4+, який
легко відновлюється до Ce3+.
Серед розглянутих
речовин літій окисляється легше всього і, отже, є найбільш сильним
відновлювачем:
Li (тв.)  Li+ (водн.) + е–
E°окисл = 3,05 В
(3.9) Li+ (водн.) + е–
E°окисл = 3,05 В
(3.9)
Трудніше всіх інших
окисляється фторид-іон F–, який, отже, є найбільш слабким
відновлювачем:
2F–
(водн.)  F2 (м.) +2e– Е°окисл
= – 2,87 В (3.10) F2 (м.) +2e– Е°окисл
= – 2,87 В (3.10)
У якості
відновлювачей часто використовуються водень Н2 і багато металів з
позитивними ступенями окислювання, а також іони деяких металів у нижчих
ступенях окислювання, наприклад Sn2+, який окисляється в Sn4+.
Розчини відновлювачей важко зберігати тривалий час, оскільки вони взаємодіють
із присутнім усюди O2, який є гарним окислювачем. Наприклад, розчини проявників для
фотографії є слабкими відновлювачами і не підлягають тривалому збереженню, тому
що легко окисляються киснем повітря [1].
4.
Мимовільність і ступінь протікання
окислювально-відновних реакцій
Як було зазначено
вище, у гальванічних елементах протікають мимовільні окислювально-відновні
реакції. Іншими словами, будь-яка реакція, за допомогою якої в гальванічному
елементі одержують позитивну е.р.с., повинна бути мимовільною. Отже,
використовуючи потенціали напівреакцій для обчислення е.р.с. зв'язаної з ними
повної окислювально-відновної реакції, можна визначити, чи належна ця реакція
протікати мимовільно. При цьому варто користуватися таким правилом: позитивна
е.р.с. указує на мимовільний процес, у той час як негативна е.р.с. указує на
немимовільний процес.
Відомо, що зміна
вільної енергії ΔG, яким супроводжується хімічний процес, є мірою
мимовільності його протікання. Оскільки е.р.с. електрохімічного елемента, де
протікає окислювально-відновна реакція, указує, наскільки вона мимовільна,
неважко зрозуміти, що між е.р.с. електрохімічного елемента і зміною вільної
енергії реакції, що протікає в ньому, повинно існувати визначене
співвідношення.
Таке співвідношення
дійсно існує:
ΔG = – nFE
(4.1)
У цьому рівнянні Е –
е.р.с. електрохімічного елемента, n – число молів електронів, стерпних в
окислювально-відновній реакції, a F-постійна, що носить назву число Фарадея (по
імені Майкла Фарадея). Число Фарадея являє собою електричний заряд 1 моля
електронів, і ця кількість заряду зветься фарадей (Ф):
1Ф = 96 500 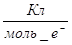 = 96 500 = 96 500 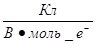 (4.2) (4.2)
У тому випадку, якщо
реагенти і продукти знаходяться в стандартних станах, рівняння (4.1) здобуває
вид
∆G° = –nFE°
(4.3)
Доведено, що
стандартна зміна вільної енергії ∆G° зв'язана з константою рівноваги. До
рівнянням (4.4):
∆G° = – 2,30•
R• T•
lgК
(4.4)
З цього рівняння
випливає, що стандартна е.р.с. окислювально-відновної реакції Е° повинна бути
зв'язана з константою рівноваги співвідношенням
–nFE° = – 2,30 R• T•
lg К
відкіля 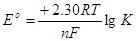 (4.5) (4.5)
Якщо застосувати це
рівняння при Т = 298 К и підставити в нього чисельні значення величин R і F,
воно спроститься:
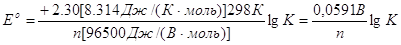 (4.6) (4.6)
Отримані рівняння
показують, що стандартна е.р.с. електрохімічного елемента тим більше, чим
більше константа рівноваги реакції, що протікає в електрохімічному елементі.
На практиці
гальванічні елементи рідко діють при стандартних умовах. Однак е.р.с. елемента,
що працює при нестандартних умовах, можна обчислити по Е°, температурі і
концентраціям реагентів і продуктів у гальванічному елементі. Рівняння, що
дозволяє проводити такі розрахунки, виводиться зі співвідношення між ∆G і
∆G°:
∆G = ∆G°
+ 2,30 R T lgQ (4.7)
Оскільки, відповідно
до рівняння (4.1), ∆G = – nFE, можна записати, що
– nFE = – nFE° + 2,30 R T lgQ
Вирішуючи попереднє
рівняння відносно Е, знаходимо
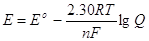 (4.8)) (4.8))
Це співвідношення
відоме за назвою рівняння Нернста, по імені Германа Вальтера Нернста
(1864-1941), німецького хіміка, що зіграв важливу роль у створенні теоретичних
основ електрохімії. При 298 К величина 2,30 RT/F має значення 0,0591 В, що
дозволяє записати рівняння Нернста в більш простому виді:
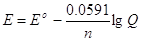 (4.9)
(4.9)
Щоб проілюструвати
застосування рівняння (4.9), розглянемо реакцію Zn(тв.) + Cu2+
(водн.)  Zn2+ (водн.) + Cu (тв.) Е° =
1,10 В Zn2+ (водн.) + Cu (тв.) Е° =
1,10 В
У даному випадку n =
2, і рівняння Нернста дає
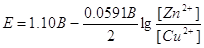 (4.10) (4.10)
Нагадаємо, що у
вираження для Q входять тільки концентрації іонів у розчині, але воно не
включає концентрації твердофазних учасників реакції. Експериментально
встановлено, що е.р.с. електрохімічного елемента не залежить від розміру і
форми твердих електродів. З рівняння (4.10) випливає, що е.р.с. гальванічного
елемента, у якому протікає окислювально-відновна реакція між міддю і цинком,
зростає при підвищенні [Cu2+] і зменшенні [Zn2+].
Наприклад, при [Cu2+] = 5,0 і [Zn2+] = 0,050 М маємо
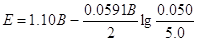
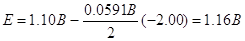
У загальному
випадку, якщо концентрації реагентів підвищуються щодо концентрацій продуктів,
це приводить до підвищення ступеня мимовільності реакції, що протікає в
гальванічному елементі, і зростанню його е.р.с. І навпаки, якщо концентрації
продуктів підвищуються в порівнянні з концентрацією реагентів, е.р.с.
зменшується. Під час дії електрохімічного елемента відбувається витрата
реагентів і утворення продуктів. Зв'язане з цим зменшення концентрацій
реагентів і зростання концентрацій продуктів викликає поступове зменшення
е.р.с. елемента [1, 7, 8, 11].
5.
Гальванічні елементи, котрі застосовуються на
практиці
Гальванічні елементи
набули широкого застосування як зручні джерела енергії, одним з найважливіших
достоїнств яких є портативність. Хоча для створення гальванічного елемента в
принципі підходить будь-яка мимовільна окислювально-відновна реакція, розробка
практично застосовного гальванічного елемента на основі якої-небудь конкретної
окислювально-відновної реакції вимагає великої винахідливості. Гальванічні
елементи, що обговорювалися вище, із сольовим містком дозволяють зрозуміти
принцип дії електрохімічного елемента. Однак вони незручні для практичного
використання, оскільки володіють великим внутрішнім опором. Тому, якщо ми
спробуємо одержати за допомогою такого гальванічного елемента великий струм,
його напруга різко знизиться. Крім цього, описаним дотепер гальванічним
елементам бракує компактності і механічній міцності, що є неодмінними умовами
портативності.
Існуючі в данний час
гальванічні елементи не витримують конкуренції з іншими розповсюдженими
джерелами енергії по вартості її одержання. Вартість електричної енергії,
одержуваної від звичайних батарей для кишенькових ліхтариків, приблизно в 800
разів вище вартості електроенергії, що поставляється в споживчу мережу
електростанціями [1].
У даному розділі
буде розглянутий пристрій деяких розповсюджених електричних батарей. Електрична
батарея являє собою один чи кілька гальванічних елементів. При послідовному
з'єднанні декількох гальванічних елементів (коли позитивний полюс одного
елемента приєднується до негативного полюса наступного елемента) е.р.с. батареї
дорівнює сумі е.р.с. окремих елементів [3].
Однією з найбільш
розповсюджених батарей – свинцева акумуляторна батарея, що використовується в
автомобілях. Свинцева акумуляторна батарея напругою 12 В складається із шести
елементів, кожний з який дає напругу 2 В. Анод кожного елемента виконаний зі
свинцю, а катод – з диоксида свинцю PbО2, що заповнює металеві
ґрати. Обидва електроди занурені в сірчану кислоту. У процесі розрядки батареї
в ній протікають електродні реакції:
на аноді Pb (тв.) + HSO4– (водн.)  PbSO4
(тв.) + H+ (водн.) + 2e– PbSO4
(тв.) + H+ (водн.) + 2e–
на катоді Pb2 (тв.) + HSO4– (водн.)
+3H+ + 2e– PbSO4 (тв.) + H2O
(рід.) PbSO4 (тв.) + H2O
(рід.)
Pb (тв.) + Pb2 (тв.) + 2H+ (водн.) + 2HSO4–
(водн.)  2PbSO4
(тв.) + H2O (рід.) (5.1) 2PbSO4
(тв.) + H2O (рід.) (5.1)
|
|
| Рис. 5.1. Свинцева акумуляторна батарея. |
Реагенти Pb і PbО2,
між якими відбувається перенос електронів, служать електродами. Оскільки вони
являють собою тверді речовини, відпадає необхідність у поділі електрохімічного
елемента на анодне і катодне відділення. Між Pb і PbО2 немає прямого
фізичного контакту, якщо, звичайно, одна електродна пластина випадково не
стикнеться з іншою. Щоб запобігти зіткненню електродів, між ними розташовують
перегородки з дерева чи скловолокна. Для підвищення сили струму, що знімається,
у кожнім елементі поміщено кілька анодних і катодних пластин, як це показано на
мал. 5.1.
З рівняння (5.1)
видно, що в процесі розрядки свинцевої акумуляторної батареї витрачається
сірчана кислота H2SO4. Концентрована сірчана кислота має
високу щільність, але в процесі розрядки батареї щільність електроліту в ній
зменшується. Електроліт у тільки що зарядженної батареї має щільність 1,25-1,30
г/см3.
Якщо його щільність
стає нижче 1,20 г/см3, батарея має потребу в перезарядженні.
Щільність електроліту вимірюють за допомогою ареометра. Цей прилад, зображений
на мал. 5.2, постачений поплавцем, що занурюється в рідину на глибину, що
залежить від її щільності. Існує різновид свинцевих акумуляторів, у яких роль
електроліту грає гель, просочений H2SO4; такі батареї
використовуються в запаяному виді.
Свинцева
акумуляторна батарея зручна тим, що її можна перезаряджати. Для перезарядження
використовується зовнішнє джерело енергії, що дозволяє звертати напрямок
мимовільної окислювально-відновної реакції (5.1). Таким чином, під час
перезарядження в батареї протікає реакція:
2PbSO4 (тв.) + 2H2O (рід.)  Pb (тв.) + Pb2
(тв.) + 2H+ (водн.) + 2HSO4– (водн.) (5.2) Pb (тв.) + Pb2
(тв.) + 2H+ (водн.) + 2HSO4– (водн.) (5.2)
В автомобілі
необхідну для перезарядження батареї енергію одержують від генератора, що
приводиться в дію двигуном. Перезарядження можливе завдяки тому, що PbSO4,
що утвориться під час розрядки батареї, не відокремлюється від електродів. Тому
при підключенні зовнішнього джерела енергії електрони перетікають з одного
електрода на інший, a PbSO4 перетворюється в Pb на одному електроді
й у PbО2 на іншому, тобто знову утворяться речовини, що малися у
тільки що зарядженій батареї. При занадто швидкій зарядці батареї можливе
розкладання води на Н2 і О2. Суміш Н2 і О2
вибухонебезпечна, крім того, ця вторинна реакція приводить до скорочення
терміну служби батареї. Виділення газоподібних Н2 і О2
приводить до механічного видалення Pb, PbО2 чи PbSO4 з
поверхні електродів і їхньому нагромадженню у виді шламу в нижній частині
батареї. Згодом це може викликати коротке замикання в батареї і вивести її з
ладу [1].
Різновид
гальванічних елементів, котрі названі сухим елементом, одержала широку
популярність завдяки тому, що цей елемент використовується для живлення ручних
електричних ліхтариків і радіоприймачів. Інша його назва – елемент Лекланше, по
імені винахідника, що запатентував його в 1866 р. В одному з варіантів
(кислому) анод виконаний у виді цинкової оболонки елемента, що контактує з
вологою пастою з MnО2, NH4Cl і вугілля. У пасту занурений
інертний катод, що представляє собою графітовий стрижень, як показано на мал.
5.3. Зовні сухий елемент має оболонку з картону чи металу, що охороняє його від
атмосферних впливів. У цьому гальванічному елементі протікають досить складні
електродні реакції, причому катодна реакція, очевидно, залежить від швидкості
розрядки:
на аноді Zn (тв.)  Zn2+ (водн.) + 2e–
(5.3) Zn2+ (водн.) + 2e–
(5.3)
на катоді 2NH4+ (водн.) + 2MnО2(тв.) +
2е–  Mn2O3(тв.)
+ 2NH3 (водн.) + H2O (рід.) (5.4) Mn2O3(тв.)
+ 2NH3 (водн.) + H2O (рід.) (5.4)
Через обмежену
рухливість реагентів у сухому елементі електрохімічно активна лише частина
катодної речовини, що знаходиться в безпосередній близькості від електрода.
В іншому варіанті
(лужному) замість NH4Cl використовується KOH (луг). Анодна реакція
як і раніше включає окислювання Zn, а катодна реакція – відновлення MnО2.
Сухий елемент такого типу має більшу працездатність, ніж кислий, оскільки в
ньому не виникає корозії цинкового анода при взаємодії з кислим NH4Cl.
Однак лужні сухі елементи дорожче кислотних. У будь-якому варіанті сухий
елемент дає напругу порядку 1,5 В [1, 9].
Оскільки сухі
елементи не можна перезаряджати, їх часто треба заміняти. Тому все більш
популярною стає Ni-Cd батарея, що перезаряджається, яка зручна в
різних побутових приладах, що живляться акумуляторами, і в переносних
обчислювальних пристроях. При розрядці в цій батареї протікають наступні
електродні реакції:
на аноді Cd (тв.) + 2ОН– (водн.)  Cd(OH)2 (тв.)
+ 2е– (5.5) Cd(OH)2 (тв.)
+ 2е– (5.5)
на катоді Ni2 (тв.) + 2Н2О
(рід.) + 2е–  Ni(OH)2 (тв.) + 2ОН–
(водн.) (5.6) Ni(OH)2 (тв.) + 2ОН–
(водн.) (5.6)
Як і у свинцевій
акумуляторній батареї, у Ni-Cd батареях продукти
реакції не відокремлюються від електродів. Це дозволяє легко проводити зворотні
реакції при перезарядженні. Оскільки ні на стадії розрядки, ні на стадії
зарядки не відбувається виділення газів, Ni-Cd батарею можна герметизувати, що являє собою значну зручність.
На відміну від
свинцевої батареї протягом зарядки і розрядки відбувається мінімальна зміна
щільності електроліту. Це дозволяє застосовувати значний запас електроліту без
впливу на електрохімічні процеси між плитами.
З огляду на
електрохімічний пристрій Ni-Cd батареї, її поводження
більш стабільне, ніж у свинцевої батареї, у неї більш тривалий термін служби,
кращі характеристики і більш висока стійкість проти несприятливих умов.
Номінальна напруга
Ni-Cd елементів складає 1,2 В [1, 12].
Багато речовин,
наприклад H2 чи СН4, використовуються як палива. Виделена
при їхній реакції з киснем теплота є джерелом енергії. Виделену при горінні
теплову енергію нерідко перетворюють в електричну енергію. Оскільки горіння
являє собою окислювально-відновну реакцію, у принципі її можна використовувати
для прямого одержання електричного струму в гальванічному елементі, якщо,
звичайно, можливе створення такого елемента. Пряме перетворення хімічної
енергії в електричну має великі переваги в порівнянні зі звичайним способом
перетворення хімічної енергії спочатку в теплову і лише після цього в
електричну. При одержанні електричної енергії з теплової останню використовують
для перетворення води в пару. Потім ця пара пускає в хід турбіну, що обертає
генератор. При перетворенні енергії з однієї форми в іншу чи при її передачі
від однієї речовини до іншої відбуваються неминучі втрати енергії і теплове
забруднення навколишнього середовища Звичайно в електричну енергію вдається
перетворити не більш 40% енергії, отриманої в результаті згоряння палив; інша
частина розсіюється в навколишнє середовище у виді марного тепла. Пряме
одержання електричної енергії з палив за допомогою гальванічних елементів
повинно забезпечити більш високий коефіцієнт перетворення хімічної енергії
палива в електричну енергію. Гальванічні елементи, у яких реагентами служать
традиційні палива, називаються паливними елементами.
На розробку
практично діючих паливних елементів затрачаються великі дослідницькі зусилля.
Однієї з виникаючих при цьому проблем є висока температура, при якій працює
більшість подібних елементів, що не тільки сприяє розсіюванню енергії, але і
прискорює корозію частин гальванічного елемента. Розроблено низькотемпературний
паливний елемент, в якому використовується H2, але поки що цей
паливний елемент занадто дорогий для широкого вжитку. Однак він знаходить
застосування в особливих випадках, наприклад у космічних апаратах. Так,
паливний елемент на основі H2–O2 служив як головне
джерело електричної енергії на космічних кораблях «Апполон», що літали на
Місяць. Маса паливного елемента, що забезпечував корабель енергією протягом
11-денного польоту, складала приблизно 250 кг. Якби для такої мети
використовувався звичайний генератор електричної енергії, його маса повинна
була б складати кілька тонн.
У паливному елементі
на H2–O2 протікають наступні електродні реакції:
на аноді 2H2 (м.) + 4OH–
(водн.)  4H2O (ж.) + 4e– 4H2O (ж.) + 4e–
на катоді 4e– + O2 (м.)
+ 2H2O (рід.)  4OH– (водн.) 4OH– (водн.)
2H2(м.) + O2 (м.)  2H2O
(рід.)
(5.7) 2H2O
(рід.)
(5.7)
Схематичне
зображення цього паливного елемента приведене на мал. 5.4. Електроди виконані у
виді порожніх трубок з пористого спресованого вугілля, просоченого
каталізатором; електролітом служить KOH. Паливний елемент працює доти, поки в
нього не припиниться подача реагентів [1, 8].
Висновки
Таким чином,
гальванічним елементом прийнято називати хімічне джерело електричної енергії
(ХДЕЕ), у якому протікають практично незворотні реакції [3]. Такий ХДЕЕ не
можна перезаряджати: він призначений для однократного використання. ХДЕЕ, у
якому протікають практично зворотні реакції, називають акумулятором: його можна
перезаряджати і використовувати багаторазово.
Дія будь-якого
гальванічного елемента заснована на протіканні в ньому окислювально-відновної
реакції. У найпростішому випадку гальванічний елемент складається з двох
пластин, виготовлених з різних металів і занурених у розчин електроліту. Така
система уможливлює просторовий поділ окислювально-відновної реакції:
окислювання протікає на одному металі, а відновлення – на іншому. Таким чином,
електрони передаються від відновлювача до окислювача по зовнішньому ланцюгу.
У принципі
електричну енергію може дати будь-яка окислювально-відновна реакція. Однак
число реакцій, практично використовуваних у хімічних джерелах електричної
енергії, невелико. Це зв'язано з тим, що не всяка окислювально-відновна реакція
дозволяє створити гальванічний елемент, що володіє технічно коштовними
властивостями (висока і практично постійна е.р.с., можливість відбирання великих
струмів, тривала схоронність і ін.). Крім того, багато окислювально-відновних
реакцій вимагають витрати дорогих речовин.
На відміну від
мідно-цинкового елемента, у всіх сучасних гальванічних елементах і акумуляторах
використовують не два, а один електроліти; такі джерела струму значно зручніше
в експлуатації. Наприклад, у свинцевих акумуляторах електролітом служить розчин
сірчаної кислоти.
Майже у всіх
гальванічних елементах анод, що випускаються в дійсний час, виготовляється з
цинку, а як речовину для катода звичайно застосовують оксиди менш активних
металів.
Список використаних джерел
1. Браун
Т., Лемей Г.Ю. Химия в центре наук: В 2-х т.– М.: Мир, 1983, т. 2. – С.
199-228.
2. Василега М.Д. Окислювально – відновлювальні реакції. – К.: Рад. школа,
1974. – 119 с.
3. Гальванические
элементы и батареи // http://www.aktex.ru/rus/technology/
4. Дамаскин
Б.Б. Принципы современных методов изучения электрохимических реакций. – М.:
Изд. Моск. ун-та, 1965. – 104 с.
5. Кудрявцев
А.А. Окислительно-восстановительные реакции. – М.: Знание, 1971. – 47 с.
6. Окислительно-восстановительные реакции // http://school-sector.relarn.ru/nsm/chemistry/Rus/
Data/Text/Ch1_8.1.html
7. Окислительно-восстановительные
реакции. Электродный потенциал // http://prince-igor.narod.ru/redox.htm
8. Остахов
Е.А., Белюсин И.Н. Справочник по электрохимии. – Л., 1981. – 486 с.
9. Подобаев
Н.И. Окислительно-восстановительные реакции и гальванические элементы. – М.:
Просвещение, 1966. – 116 с.
10. Терни Т. Механизмы
реакций окисления – восстановления. – М.: Мир, 1968. – 238 с.
11. Электрохимия //
http://schoolchemistry.by.ru/o_chemistry/vidy_ximii/tvtelo.htm
12. Электрохимия
никель-кадмиевых батарей // http://www.ferak.cz/ru/ PRIRUCKA/
|