Курсовая работа: Хімічні джерела струму
Курсовая работа: Хімічні джерела струму
ВСТУП.. 2
1. ІСТОРІЯ ВІДКРИТТЯ І РОЗВИТКУ ХІМІЧНИХ ДЖЕРЕЛ СТРУМУ.. 3
2. ХІМІЧНІ ДЖЕРЕЛА СТРУМУ.. 14
2.1 ЗАГАЛЬНА ХАРАКТЕРИСТИКА.. 14
2.2 ПЕРВИННІ ДЖЕРЕЛА СТРУМУ.. 16
2.3 ВТОРИННІ ДЖЕРЕЛА СТРУМУ АБО АКУМУЛЯТОРИ.. 18
2.3.1 СВИНЦЕВИЙ КИСЛОТНИЙ АКУМУЛЯТОР. 19
2.3.2 КАДМІЄВО-НІКЕЛЕВИЙ ЛУЖНИЙ АКУМУЛЯТОР. 21
2.3.4 СРІБНО-ЦИНКОВИЙ ЛУЖНИЙ
АКУМУЛЯТОР. 22
2.4 ПАЛИВНІ ЕЛЕМЕНТИ.. 23
2.5 ХІМІЧНІ ДЖЕРЕЛА СТРУМУ НА ОСНОВІ НЕВОДНИХ ЕЛЕКТРОЛІТІВ 26
ВИСНОВКИ.. 30
ВИКОРИСТАНА ЛІТЕРАТУРА.. 31
В сучасному світі широко використовуються багато явищ, що описуються за
допомогою фізики і хімії. Вони знайшли своє застосування і стали не аби якими
корисними для людства.
Хімічні джерела струму стали рішенням дуже багатьох проблем, а саме, як
можна отримувати автономний струм, що отримується з маленьких елементів,
відносно дешевий вид отримання струму.
У даній курсовій роботі розглянуто пер за все основні і найголовніші
джерела хімічного струму. А саме гальванічні елементи, акумулятори, паливні
елементи.
Цікава і історія розвитку хімічний джерел струму, а особливо відкриття
Гальвані, яке також описано у курсовій роботі.
Не аби яку цікавість викликають і нові технології по отриманню струму
за допомогою хімічних речовин, зараз дуже актуальні елементи з використанням
літію, останніми роками ці елементи дуже добре зарекомендували себе. Отже -
вивчити найголовніші властивості і принцип дії хімічних джерел струму є мета
даної курсової роботи.
Автономні (переносні) хімічні джерела струму діляться на первинні (гальванічні
елементи) і вторинні (акумулятори). Первинні джерела після їхнього виснаження
не заряджаються, а викидаються. Не дивно, що їхня вартість значно нижче, ніж в
акумуляторів, що слугують, наприклад, у мобільних телефонах. Однак принцип дії
в них один - окислювально-відновна хімічна реакція, при якій електрони, що
переходять від відновника до окислювача, і є електричний струм.
До винаходу гальванічних елементів єдиним джерелом електрики були
електричні електростатичні машини (назва походить від грецького слова
"електрон" - бурштин; зі старовини була відома здатність шматків
бурштину заряджатися при терті і притягати легкі предмети). У цих машинах
електричний заряд виникає за рахунок тертя. Потім з'явилися індукційні машини,
у яких заряди з'являлися на обертовних у протилежні сторони скляних дисках і
накопичувалися на двох металевих кулях - розрядниках (такі машини можна
побачити й у шкільному кабінеті фізики). Коли напруга на розрядниках перевищує
напругу пробою повітря (приблизно 30 кіловольт/див), проскакує іскра і чутний
тріск; аналогічне явище у великому масштабі відбувається і при розряді
"дійсної" блискавки. Такі машини дозволяли проробляти деякі досліди
(наприклад, за допомогою іскри можна було підпалити ефір), однак вони не могли
давати електричний струм протягом хоча б декількох секунд.
У 1745-1746 роках німецький фізик Эвальд Юрген Фон Клейст і
голландський фізик Питер Ван Мушенбрук, що працювали в місті Лейдене, створили
простий прилад, що дозволяє зберігати електричний заряд, отриманий від електростатичної
машини. Це був праобраз сучасних конденсаторів, що назвали лейденською банкою. Він
теж міг давати тільки короткочасний розряд.
Створенню постійних джерел струму сприяло відкриття, зроблене
наприкінці XVІІІ в. італійським професором анатомії Луїджи Гальвані. Гальвані
препарував жабу, а неподалік стояла електростатична машина. Коли вістря
скальпелю торкнулося стегнових нервів, то, як писав Гальвані, "негайно всі
м'язи кінцівок почали так скорочуватися, що здавалися запалими в найсильніші
тонічні судороги". Помічник Гальвані помітив, що в цей самий момент між
полюсами машини проскочила іскра.
Такі ж результати були згодом отримані і на інших тваринах і не тільки
холоднокровних. Електричну машину в досліді з жабою цілком міг замінити розряд
у лейденській банці і, як згодом з'ясувалося, атмосферний розряд - блискавка. Гальвані
пояснив це незвичайне явище існуванням деякої "тваринної електрики". На
його думку, м'язи і нерви утворюють як би дві обкладки лейденської банки і
можуть накопичувати електрику. Дійсно, так і відбувається в електричних риб і
скатів: у них є досить ємні природні конденсатори. Але це стало відомо набагато
пізніше. Гальвані ж, сам того не підозрюючи, передбачив досвіди німецького
фізика Генріха Рудольфа Герца, що за допомогою іскри одержав радіохвилі, а
потім зміг їх прийняти на відстані декількох метрів. Тільки в Герца приймачем
служив дротовий прямокутник - антена з іскровим проміжком (дуже слабкі іскорки
в приймачі він спостерігав у темряві за допомогою лупи), тоді як у Гальвані роль
антени виконував скальпель, а детектором був нерв жаби.
Однак у деяких досвідах жаб'ячі м'язи скорочувалися без усяких видимих
причин: ні грози, ні електричної машини поблизу не було. Виявилося, що це
відбувається в тих випадках, коли м'яз і нерв з'єднані металевим дротом, і
особливо сильно - якщо цей дріт складений із двох різних металів; сильніше
інших діяла пара залізо-срібло.
Розкрити природу відкритого Гальвані явища вдалось італійському фізику
Алессандро Вольта. Спочатку він узагалі не повірив Гальвані, але, повторивши
його досліди, переконався в тім, що явище дійсне існує. Однак досліди з дротом
він пояснив зовсім інакше: електрика виникає при контакті різних металів, а
жаба - це просто дуже чуттєвий прилад для виміру і до утворення електрики як такого
відношення не має. Дослідницьким шляхом Вольта розташував метали в ряд таким
чином, що чим далі один від одного вони в цьому ряді, тим більше сильний ефект
роблять. Хіміки з подивом знайшли, що в такому ж порядку змінюється і хімічна
активність металів. В даний час цей ряд називається рядом напруг металів або
електродних потенціалів. В основних рисах він має вид Lі... Mg... Zn... Fe... Sn...
H... Cu... Ag... Au.
Вольта, крім жаби, використовував і інші способи виміру, наприклад,
власний язик: він клав на нього золоту чи срібну монету, а під язик - мідну. Як
тільки дві монети з'єднували шматочком дроту, відразу ж у роті відчувався
кислий смак, знайомий кожному, хто пробував "на язик" контакти
батарейки для кишенькового ліхтаря. Щоб підсилити ефект, Вольта з'єднував пари
металів послідовно, так що вийшов ланцюжок, названа по імені винахідника
"вольтовым стовпом". Спочатку це були чашечки з розчином кислоти, у
яку були опущені металеві смужки, потім - кружечки з цинку і міді (чи срібла),
розділені прокладками з папера, тканини, що були пропитані розчином лугу або просто
розсолом.
Введення в електричний ланцюг розчинів (Вольта назвав їх провідниками
другого роду на відміну від металів - провідників першого роду) виявилося
вирішальним у винаході Вольта. У пам'ять про Гальвані, що помер у 1798, Вольта
назвав свої елементи гальванічними. Незабаром англійський хірург і хімік Энтони
Карлейль виготовив вольтов стовп із 36 послідовно з'єднаних цинкових кружків і
монет У перших дослідах з батареєю спостерігалося розкладання води з утворенням
газів.
Відомий англійський хімік Гемфрі Дэві виготовив вольтов стовп із мідних
і цинкових пластинок, розділених водяним розчином аміаку. Перша його батарея
складалася з 60 таких елементів, а через кілька років довів їхню кількість до
тисячі. За допомогою цієї батареї він провів знамениті досвіди по виділенню
нових елементів - лужних і лужноземельних металів.
Ще більш грандіозну батарею побудував за кілька років до Дэві росіянин
фізик-самовучка Василь Володимирович Петров. У 1802 році він створив батарею,
що складається з 4200 мідних і цинкових пластин. Між металевими кружками
прокладалися картонні кружки, просочені розчином хлориду амонію. "Стовп
Петрова", на відміну від вольтова стовпа, розташовувався горизонтально в
сухих вузьких дерев'яних шухлядках. Уся батарея була складена з чотирьох рядів,
кожен довжиною близько 3 м, з'єднаних послідовно мідними дужками. Про важкість
роботи з цією батареєю свідчить такий факт: щоб очистити тільки 40 пластин
після їхнього окислювання помічнику Петрова було потрібно не менш години! Теоретично
така батарея може давати напругу до 2500 вольт. За допомогою цієї гігантської
батареї Петров провів безліч дослідів: він розкладав різні речовини, у тому
числі органічні, а також оксиди металів - ртуті, свинцю й олова. У 1803 Петров
вперше у світі одержав електричну дугу і вказав на можливість її практичного
застосування; так, з її допомогою йому вдалося розплавити метали, яскраво
висвітлювати великі приміщення.
Протягом XІХ ст. працями фізиків і хіміків була закладена теорія роботи
гальванічних елементів; основна заслуга в цьому належить німецькому фізико-хіміку
Вальтерові Нернсту. Конструкція елементів також була значно удосконалена. Головний
підсумок роботи теоретиків такий: у гальванічному елементі відбувається пряме
перетворення хімічної енергії в електричну. Для цього в елементі повинна
протікати окислювально-відновна реакція, наприклад, розчинення цинку в кислому
середовищі:
Zn + 2H+ = Zn2+ + H2.
Атоми цинку (відновники) віддають електрони:
Zn - 2e = Zn2+,
а іони водню (окислювачі) їхній приймають:
2H+ + 2e = H2.
У гальванічному елементі процеси окислення і відновлення просторово
розділені: водень повинний виділятися не на цинку, а на міді. Тоді електрони
від цинку до міді будуть переходити не безпосередньо в розчині (у цьому випадку
вони губляться без користі), а через зовнішній ланцюг, де можуть робити корисну
роботу. Саме так працює елемент Вольта.
Струм в елементі знімається за допомогою двох електродів. Відповідно до
прийнятої номенклатури, на одному з них - аноді протікає процес окислення, а на
катоді йде відновлення. Тому цинковий електрод гальванічного елементу - це
анод, а мідний - катод (при електролізі солей цинку він виділяється на катоді,
тому що при цьому цинк не окислюється, а відновлюється: Zn2+ + 2e = Zn; аналогічно
при електролізі з мідним анодом мідь окислюється: Cu - 2e = Cu2+, так що
визначення катода й анода залишається в силі)
Дія гальванічного елементу припиняється після повного чи часткового
використання якогось електроду (наприклад, цинку). Тому що хімічна реакція, що
протікає в елементі, не оборотня, його не можна знову "зарядити". Електрорушійна
сила елемента (ЭРС) не залежить від розмірів і конструкції електродів, від
кількості електроліту, але залежить від природи хімічної реакції, що протікає,
від складу і концентрації електроліту. Якщо ці параметри відомі, ЭРС можна
розрахувати. Розрахувати можна і теоретичну ємність елемента. Так, за законом
Фарадея для розчинення 1 моль цинку потрібно 2 моль електронів, чи 96500 кулонів
(ампер-секунд) електрики, чи 26,8 ампер-годин.
Здатність металу переходити в розчин у виді іонів, а також
відновлюватися з іонів до металу характеризується його стандартним електродним
потенціалом. Ряд, вибудований у порядку зміни потенціалів, називається рядом
стандартних електродних потенціалів (при стандартних умовах концентрації всіх
іонів рівній 1 моль/л, тиск усіх газів складає 1 атм).
Щоб визначити стандартний електродний потенціал металу, вимірюють ЭРС
гальванічного елемента, один з електродів якого - досліджуваний метал,
занурений у розчин його солі (при концентрації 1 моль/л), а другий електрод - еталонний
(його ще називають водневим). Він виготовлений з дуже пористої губчатої платини
й занурений у розчин кислоти (концентрація іонів H+ 1 моль/л); платиновий
електрод безупинно оточує газоподібний водень (під тиском 1 атм), що частково
розчиняється в платині. Таким чином, всі електродні потенціали - не абсолютні,
а відносні, обмірювані для гальванічної пари метал - водень (потенціал
стандартного водневого електроду приймають рівним нулю). Визначені в таких
умовах потенціали різних металів завжди будуть постійними, вони занесені в усі
довідники і приводяться звичайно для температури 250С). Електродні потенціали
активних металів, що реагують з водою, отримані непрямим шляхом.
Електродні потенціали записують як потенціали відновлення іонів металів.
Найнегативніший потенціал (-3,04 В) - у реакції Lі+ + e = Lі; один з
найпозитивніших (+1,68 В) - у реакції Au+ + e = Au. Це говорить про те, що ЭРС
гальванічної пари літій-золото (якби така пари могла працювати у водяному
середовищі) була б рівною 4,72 В; для розповсюдженої пари мідь-цинк ЭДС значно
менше і дорівнює 1,10 В (відповідні потенціали металів рівні - 0,76 і +0,34 В).
Для неводних електролітів можна використовувати і лужні метали; так улаштовані,
наприклад, літієві елементи (їх застосовують, зокрема, для "харчування"
стимуляторів серця) - вони дають ЭРС до 3,5 В. Звичайно, потенціали для
неводних розчинів інші.
При роботі гальванічного елемента, коли через нього і через зовнішній
ланцюг йде струм, напруга на електродах знижується; це зниження за законом Ома
залежить від внутрішнього опору елемента (звичайно воно складає від 1 до 20 Ом)
і від сили струму. Для деяких елементів це зниження невелике і не перевищує 0,1
В, для інших може бути значно великим. Стосовно до джерел струму зниження
напруги на електродах при роботі елемента називається поляризацією. Вона
залежить від хімічної природи і конструкції електродів, від складу і
концентрації електроліту, щільності струму, температури. Так називана хімічна
поляризація часто спостерігається при виділенні на електродах водню і кисню. Величина
такої поляризації в дуже сильному ступені залежить від матеріалу електрода. Наприклад,
якщо в елементі Вольта замінити мідний електрод на платиновий, то напруга
елемента зросте майже на 0,5 В. Якщо ж замість мідного електрода узяти
свинцевий, то напруга, навпаки, упаде приблизно на 0,6 В. Різниця між
експериментальним і теоретичним потенціалом електрода для даної концентрації
іонів водню і щільності струму називається перенапругою водню на цьому
електроді. Поляризація відіграє роль і в процесах електролізу: якби її зовсім
не було, розряд іонів водню йшов би вже при дуже малій напрузі на електродах,
чого не спостерігається.
В елементі Вольта навіть при незамкнутому зовнішньому ланцюзі все-таки
йде окислювально-відновна реакція на межі цинк-кислота (катодами слугують
домішки в цинку). Тому це джерело струму на практиці не застосовується. Крім
того, що виділяються на мідному електроді і прилипають до нього пухирці водню
сильно заважають роботі елемента. На цю обставину в 1836 звернув увагу Джон
Фредерік Даніель - британський хімік і метеоролог (він винайшов також вимірник
вологості - гігрометр). У його конструкції цинковий електрод занурений у розчин
цинкового купоросу (сульфату цинку), а мідний - у розчин мідного купоросу
(сульфату міді). У результаті на мідному електроді водень не виділяється, а йде
реакція відновлення іонів міді: Cu2+ + 2e = Cu. Щоб обидва електроліти не
змішувалися, Даніель розділив їхньою пористою перегородкою з необпаленої глини.
Такий пристрій уперше забезпечив тривалу і рівномірну дію гальванічного
елемента, а його ЭДС (електрорушійна сила) близька до теоретичного і дорівнює
1,09 В. За цей винахід Даніель був визнаний гідним вищої нагороди Королівського
суспільства - золотої медалі Коплі. Незалежно аналогічний елемент був
розроблений російським ученим Б.С. Якобі. Цей елемент при порівняльної простої
конструкції мав значну ємність і протягом декількох десятиліть застосовувалося
як джерело харчування на телеграфі. І в даний час роботу хімічних джерел струму
пояснюють на прикладі елемента Даніеля - Якобі.
Інакше вирішили проблему поляризації катода Грені, Бунзен і Гроув. Грені
замінив мідний електрод вугільним, а до розчину сірчаної кислоти додав дихромат
калію. Дихромати в кислому середовищі - дуже сильні окислювачі, тому водень на
катоді просто окислявся до води. В елементі Бунзена вугільний катод був
занурений у концентровану азотну кислоту, що знаходилася в пористій керамічній
судині, а зовні був цинковий анод у розведеній сірчаній кислоті. Саме елементи
Бунзена послужили Ч.М. Холу, що вперше одержав алюміній методом електролізу. У
Гроува замість вугільного електрода був платиновий, а цинк Гроув амальгував. Щоб
цинк не розчинявся в кислоті в той час, коли такими елементами не користаються,
цинковий електрод робили піднімальним.
Значно удосконалив гальванічний елемент і зробив його зручним для
практичного використання французький інженер Жорж Лекланше в 1867 Як деполяризатор
він використовував діоксид марганцю, що на катоді відновлюється, перешкоджаючи
виділенню газоподібного водню:
MnО2 + 4H+ + 2e = Mn2+ + 2H2O. Спочатку електролітом служив водяний
розчин хлориду амонію; потім Лекланше став використовувати електроліт,
загущений клейстером. Це революційним образом змінило справу: "сухі"
елементи Лекланше перестали боятися випадкового перекидання, їх можна було
використовувати в будь-якім положенні. Винахід Лекланше мав негайний
комерційний успіх, а сам винахідник, закинувши свою основну професію, відкрив
фабрику по виробництву елементів.
В даний час елементи Лекланше - найдешевші, і випускаються мільярдами. Цьому
сприяє приступність і дешевина сировини: цинк дешевше міді, а MnО2 - найпоширеніша
сполука марганцю в природі (мінерал піролюзит). Багаті поклади цієї руди
маються в Африці, Бразилії, Мексиці. Активна катодна суміш елементів Лекланше,
що оточує вугільний катод, пресується з діоксида марганцю і графіту з добавкою
електроліту. Цинкові аноди спочатку робили зі сплаву, що містить свинець,
кадмій і досить багато (до 8%) ртуті. Зараз зміст ртуті зведений до мінімуму, а
в багатьох елементах ртуті немає зовсім (на них позначено "mercury
free"). Вже з перших днів виробництва елементів Лекланше було встановлено,
що різні джерела діоксида марганцю сильно впливають на характеристики елемента.
Дійсно, відомо принаймні п'ять кристалічних модифікацій Mn2, що розрізняються
по властивостях. Найдешевші елементи використовують природний піролюзит,
добутий у Гані, чи Габону Мексиці. Уся його переробка зводиться до простого
перемелювання і промивання. Щоб одержати більш відтворені результати,
використовують чи хімічно електрохімічно модифікований високоякісний MnО2,
змішаний з вугільним порошком, а замість хлориду амонію застосовують більш
дорогий хлорид цинку - такі елементи звичайно позначають як
"heavy-duty", тобто підвищеної потужності. Тепер зрозуміло, чому
різні елементи так сильно відрізняються за ціною і якістю.
У лужних елементах (їхнє масове виробництво почалося в 1950-і) електролітом
служить цинкат калію K2Zn(OH) 4 у концентрованому розчині КОН; при цьому на
катоді йде реакція MnО2 + H2O + e = MnOOH + OH-. У лужних елементах (на них
значиться "alkalіne") анод складається з дрібних цинкових гранул у
гелі електроліту, поміщених у стаканчик-сепаратор. Він стосується внутрішньої
стінки зовнішнього сталевого циліндра.
Якщо хімічне джерело струму зроблене якісно і не робить роботи (не
включений ні в який електричний ланцюг), то напруга на ньому може не мінятися
буквально століттями. Так, електричний дзвоник, що зберігається в музеї
фізичних приладів Кларендонской фізичної лабораторії в Оксфорді, без усякої чи
підзарядки зміни батареї, справно (і безупинно) працює від батареї гальванічних
елементів уже понад півтора століття!
На відміну від гальванічних елементів, в акумуляторі (назва походить
від латинського слова, що означає "нагромаджувати",
"збирати") використовуються оборотні хімічні реакції. Так, при
розряді найпоширенішого свинцевого акумулятора (їхнє світове виробництво перевищує
100 млн. у рік) йде реакція
PbО2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O; у нікель-кадмієвому - 2NіOOH + Cd =
2Nі(OH) 2 + Cd(OH) 2
(аналогічна реакція йде в нікель-залізному акумуляторі); у
срібно-цинковому
Ag2O + Zn = Zn + 2Ag;
при заряді всі ці реакції йдуть у зворотному напрямку. Тому акумулятор
можна заряджати за допомогою зовнішнього джерела струму. Акумулятори
(наприклад, для мобільного телефону) помітно дорожче гальванічних елементів.
Акумулятори дають приблизно таку ж напругу, як і гальванічні елементи. Так,
найпоширеніший кислотний свинцевий акумулятор дає близько 2 В, лужний
нікель-кадмієвий - близько 1,3 вольт, а нікель-залізний - близько 1,4 вольт. Такої
напруги цілком достатньо для роботи кварцових годинників, але вже лампочка для
кишенькового ліхтаря горіти від одного акумулятора не буде. Тому, як і
гальванічні елементи, акумулятори для підвищення напруги з'єднують у батареї. Для
живлення диктофона, плейера чи фотоапарата досить двох з'єднаних послідовно
акумуляторів. На автомобілях з'єднують послідовно вже шість свинцевих
акумуляторів; вони здатні короткочасно давати дуже великий струм, необхідний
для запуску двигуна. Гальванічні елементи і батареї великих струмів давати не
можуть. Акумулятори працюють також на космічних кораблях, в електромобілях і
електрокарах, їх використовують для аварійного висвітлення.
У 1970 р. почались дослідження нового типу акумуляторів - нікель-гідридних,
а в 80-і роки з'явилися перші робочі зразки, у яких струм генерувався в
результаті реакції 2NіOOH + H2 = 2Nі(OH) 2. При заряді водень знову виділявся. Тому
що водень для таких акумуляторів знаходиться під великим тиском, блок з
електродами поміщають у сталевий циліндр. Ці акумулятори запасали на 40% більше
енергії (на одиницю маси), ніж нікель-кадмієві. Через високу вартість (тисячі
доларів кожний) ці акумулятори застосовували насамперед там, де особливо
важливі економія ваги, тобто в космічній техніці. В останні роки розроблені
мініатюрні метал-гідридні
акумулятори; у них при заряді катіони водню в електроліті відновлюються,
атоми водню дифундують у метал (звичайно використовуються интерметалічні склади)
і утворюється гідрид. При розряді процес йде в зворотному напрямку. Перевагу
таких акумуляторів може оцінити кожен власник мобільного телефону.
Про потенційні можливості акумуляторів говорить такий факт. У Західному
Берліні, побоюючись відключення електроенергії владою ГДР (у 1961 році вже була
почата спроба задушити місто блокадою), спорудили величезну акумуляторну
батарею. Ця батарея масою 630 тон при потужності 17 мегават могла в разі
потреби протягом години, до запуску аварійних електростанцій, постачати
багатомільйонне місто електроенергією.
В останні десятиліття інтенсивні роботи ведуться по створенню й
удосконаленню паливних елементів - пристроїв, що виробляють електроенергію за
рахунок хімічної реакції між речовинами, що безупинно подаються до електродів
ззовні. Окислювачем найчастіше слугує кисень, а паливом може бути, наприклад,
водень. На базі таких елементів уже працюють дослідні електростанції.
Будь-який електрохімічний елемент у принципі є джерелом електричного
струму. Однак для практичного використання як джерела струму придатна лише незначна
частина цих елементів. Це пов’язано з тим, що елемент повинен мати досить
велику електричну ємність, високу швидкість і оборотність електрохімічних
процесів, стабільність при експлуатації, технологічність і економічність
виробництва.
Всі хімічні джерела струму (ХДС) поділяються на три групи: джерела
струму одноразової дії (гальванічні елементи), джерела струму багаторазової дії
(акумулятори), паливні елементи.
У первинних ХДС електродні матеріали завантажуються в елемент при
виготовленні, і елемент експлуатується, поки його напруга не впаде до деякого
критичного значення. Електродні матеріали ХДС, що відпрацювали, йдуть у відходи
або частково переробляються для регенерації компонентів.
В акумуляторах електроактивні речовини у ході попереднього електролізу
(заряд акумулятора). У процесі експлуатації вони витрачаються (розряд
акумулятора), а напруга акумулятора знижується до деякої гранично допустимої
величини, після чого знову проводять заряд. Процеси заряду і розряду утворюють
цикл роботи акумулятора. Максимальне число циклів (звичайно декілька сотень) залежить
від типу акумулятора і умов його експлуатації.
Робота ХДС характеризується рядом параметрів, від яких залежить
можливість використання ХДС для тих або інших потреб.
Електрорушійна сила (ЕРС) хімічного джерела струму, як і будь-якого
електрохімічного кола, визначається різницею потенціалів електродів (анода і
катода) при розімкненому зовнішньому колі.
Повним внутрішнім опором r ХДС називається опір, що чиниться ним при
проходженні всередині нього постійного струму:
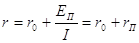
де ЕП - ЕРС поляризації: І - сила струму.
Перша з цих складових r0 називається омічним опором і являє собою суму
опорів електродів і електроліту. Друга складова rП - зумовлена зміною
потенціалів електродів при проходженні струму і називається опором поляризації,
або фіктивним опором, його величина залежить від величини струму. У процесі
розряду ХДС повний внутрішній опір збільшується через зміну складу електроліту
і електродів. Наявністю внутрішнього опору зумовлене те, що розрядна напруга Up
(тобто напруга при замкненому зовнішньому колі) завжди менша за ЕРС джерела
струму:
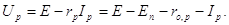
(нижній індекс "р" означає розряд).
При постійній величині струму та постійній температурі електроліту
розрядна напруга зменшується у часі.
Зарядна напруга Uз оборотних систем виражається рівнянням:
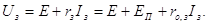
При постійній величині зарядного струму зарядна напруга збільшується у
часі внаслідок збільшення ЕП. У кінці заряду, коли відбувається в основному
процес електролізу води, значення Uз стабілізується.
Розрядною ємністю (ємністю за струмом) Qр називається та кількість
електрики, яка може бути отримана від ХДС при даних умовах роботи, тобто при
заданих температурі, величині розрядного струму і кінцевому значенні розрядної
напруги.
Одними з найбільш поширених первинних ХДС є мангано-цинкові елементи,
виробництво яких становить близько 3 млрд. одиниць на рік. Це сольові елементи
(система Лекланше):
(-) Zn | 20% - ний розчин NH4Cl | MnO2 | C (+)
та лужні
(-) Zn | KOH | MnO2 | C (+)
Негативним електродом елемента Лекланше є цинковий стакан, електроліт -
розчин хлориду амонію із загусником (борошном або крохмалем). Позитивний
електрод являє собою вугільний стрижень, оточений піролюзитом MnO2. До розчину
хлориду амонію додається невелика кількість хлориду цинку, хлориду кальцію і
хлориду ртуті. Перші дві солі гігроскопічні і перешкоджають пересиханню
елемента та збільшують в’язкість розчину. Хлорид ртуті виконує подвійну функцію:
з одного боку, ртуть із хлориду частково осідає на цинку (Zn + HgCl2 = ZnCl2 +
Hg), поверхня якого внаслідок цього амальгамується і стає більш однорідною, що
зменшує саморозряд. З іншого боку хлорид ртуті знищує мікроорганізми і
запобігає бродінню крохмалю. Останнім часом виготовляють елементи без домішок
сполук ртуті, які замінюють органічними інгібіторами. Порошок піролюзиту для
збільшення електричної провідності змішується з сажею або графітовим порошком.
За конструкцією сучасні елементи розділяються на циліндричні,
прямокутні, чашкові та галетні.
Хімічним процесом, що перебігає в елементі, є окислення цинку діоксином
марганцю:
Zn + 2NH4Cl + 2MnO2 = [Zn(NH3) 2] Cl2 + Mn2O3 + H2O
ЕРС елемента типу Лекланше досягає 1,5 В, його внутрішній опір дорівнює
0,05 - 1 Ом, потужність 20-25 Вт/кг. Існують різні варіанти елементу Лекланше. У
деяких із них замість хлориду амонію застосовується, наприклад, хлорид (або
бромід) магнію, який сприяє зменшенню саморозряду внаслідок захисної дії Mg(OH)
2, що утворюється, але цей елемент має більш низьку напругу. У тих випадках,
коли від елемента потрібна висока питома потужність, замість цинку застосовують
більш легкі метали - магній або алюміній, наприклад мангано-магнієвий елемент:
Mg | MgBr2 | MnO2 | C,
в якому відбувається реакція
MnO2 + Mg + H2O = MnO + Mg(OH) 2
Малюнок 1.1 Схема найпростішого гальванічного елементу
Малюнок 1.2 Схема мангано-цинкового елементу (батарейки)
В акумуляторах при пропусканні крізь них електричного току від
зовнішнього ланцюгу (заряд) йдуть хімічні реакції в електродах і розчинах,
близькі до оборотних, і робота електричного току акумулюється у вигляді вільної
енергії продуктів реакції. Заряджений акумулятор дає електричний струм при
розряді, після чого знову можна його зарядити.
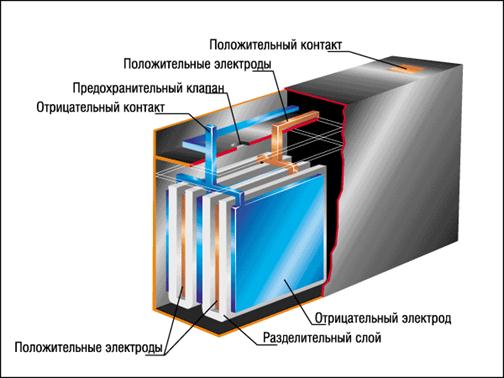
Малюнок 2. Загальна будова акумулятору
Найбільш широко використовують кислотний свинцевий, лужний кадмієво -
нікелевий та лужний срібно - цинковий акумулятори.
Свинцевий кислотний акумулятор в зарядженому стані являє собою елемент:
(-) Pb, PbSO4(т) | H2SO4 (32-34%) | PbO2, Pb (+)
при роботі якого протікають наступні електродні реакції: на лівому
катоді:
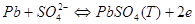
на правому електроді:
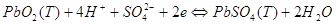
сумарна реакція процесу:
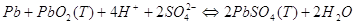
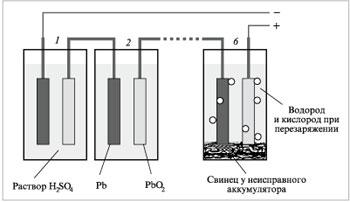
Малюнок 3. Схема дії свинцевого акумулятору
Ізобарний потенціал цієї реакції відображає зникнення твердих свинцю і
його діоксину, виникнення твердого сульфату свинцю, а також зникнення 2 моль
сірчаної кислоти і виникнення 2 моль води:
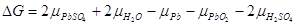
Так як хімічні потенціали твердих фаз постійні (при даних температурі і
тиску), то
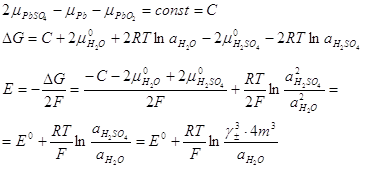
Ізобарний потенціал і ЕРС акумулятора залежать від концентрації
сірчаної кислоти (точніше - від активності компонентів розчину).
У процесі розряду акумулятора концентрація сірчаної кислоти
зменшується, а при зарядженні збільшується.
Цей акумулятор у зарядженому стані являє собою електрохімічний елемент:
(-) Cd | Cd(OH) 2, KOH (20%) || KOH (20%), Ni(OH) 2, Ni(OH) 3/Ni (+)
Сумарна реакція і цьому елементі:
Cd + 2Ni(OH) 3 = Cd(OH) 2 + 2Ni(OH) 2
Значення 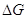  для цієї реакції не повинно
залежати від концентрації лугу, так як в сумарній реакції приймають участь
тільки тверді речовини. Однак реакції на електродах супроводжуються зміною
концентрацією лугу і утворенням різниці концентрації у двох електродів: для цієї реакції не повинно
залежати від концентрації лугу, так як в сумарній реакції приймають участь
тільки тверді речовини. Однак реакції на електродах супроводжуються зміною
концентрацією лугу і утворенням різниці концентрації у двох електродів:
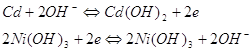
Ця різниця повинна визначати концентраційну поляризацію, котра зменшує
ЕРС елементу. Однак в результаті перемішування в умовах близькості електродів
ця різниця концентрацій практично не виникає.
ЕРС кадмієво - нікелевого акумулятора рівна приблизно 1,36 В. Використовуються
такі лужні акумулятори, в яких кадмій і оксид кадмію замінюють залізом та
закисним залізом.
Анодом є пориста цинкова пластинка, катодом оксиди срібла Ag2O і AgO,
отримані електролітичним окисненням металічного срібла. Електроліт -
концентрований розчин КОН, насичений цинкатом калія Zn(OK) 2. Заряджений
акумулятор може бути представлений у вигляді:
(-) Zn | Zn(OK) 2 + KOH(40%) | Ag2O або AgO | Ag (+)
Сумарна реакція в цьому елементі
AgO + Zn = ZnO + Ag
Процес проходить у дві стадії: AgO відновлюється спочатку до Ag2O, далі
до металічного срібла. ЕРС елементів з катодом AgO рівна 1,86 В, з катодом Ag2O
- 1,58-1,60 В. При малій густині струму напруга падає на 0,3 В при переході від
першої стадії до другої. Практично використовується лише друга стадія.
Після розряду акумулятора:
(-) Zn | ZnO, Zn(OK) 2 + KOH (40%) | Ag (+)
В таких акумуляторах на відміну від свинцевих і лужних електроліт в
реакціях заряду і розряду не приймає участі, саме цьому його можна брати в
малій кількості. Це дозволило сконструювати акумулятори, що мають дуже
ефективну конструкцію: електроди знаходяться один біля одного і розділені
тонким шаром целофану. Весь електроліт знаходиться в порах електродів. Срібно -
цинкові акумулятори мають велику ємність, високу енергію і високу потужність на
одиницю маси і об’єму, саме цьому вони широко застосовуються там, де необхідні
акумулятори невеликого розміру.
У наш час велика частина електроенергії виробляється на теплових
електростанціях при спалюванні природних енергоносіїв (вугілля, нафти,
природного газу). При цьому процес перетворення хімічної енергії палива в
електричну проходить через три стадії: перетворення хімічної енергії у теплову
при згоранні палива; далі - теплової енергії у механічну роботу у паровій
машині; нарешті, перетворення механічної роботи в електроенергію у генераторі. На
всіх цих стадіях втрачається енергія і коефіцієнт корисної дії (ККД) сучасних
теплових електростанцій становить близько 40%, а для більшості електростанцій -
25%.
Термодинамічний аналіз, проведений ще в кінці XIX ст. ., показав, що в
гальванічних елементах немає такого обмеження ККД, як у теплових машинах. У
1893 р. Нернст обчислив, що якби вдалося перетворювати хімічну енергію вугілля
в електричну електрохімічним шляхом, то максимальний теоретичний ККД такого
процесу становив би 99,75%. Однак через чисельні технічні труднощі перші
працездатні паливні елементи вдалося створити лише у 30 - 40 - х роках ХХ ст. .
Паливними елементами називають гальванічні елементи, в яких
електрохімічно активними речовинами слугують звичайні горючі речовини і кисень,
а процесом генерування струму є окислення горючих речовин. При роботі елемента
проводиться безперервна подача реагентів і відвідення продуктів реакції, так що
склад системи практично не змінюється.
При роботі будь-якого хімічного джерела струму проходить сумарна
хімічна реакція взаємодії окисника з відновником. Максимальна електрична
робота, отримана при роботі джерела струму, рівна зменшенню ізобарного
потенціалу для цієї реакції:
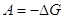
Перетворення енергії у електричну шляхом паливних елементів доволі
складний процес. Максимальна електрична робота, отримана при складному
перетворенні, визначається тепловим ефектом реакції 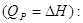
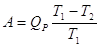
Найбільш реакційно здатним видом палива є водень. Воднево - кисневі
елементи зазвичай виготовляють з застосуванням мілко дрібних вугільних або
нікелевих електродів, що занурені в лужний розчин електроліту. Схематично такий
елемент можна уявити в такому вигляді:
(-) (Ni) H2 | KOH (30-40%) | O2(Ni) (+)
Малюнок 4. Воднево-кисневий паливний елемент
При роботі елемента на негативному електроді протікає електродна
реакція:
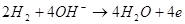
На позитивному
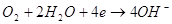
Сумарна реакція
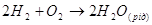
Теоретичне значення ЕРС воднево - кисневого елемента при 250С дорівнює
1,229 В і не залежить від складу розчину - електроліту.
При розряді воднево - кисневих елементів напруга тримається у межах 07,
- 0,9 В, в залежності від густини розрядного струму на електродах (в лучних
конструкціях елементів густина струму сягає 200-300 ма/см2).
Інші види газоподібного палива (оксид вуглецю, вуглеводні) практично можуть
бути застосовані у паливних елементах тільки при підвищених температурах (вище
400-5000С). У таких високотемпературних елементах у якості електроліту
використовують або розплави вуглецевих солей лужних металів, або тверді
електроліти з аніонною (кисневою) проводністю.
Спроби безпосередньо використовувати тверде вугілля у паливних
елементах поки безуспішні. Вугілля може бути використане тільки після
попередньої газифікації його. Якщо газифікацію проводити за допомогою СО2,
спостерігається наступна послідовність реакцій:
Газифікація 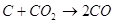
В паливному елементі 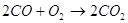
Сумарна реакція 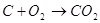
Водень - кисневий елемент можна створити, наприклад, за допомогою двох
платинових електродів, занурених у водний розчин гідроксиду калію. Один електрод
омивається воднем, інший - киснем;
Pt(H2) | KOH, насичений H2 | KOH, насичений О2 | (O2) Pt.
У цьому елементі окиснення водню і відновлення кисню просторово
розділені, і струм генерується у процесі реакцій:
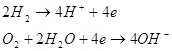
Тобто сумарний процес зводиться до окиснення водню киснем з утворенням
води. Істотним недоліком, такого паливного елемента є дуже мала густина струму.
Для збільшення густини струму використовують підвищений тиск і температуру,
спеціальні конструкції електродів, перемішування розчину тощо.
Розробка паливних елементів продовжується. Принципово доведена
можливість використання деяких видів палива в паливних елементах і перетворення
їх хімічної енергії в електричну з практичним ККД до 75 - 90%.
Розвиток техніки, яка зробила якісний стрибок у другій половині ХХ
століття, істотно підвищив вимоги до джерел електричної енергії. Поява
компактних ХДС стала дуже актуальною. Потрібні були ХДС, здатні зберігати заряд
і працювати безупинно роками. Крім того зростає дефіцит кольорових металів,
особливо срібла, що вимагає їхньої заміни іншими матеріалами. Рішення цих задач
стало можливим на основі створення джерел струму з електролітами у неводних
розчинниках.
У хімічних джерелах струму як відновники, як правило, використовують
метали. Із зіставлення значень електродних потенціалів у ряді напруг металів
випливає, що найбільш енергоємні анодні матеріали розташовані у верхньому
лівому куті періодичної системи елементів. Теоретичні значення питомої енергії,
що можуть забезпечити ці метали, складають (у Втгод/кг): для Li - 11757, Mg -
5216, Al - 4946, Са - 3837, Na - 3163. У той же час теоретичні значення питомої
енергії для традиційних матеріалів ХДС дорівнюють: для Zn - 623, Fe - 423, Ni -
278, Cd - 190 Втгод/кг. Однак високі електродні потенціали роблять метали І,
ІІ, ІІІ групи періодичної системи нестійкими у водному середовищі, що практично
виключає їх використання у ХДС. Енергетичні можливості легких металів вдалося
реалізувати лише після того, як було показано, що багато з них, і в першу чергу
літій, стійкі і здатні анодно розчинятись у неводних розчинниках.
Існує ряд органічних сполук, які не містять у своїй молекулі рухливого
атома водню і відносяться до класу апротонних диполярних розчинників (АДР.). В
електролітах на основі цих розчинників літій не тільки може зберігатися на
протязі багатьох років, але і виявляє поведінку, властиву рівноважним
електродам. Зокрема, його потенціал підпорядковується рівнянню Нернста у
широкому інтервалі концентрацій іонів літію, не залежить від перемішування
розчину, швидко повертається до вихідного значення після малих катодних і
анодних поляризацій.
Головним критерієм, за яким були прийняті до використання розчинники
групи АДР, є їхня сумісність з літієм. У даний час відсутній строгий
теоретичний підхід до вибору оптимального розчинника, тому у промисловому
виробництві використовується ряд різних розчинників. До них відносяться у першу
чергу прості і складні ефіри, головним чином циклічні: 1,2 - диметоксіетан (1,2
- ДМЕ), 1,3 - діоксолан (1,3 - ДО), метил форміат (МФ), пропілен карбонат (ПК),
тетрагідрофуран (ТГФ).
Термодинамічними розрахунками було доведено, що система Li - АДР не є
стійкою. Значення потенціалів для реакцій взаємодії літію з АДР можуть досягати
2,5 - 4,3 В, а продуктами реакції є сполуки, нерозчинні в АДР.
АДР мають невисоку сольватуючу здатність, і внаслідок цього в них добре
розчиняються лише деякі літієві солі. Це, головним чином, сполуки із
комплексними аніонами, що містять як центральний атом елементи третьої і п’ятої
груп періодичної системи. Як електроліти у промисловому виробництві
використовуються LiAs6, LiBF4, LiAlCl4, LiCl4, LiBr. Усі ці солі сильно
гігроскопічні, що значно ускладнює і здорожує виробництво через труднощі
глибокого осушування та необхідності захисту всього технологічного процесу від
впливу атмосферної вологи.
Зараз у літієвих ХДС використовуються як тверді, так і рідкі катодні
матеріали. Високий електродний потенціал літію дозволяє застосовувати не
занадто активні окислювачі і при цьому одержувати електродні пари з ЕРС,
більшою 3 В. Промисловість випускає елементи з простими (MnO2, CuO, V2O5) і
складними (2PbOPbO2, 2PbOBi2O3, Ag2OCrO3) оксидними катодами, з катодами з SO2,
SOCl2.
Розряд негативного літієвого електрода веде до його іонізації:
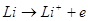
Присутність на поверхні літію оксидно - сольової плівки впливає на його
потенціал і швидкість розряду.
У залежності від природи катодного матеріалу схеми електрохімічних
реакцій можна зобразити рівняннями:
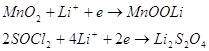
Найбільш поширене виробництво циліндричних та дискових елементів різних
конструкцій.
Створення ХДС на основі неводних електролітів стимулювало розвиток
теоретичних уявлень в області теорії розчинів, поверхневих явищ, нових типів
неорганічних сполук, нестехіометричних сполук, теорії пористих електродів тощо.
Теоретичні досягнення, у свою чергу, дозволяють очікувати істотного поліпшення
нових поколінь ХДС.
В наш час залишаються дуже актуальними акумулятори, адже більшість
автомобільних транспортних засобів не може обходитись без цих хімічних джерел
струму. Також дуже поширені цинково-манганові елементи, що дістали назви
звичайної батарейки. Всі вони є надійними джерелами струму і слугують порівняно
тривалий час.
Вичерпність природних ресурсів призводить до створення нових хімічних
джерел струму, зараз ведеться активна робота по їх створенню. І допоможуть в
цьому лужні метали. Вже зроблені перші кроки - створено хімічні джерела струму
на основі літію, що знаходиться у контакті з органічним апротонним розчинником.
Літієві джерела струму зарекомендували себе як дуже надійні. Зараз важко
зустріти галузь деб не застосовувались такі елементи. Батареї мобільних
телефонів і рацій, батарейки для годинників, калькуляторів, різноманітних
приладів - майже скрізь працюють літієві хімічні джерела струму.
Саме вони стають найбільш актуальними у подальшому розвитку суспільства.
Паливні елементи є не актуальні, адже вони дуже енергоресурсоємкі, а
коефіцієнт корисної дії порівняно низький.
Акумулятори також ще застосовуються, але вже існують пристрої, значно
спрощеної дії ніж акумуляторів, і виконують ті ж самі функції.
Отже ера хімічних джерел струму продовжується, і невпинно крокує вперед.
1.
Герасимов Я.И., Курс физической химии, т. ІІ,
издание 2, испр., М., "Химия", 1973.
2.
Лебідь В.І., Фізична хімія, Харків, "Фоліо",
2005.
3.
Льоцци М., История физики, М., "Мир",
1970.
|