Реферат: Тяжёлые металлы. Источники поступления в окружающую среду. Действие на организм человека
Реферат: Тяжёлые металлы. Источники поступления в окружающую среду. Действие на организм человека
БЕЛОРУССКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ФАКУЛЬТЕТ
ФИЛОСОФСКИХ И СОЦИАЛЬНЫХ НАУК
РЕФЕРАТ
по дисциплине: "Экология"
на тему:
«Тяжёлые металлы.
Источники поступления
в окружающую среду.
Действие на организм человека».
| Житкевич И.Н., студентки |
| 1 курса заочного обучения ФФСН |
|
|
|
|
| Проверил: Румянцев И.Ю. |
|
|
|
|
Минск, 2001
ВВЕДЕНИЕ
Одним из сильнейших по действию и наиболее
распространенным химическим загрязнением является загрязнение тяжелыми
металлами.
К тяжелым металлам относятся более 40 химических
элементов периодической системы Д.И. Менделеева, масса атомов которых
составляет свыше 50 атомных единиц.
Эта группа элементов активно участвует в биологических
процессах, входя в состав многих ферментов. Группа "тяжелых металлов"
во многом совпадает с понятием "микроэлементы". Отсюда свинец, цинк,
кадмий, ртуть, молибден, хром, марганец, никель, олово, кобальт, титан, медь,
ванадий являются тяжелыми металлами.
Источники поступления тяжелых металлов делятся на
природные (выветривание горных пород и минералов, эрозийные процессы,
вулканическая деятельность) и техногенные (добыча и переработка полезных
ископаемых, сжигание топлива, движение транспорта, деятельность сельского
хозяйства). Часть техногенных выбросов, поступающих в природную среду в виде
тонких аэрозолей, переносится на значительные расстояния и вызывает глобальное
загрязнение.
Другая часть поступает в бессточные водоемы, где
тяжелые металлы накапливаются и становятся источником вторичного загрязнения,
т.е. образования опасных загрязнений в ходе физико-химических процессов, идущих
непосредственно в среде (например, образование из нетоксичных
веществ ядовитого газа фосгена).
Тяжелые
металлы накапливаются в почве, особенно в верхних гумусовых горизонтах, и
медленно удаляются при выщелачивании, потреблении растениями, эрозии и дефляции
- выдувании почв.
Период
полуудаления или удаления половины от начальной концентрации составляет
продолжительное время: для цинка - от 70 до 510 лет, для кадмия - от 13 до 110
лет, для меди - от 310 до 1500 лет и для свинца - от 740 до 5900 лет.
В
гумусовой части почвы происходит первичная трансформация попавших в нее
соединений.
Тяжелые
металлы обладают высокой способностью к многообразным химическим,
физико-химическим и биологическим реакциям. Многие из них имеют переменную
валентность и участвуют в окислительно-восстановительных процессах. Тяжелые
металлы и их соединения, как и другие химические соединения, способны
перемещаться и перераспределяться в средах жизни, т.е.
мигрировать.
Миграция
соединений тяжелых металлов происходит в значительной степени в виде органо-минеральной
составляющей. Часть органических соединений, с которыми связываются металлы,
представлена продуктами микробиологической деятельности. Ртуть характеризуется
способностью аккумулироваться в звеньях "пищевой цепи" (об этом шла
речь ранее). Микроорганизмы почвы могут давать устойчивые к ртути популяции,
которые превращают металлическую ртуть в токсические для высших организмов
вещества. Некоторые водоросли, грибы и бактерии способны аккумулировать ртуть в
клетках.
Ртуть,
свинец, кадмий входят в общий перечень наиболее важных загрязняющих веществ
окружающей среды, согласованный странами, входящими в ООН. Остановимся
подробнее на этих веществах.
§ 1.
РТУТЬ.
Кроме
свинца наиболее полно по сравнению с другими микроэлементами изучена ртуть.
Ртуть
крайне слабо распространена в земной коре (-0,1 х 10-4 %), однако
удобна для добычи, так как концентрируется в сульфидных остатках, например, в
виде киновари (НgS). В этом виде ртуть относительно безвредна, но
атмосферные процессы, вулканическая и человеческая деятельность привели к тому,
что в мировом океане накопилось около 50 млн.т этого металла. Естественный
вынос ртути в океан в результате эрозии 5000 т/год, еще 5000 т/год ртути
выносится в результате человеческой деятельности.
Первоначально
ртуть попадает в океан в виде Нg2+, затем
она взаимодействует с органическими веществами и с помощью анаэробных
организмов переходит в токсичные вещества метилртуть (СН3Нg)+
и диметилртуть (СН3-Нg-СН3),
Ртуть присутствует не только в
гидросфере, но и в атмосфере, так как имеет относительно высокое давление
паров. Природное содержание ртути составляет ~0,003-0,009 мкг/м3.
Ртуть характеризуется малым временем
пребывания в воде и быстро переходит в отложения в виде соединений с
органическими веществами, находящимися в них. Поскольку ртуть адсорбируется
отложениями, она может медленно освобождаться и растворяться в воде, что
приводит к образованию источника хронического загрязнения, действующего
длительное время после того, как исчезнет первоначальный источник загрязнения.
Мировое
производство ртути в настоящее время составляет более 10000 т в год, большая
часть этого количества используется в производстве хлора. Ртуть проникает в
воздух в результате сжигания ископаемого топлива. Анализ льда Гренландского
ледяного купола показал, что, начиная с 800 г. н.э. до 1950-х гг., содержание
ртути оставалось постоянным, но уже с 50-х гг. нашего столетия количество ртути
удвоилось. На рис.23 представлены пути цикловой миграции ртути.
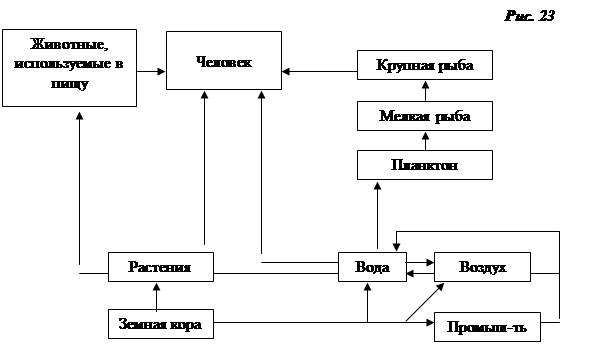
Ртуть
и ее соединения опасны для жизни. Метилртуть особенно опасна для животных и
человека, так как она быстро переходит из крови в мозговую ткань, разрушая
мозжечок и кору головного мозга. Клинические симптомы такого поражения -
оцепенение, потеря ориентации в пространстве, потеря зрения. Симптомы ртутного
отравления проявляются не сразу. Другим неприятным последствием отравления
метилртутью является проникновение ртути в плаценту и накапливание ее в плоде,
причем мать не испытывает при этом болезненных ощущений. Метилртуть
оказывает тератогенное воздействие на человека. Ртуть относится к I классу
опасности.
Металлическая
ртуть опасна, если ее проглотить и вдыхать ее пары. При этом у человека
появляется металлический вкус во рту, тошнота, рвота, колики в животе, зубы
чернеют и начинают крошиться. Пролитая ртуть разлетается на капельки и, если
это произошло, ртуть должна быть тщательно собрана.
Неорганические
соединения ртути практически нелетучи, поэтому опасность представляет попадание
ртути внутрь организма через рот и кожу. Соли ртути разъедают кожу и слизистые
оболочки тела. Попадание солей ртути внутрь организма вызывает воспаление зева,
затрудненное глотание, оцепенение, рвоту, боли в животе.
У
взрослого человека при попадании внутрь около 350 мг ртути может наступить
смерть.
Загрязнение ртутью может быть уменьшено в результате
запрещения производства и применения ряда продуктов. Нет сомнения, что
загрязнение ртутью всегда будет острой проблемой. Но с введением строгого
контроля за отходами производства, содержащими ртуть, а также за пищевыми
продуктами можно уменьшить опасность отравления ртутью.
§ 2.
СВИНЕЦ.
Содержание свинца в магматических породах позволяет
отнести его к категории редких металлов. Он концентрируется в сульфидных
породах, которые встречаются во многих местах в мире. Свинец легко выделить
путем выплавки из руды. В природном состоянии он обнаруживается в основном в
виде галенита (РbS).
Свинец, содержащийся в земной коре, может
вымываться под воздействием атмосферных процессов, переходя постепенно в
океаны. Ионы Рb 2+ довольно нестабильны, и содержание свинца в ионной
форме составляет всего 10 –8 %. Однако он накапливается в океанских
осадках в виде сульфитов или сульфатов. В пресной воде содержание свинца
гораздо выше и может достигать 2 х 10 –6 %, а в почве примерно такое
же количество, что и в земной коре (1,5 х 10 –3 %) из-за нестабильности
этого элемента в геохимическом цикле.
Свинцовые руды содержат 2-20 % свинца. Концентрат,
получаемый флотационным способом, содержит 60-80 % Рb. Его нагревают
для удаления серы и выплавляют свинец. Такие первичные процессы
крупномасштабны. Если же для получения свинца используют отходы, процессы
выплавки называют вторичными. Ежегодное мировое потребление свинца составляет
более 3 млн. т, из них 40 % используют для производства аккумуляторных батарей,
20% -для производства алкила свинца - присадки к бензину, 12% применяют в
строительстве, 28 % для других целей.
Ежегодно в мире в результате воздействия атмосферных
процессов мигрирует около 180 тыс. т свинца. При добыче и переработке
свинцовых руд теряется более 20 % свинца. Даже на этих стадиях выделение свинца
в среду обитания равно его количеству, попадающему в окружающую среду в
результате воздействия на магматические породы атмосферных процессов.
Наиболее серьезным источником загрязнения среды
обитания организмов свинцом являются выхлопы автомобильных двигателей. Антидетонатор
тетраметил - или тетраэтилсвинеп - прибавляют к большинству бензинов, начиная с
1923 г., в количестве около 80 мг/л. При движении автомобиля от 25 до 75% этого
свинца в зависимости от условий движения выбрасывается в атмосферу. Основная
его масса осаждается на землю, но и в воздухе остается заметная ее часть.
Свинцовая пыль не только покрывает обочины шоссейных
дорог и почву внутри и вокруг промышленных городов, она найдена и во льду
Северной Гренландии, причем в 1756 г. содержание свинца во льду
составляло 20 мкг/т, в 1860 г. уже 50 мкг/т, а в 1965 г. - 210 мкг/т.
Активными
источниками загрязнения свинцом являются электростанции и бытовые печи,
работающие на угле.
Источниками
загрязнения свинцом в быту могут быть глиняная посуда, покрытая глазурью;
свинец, содержащийся в красящих пигментах.
Свинец
не является жизненно необходимым элементом. Он токсичен и относится
к I классу опасности. Неорганические его соединения нарушают
обмен веществ и являются ингибиторами ферментов (подобно большинству тяжелых
металлов). Одним из наиболее коварных последствий действия неорганических
соединений свинца считается его способность заменять кальций в костях и быть
постоянным источником отравления в течение длительного времени. Биологический
период полураспада свинца в костях - около 10 лет. Количество свинца,
накопленного в костях, с возрастом увеличивается, и в 30-40 лет у лиц, по роду
занятий не связанных с загрязнением свинца, составляет 80-200 мг.
Органические
соединение свинца считаются ещё более токсичными, чем неорганические.
Главным
источником, из которого свинец попадает в организм человека, является пища,
наряду с эти важную роль играет вдыхаемый воздух, а у детей – и заглатываемая
ими свинецсодержащая пыль и краски. Вдыхаемая пыль примерно на 30-35 %
задерживается в легких, значительная доля её всасывается потоком крови.
Всасывания в желудочно-кишечном тракте составляют в целом 5-10 %, у детей – 50
%. Дефицит кальция и витамина Д усиливает всасывание свинца.
Острые
свинцовые отравления встречаются редко. Их симптомы – слюнотечение, рвота,
кишечные колики, острая форма отказа почек, поражение мозга. В тяжёлых случаях
– смерть через несколько дней.
Ранние
симптомы отравления свинцом проявляются в виде повышенной возбудимости,
депрессии и раздражительности. При отравлении органическими соединениями свинца
его повышенное содержание обнаруживают в крови.
Вследствие
глобального загрязнения окружающей среды свинцом он стал вездесущим компонентом
любой пищи и кормов. Растительные продукты в целом содержат больше свинца, чем
животные.
§ 3. КАМДИЙ И ЦИНК.
Камдий, цинк и медь являются наиболее важными
металлами при изучении проблемы загрязнений, так они широко распространены в
мире и обладают токсичными свойствами. Камдий и цинк (так же ка свинец и ртуть)
обнаружены в основном в сульфидных осадках. В результате атмосферных процессов
эти элементы легко попадают в океаны. В почвах содержится приблизительно
4,5х10 –4 %. Растительность содержит различное количество обоих элементов,
но содержание цинка в золе растений относительно высоко –0,14;, так как этот
элемент играет существенную роль в питании растений.
Около 1 млн. кг камдия попадает в атмосферу ежегодно в
результате деятельности заводов по его выплавке, что составляет около 45 %
общего загрязнения этим элементом. 52 % загрязнений попадают в
результате сжигания или переработки изделий, содержащих камдий. Камдий обладает
относительно высокой летучестью, поэтому он легко проникает в атмосферу.
Источники загрязнения атмосферы цинком те же, что и камдием.
Попадание камдия в природные воды происходит в
результате применения его в гальванических процессах и техники. Наиболее
серьёзные источники загрязнения воды цинком – заводы по выплавке цинка и
гальванические производства.
Потенциальным источником загрязнением камдием
являются удобрения. При этом камдий внедряется в растения, употребляемые
человеком в пищу, и в конце цепочки переходят в организм человека. Камдий и
цинк легко проникают в морскую воду и океан через сеть поверхностных и
грунтовых вод.
Камдий и цинк накапливаются в определённых органах
животных (особенно в печени и в почках).
Цинк наименее токсичен из всех вышеперечисленных
тяжёлых металлов. Тем не менее все элементы становятся токсичными, если
попадаются в избытке; цинк не является исключением. Физиологическое воздействие
цинка заключается в действии его как активатора ферментов. В больших
количествах он вызывает рвоту, эта доза составляет примерно 150 мг для
взрослого человека.
Камдий намного токсичнее цинка. Он и его соединения
относятся к I классу опасности. Он проникает в человеческий организм в
течение продолжительного периода. Вдыхание воздуха в течение 8 часов при
концентрации камдия 5 мг/м3 может привести к смерти.
При хроническом отравлении камдием в моче появляется
белок, повышается кровяное давление.
При исследовании присутствия камдия в продуктах
питания было выявлено, что выделения человеческого организма редко содержат
столько же камдия, сколько было поглощено. Единого мирового мнения относительно
приемлемого безопасного содержания камдия в пище сейчас нет.
Одним их эффективных путей предотвращения поступления
камдия и цинка в виде загрязнений состоит в введении контроля за содержанием
этих металлов в выбросах плавильных заводов и других промышленных предприятий.
Кроме металлов, рассмотренных ранее (ртуть, свинец,
камдий, цинк), имеются и другие токсичные элементы, попадание которых в среду
обитания организмов в результате деятельность людей вызывает серьёзное
беспокойство.
§ 4.
СУРЬМА, МЫШЬЯК, КОБАЛЬТ.
Сурьма
присутствует вместе с мышьяком в рудах, содержащих сульфиды металлов. Мировое
производство сурьмы составляет около 70 т в год. Сурьма является компонентом
сплавов, используется в производстве спичек, в чистом виде применяется в
полупроводниках.
Токсическое действие сурьмы подобно мышьяку. Большие
количества сурьмы вызывают рвоту, при хроническом отравлении сурьмой наступает
расстройство пищеварительного тракта, сопровождаемое рвотой и понижением
температуры.
Мышьяк в
природе присутствует в виде сульфатов. Его содержание в свинцово-цинковых
концентратах около 1 %. Вследствие летучести он легко попадает в атмосферу.
Самыми сильными источниками загрязнения этим металлом
являются гербициды (химические вещества для борьбы с сорными растениями),
фунгициды (вещества для борьбы с грибными болезнями растений) и инсектициды
(вещества для борьбы с вредными насекомыми).
По токсическим свойствам мышьяк относится к
накапливающимся ядам. По степени токсичности следует различать элементарный
мышьяк и его соединения. Элементарный мышьяк сравнительно мало ядовит, но
обладает тератогенными свойствами. Вредное воздействие на наследственный
материал (мутагенность) оспаривается.
Соединения мышьяка медленно поглощаются через кожу,
быстро всасываются через лёгкие и желудочно-кишечный тракт. Смертельная доза
для человека – 0,15-0,3 г.
Хроническое отравление вызывает нервные заболевания,
слабость, онемение конечностей, зуд, потемнение кожи, атрофию костного мозга,
изменения печени. Соединения мышьяка являются канцерогенными для человека.
Мышьяк и его соединения относятся ко II классу
опасности.
Кобальт не
является широко применяемым. Так, например, его используют в сталелитейной
промышленности, в производстве полимеров. При попадании внутрь больших
количеств кобальт отрицательно влияет на содержание гемоглобина в крови
человека и может вызвать заболевания крови. Предполагают, что кобальт вызывает
базедову болезнь. Этот элемент опасен для жизни организмов ввиду его
чрезвычайно высокой реакционной способности и относится к I
классу опасности.
§ 5. МЕДЬ
И МАРГАНЕЦ.
Медь
обнаруживают в сульфидных осадках вместе со свинцом, камдием и цинком. Она
присутствует в небольших количествах в цинковых концентратах и может
переноситься на большие расстояния с воздухом и водой. Аномальное содержание
меди обнаруживается в растениях с воздухом и водой. Аномальное содержание меди
обнаруживается в растениях и почвах на расстоянии более 8 км от плавильного
завода. Соли меди относятся ко II классу опасности. Токсические свойства меди изучены
гораздо меньше, чем те же свойства других элементов. Поглощение больших
количеств меди человеком приводит к болезни Вильсона, при этом избыток меди
откладывается в мозговой ткани, коже, печени, поджелудочной железе.
Природное содержание марганца в растениях,
животных и почвах очень высоко. Основные области производства марганца –
производство легированных сталей, сплавов, электрических батарей и других
химических источников тока. Присутствие марганца в воздухе сверх нормы
(среднесуточная ПКД марганца в атмосфере – воздухе населённых мест – составляет
0,01 мг/м3) вредно влияет на организм человека, что выражается в
прогрессирующем разрушении центральной нервной системы. Марганец относится
ко II классу
опасности.
|