Курсовая работа: Применение радиоактивных изотопов в технике
Курсовая работа: Применение радиоактивных изотопов в технике
Курсовая работа
На тему: "Радиоактивность.
Применение радиоактивных
изотопов в технике"
Содержание
Введение
1.Виды радиоактивных
излучений
2.Другие виды
радиоактивности
3.Альфа-распад
4.Бета-распад
5.Гамма-распад
6.Закон радиоактивного
распада
7.Радиоактивные ряды
8.Действие радиоактивного
излучения на человека
9.Применение
радиоактивных изотопов
Список использованной
литературы
Введение
Радиоактивность
–
превращение атомных ядер в другие ядра, сопровождающееся испусканием различных
частиц и электромагнитного излучения. Отсюда и название явления: на латыни
radio – излучаю, activus – действенный. Это слово ввела Мария Кюри. При распаде
нестабильного ядра – радионуклида из него вылетают с большой скоростью одна или
несколько частиц высокой энергии. Поток этих частиц называют радиоактивным
излучением или попросту радиацией.
Лучи Рентгена. Открытие радиоактивности было
непосредственно связано с открытием Рентгена. Более того, некоторое время
думали, что это один и тот же вид излучения. Конец 19 в. вообще был богат на
открытие различного рода не известных до того «излучений». В 1880-е английский
физик Джозеф Джон Томсон приступил к изучению элементарных носителей
отрицательного заряда, в 1891 ирландский физик Джордж Джонстон Стони
(1826–1911) назвал эти частицы электронами. Наконец, в декабре Вильгельм Конрад
Рентген сообщил об открытии нового вида лучей, которые он назвал Х-лучами. До
сих пор в большинстве стран они так и называются, но в Германии и России
принято предложение немецкого биолога Рудольфа Альберта фон Кёлликера
(1817–1905) называть лучи рентгеновскими. Эти лучи возникают, когда быстро
летящие в вакууме электроны (катодные лучи) сталкиваются с препятствием. Было
известно, что при попадании катодных лучей на стекло, оно испускает видимый
свет – зеленую люминесценцию. Рентген обнаружил, что одновременно от зеленого
пятна на стекле исходят какие-то другие невидимые лучи. Это произошло случайно:
то в темной комнате светился находящийся неподалеку экран, покрытый тетрацианоплатинатом
бария Ba[Pt(CN)4] (раньше его называли платиносинеродистым барием).
Это вещество дает яркую желто-зеленую люминесценцию под действием
ультрафиолетовых, а также катодных лучей. Но катодные лучи на экран не
попадали, и более того, когда прибор был закрыт черной бумагой, экран продолжал
светиться. Вскоре Рентген обнаружил, что излучение проходит через многие
непрозрачные вещества, вызывает почернение фотопластинки, завернутой в черную
бумагу или даже помещенной в металлический футляр. Лучи проходили через очень
толстую книгу, через еловую доску толщиной 3 см, через алюминиевую пластину толщиной 1,5 см... Рентген понял возможности своего открытия: «Если держать руку
между разрядной трубкой и экраном, – писал он, – то видны темные тени костей на
фоне более светлых очертаний руки». Это было первое в истории
рентгеноскопическое исследование.
Открытие
Рентгена мгновенно облетело весь мир и поразило не только специалистов. В канун
1896 в книжном магазине одного немецкого города была выставлена фотография
кисти руки. На ней были видны кости живого человека, а на одном из пальцев –
обручальное кольцо. Это была снятая в рентгеновских лучах фотография кисти жены
Рентгена. Первое сообщение Рентгена “О новом роде лучей” было
опубликовано в «Отчетах Вюрцбургского физико-медицинского общества» 28 декабря
оно было немедленно переведено и опубликовано в разных странах, выходящий в
Лондоне самый известный научный журнал «Nature» («Природа») опубликовал статью
Рентгена 23 января 1896.
Новые
лучи стали исследовать во всем мире, только за один год на эту тему было
опубликовано свыше тысячи работ. Несложные по конструкции рентгеновские
аппараты появились и в госпиталях: медицинское применение новых лучей было
очевидным.
Сейчас
рентгеновские лучи широко используются (и не только в медицинских целях) во
всем мире.
Лучи Беккереля. Открытие Рентгена вскоре
привело к не менее выдающемуся открытию. Его сделал в 1896 французский физик Антуан
Анри Беккерель. Он был 20 января 1896 на заседании Академии, на котором физик и
философ Анри Пуанкаре рассказал об открытии Рентгена и продемонстрировал
сделанные уже во Франции рентгеновские снимки руки человека. Пуанкаре не
ограничился рассказом о новых лучах. Он высказал предположение, что эти лучи
связаны с люминесценцией и, возможно, всегда возникают одновременно с этим
видом свечения, так что, вероятно, можно обойтись и без катодных лучей.
Свечение веществ под действием ультрафиолета – флуоресценция или фосфоресценция
(в 19 в. не было строгого разграничения этих понятий) было знакомо Беккерелю:
ею занимались и его отец Александр Эдмонд Беккерель (1820–1891), и дед Антуан Сезар
Беккерель (1788–1878) – оба физики; физиком стал и сын Антуана Анри Беккереля –
Жак, который «по наследству» принял кафедру физики при парижском Музее
естественной истории, эту кафедру Беккерели возглавляли 110 лет, с 1838 по
1948.
Беккерель
решил проверить, связаны ли лучи Рентгена с флуоресценцией. Яркой желто-зеленой
флуоресценцией обладают некоторые соли урана, например, уранилнитрат UO2(NO3)2.
Такие вещества были в лаборатории Беккереля, где работал. С препаратами урана
работал еще его отец, который показал, что после прекращения действия
солнечного света их свечение исчезает очень быстро – менее чем за сотую долю
секунды. Однако никто не проверял, сопровождается ли это свечение испусканием
каких-то других лучей, способных проходить сквозь непрозрачные материалы, как
это было у Рентгена. Именно это после доклада Пуанкаре решил проверить
Беккерель. 24 февраля 1896 на еженедельном заседании Академии он рассказал, что
беря фотопластинку, завернутую в два слоя плотной черной бумаги, кладя на нее
кристаллы двойного сульфата калия-уранила K2UO2(SO4)2·2H2O
и выставляя все это на несколько часов на солнечный свет, то после проявления
фотопластинки на ней можно видеть несколько размытый контур кристаллов. Если
между пластинкой и кристаллами поместить монету или вырезанную из жести фигуру,
то после проявления на пластинке появляется четкое изображение этих предметов.
Все
это могло свидетельствовать о связи флуоресценции и рентгеновского излучения.
Недавно открытые Х-лучи можно получать намного проще – без катодных лучей и
необходимых для этого вакуумной трубки и высокого напряжения, но надо было
проверить, не оказывается ли, что урановая соль, нагреваясь на солнце, выделяет
какой-то газ, который проникает под черную бумагу и действует на фотоэмульсию
Чтобы исключить эту возможность, Беккерель проложил между урановой солью и
фотопластинкой лист стекла – она все равно засветилась. «Отсюда, – заключил
свое краткое сообщение Беккерель, – можно сделать вывод о том, что светящаяся
соль испускает лучи, которые проникают через не прозрачную для света черную
бумагу и восстанавливают серебряные соли в фотопластинке». Как будто Пуанкаре
оказался прав и Х-лучи Рентгена можно получить совсем другим способом.
Беккерель
начал ставить множество опытов, чтобы лучше понять условия, при которых
появляются лучи, засвечивающие фотопластинку, и исследовать свойства этих
лучей. Он помещал между кристаллами и фотопластинкой разные вещества – бумагу,
стекло, пластинки алюминия, меди, свинца разной толщины. Результаты получались
те же, что и у Рентгена, что также могло служить доводом в пользу сходства
обоих излучений. Помимо прямого солнечного света Беккерель освещал соль урана
светом, отраженным зеркалом или преломленным призмой. Он получил, что
результаты всех прежних опытов никак не были связаны с солнцем; имело значение
лишь то, как долго урановая соль находилась вблизи фотопластинки. На следующий
день Беккерель доложил об этом на заседании Академии, но вывод он, как потом
выяснилось, сделал неверный: он решил, что соль урана, хотя бы раз «заряженная»
на свету, способна потом сама длительное время испускать невидимые проникающие
лучи.
Беккерель
до конца года он опубликовал на эту тему девять статей, в одной из них он
писал: «Разные соли урана были помещены в толстостенный свинцовый ящик...
Защищенные от действия любых известных излучений, эти вещества продолжали
испускать лучи, проходящие через стекло и черную бумагу..., через восемь
месяцев».
Эти
лучи исходили от любых соединений урана, даже от тех, которые не светятся на
солнце. Еще более сильным (примерно в 3,5 раза) оказалось излучение
металлического урана. Стало очевидным, что излучение хотя и похоже по некоторым
проявлениям на рентгеновское, но обладает большей проникающей способностью и
как-то связано с ураном, так что Беккерель стал называть его «урановыми
лучами».
Беккерель
обнаружил также, что «урановые лучи» ионизируют воздух, делая его проводником
электричества. Практически одновременно, в ноябре 1896, английские физики Дж.
Дж.Томсон и Эрнест Резерфорд (обнаружили ионизацию воздуха и под действием
рентгеновских лучей. Для измерения интенсивности излучения Беккерель
использовал электроскоп, в котором легчайшие золотые листочки, подвешенные за
концы и заряженные электростатически, отталкиваются и их свободные концы
расходятся. Если воздух проводит ток, заряд с листочков стекает и они опадают –
тем быстрее, чем выше электропроводность воздуха и, следовательно, больше
интенсивность излучения.
Оставался
вопрос, каким образом вещество испускает непрерывное и не ослабевающее в
течение многих месяцев излучение без подвода энергии от внешнего источника Сам
Беккерель писал, что не в состоянии понять, откуда уран получает энергию,
которую он непрерывно излучает. По этому поводу выдвигались самые разные
гипотезы, иногда довольно фантастические. Например, английский химик и физик Уильям
Рамзай писал: «… физики недоумевали, откуда мог бы взяться неисчерпаемый запас
энергии в солях урана. Лорд Кельвин склонялся к предположению, что уран служит
своего рода западней, которая улавливает ничем другим не обнаруживаемую
лучистую энергию, доходящую до нас через пространство, и превращает ее в такую
форму, в виде которой она делается способной производить химические действия».
Беккерель
не мог ни принять эту гипотезу, ни придумать что-то более правдоподобное, ни
отказаться от принципа сохранения энергии. Кончилось тем, что он вообще на некоторое
время бросил работу с ураном и занялся расщеплением спектральных линий в
магнитном поле. Этот эффект был обнаружен почти одновременно с открытием
Беккереля молодым голландским физиком Питером Зееманом и объяснен другим
голландцем – Хендриком Антоном Лоренцем.
На
этом закончился первый этап исследования радиоактивности. Альберт Эйнштейн
сравнил открытие радиоактивности с открытием огня, так как считал, что и огонь
и радиоактивность – одинаково крупные вехи в истории цивилизации.
1.
Виды радиоактивных излучений
Когда в руках
исследователей появились мощные источники радиации, в миллионы раз более
сильные, чем уран (это были препараты радия, полония, актиния), можно было
более подробно ознакомиться со свойствами радиоактивного излучения. В первых
исследованиях на эту тему самое активное участие приняли Эрнест Резерфорд
супруги Мария и Пьер Кюри, А.Беккерель, многие другие. Прежде всего, была
изучена проникающая способность лучей, а также действие на излучение магнитного
поля. Оказалось, что излучение неоднородно, а представляет собой смесь «лучей».
Пьер Кюри обнаружил, что при действии магнитного поля на излучение радия одни
лучи отклоняются, а другие нет. Было известно, что магнитное поле отклоняет
только заряженные летящие частицы, причем положительные и отрицательные в
разные стороны. По направлению отклонения убедились в том, что отклоняемые β-лучи
заряжены отрицательно. Дальнейшие опыты показали, что между катодными и β-лучами
нет принципиальной разницы, откуда следовало, что они представляют собой поток
электронов.
Отклоняющиеся
лучи обладали более сильной способностью проникать через различные материалы,
тогда как неотклоняющиеся легко поглощались даже тонкой алюминиевой фольгой –
так вело себя, например, излучение нового элемента полония – его излучение не
проникало даже сквозь картонные стенки коробки, в которой хранился препарат.
При
использовании более сильных магнитов оказалось, что α-лучи тоже
отклоняются, только значительно слабее, чем β-лучи, причем в другую
сторону. Отсюда следовало, что они заряжены положительно и имеют значительно бóльшую
массу (как потом выяснили, масса α-частиц в 7740 раз больше массы
электрона). Впервые это явление обнаружили в 1899 А.Беккерель и Ф.Гизель. В
дальнейшем выяснилось, что α-частицы представляют собой ядра атомов гелия
(нуклид 4Не) с зарядом +2 и массой 4 у.е.. Когда же в 1900
французский физик Поль Вийар (1860–1934) исследовал более подробно отклонение α-
и β-лучей, он обнаружил в излучении радия и третий вид лучей, не
отклоняющихся в самых сильных магнитных полях, это открытие вскоре подтвердил и
Беккерель. Этот вид излучения, по аналогии с альфа- и бета-лучами, был назван
гамма-лучами, обозначение разных излучений первыми буквами греческого алфавита
предложил Резерфорд. Гамма-лучи оказались сходными с лучами Рентгена, т.е. они
представляют собой электромагнитное излучение, но с более короткими длинами
волн и соответственно с большей энергией. Все эти виды радиации описала М.Кюри в
своей монографии «Радий и радиоактивность». Вместо магнитного поля для
«расщепления» радиации можно использовать электрическое поле, только заряженные
частицы в нем будут отклоняться не перпендикулярно силовым линиям, а вдоль них
– по направлению к отклоняющим пластинам.
Долгое
время было неясно, откуда берутся все эти лучи. В течение нескольких
десятилетий трудами многих физиков была выяснена природа радиоактивного
излучения и его свойства, были открыты новые типы радиоактивности.γ
Альфа-лучи
испускают, главным образом, ядра самых тяжелых и потому менее стабильных атомов
(в периодической таблице они расположены после свинца). Эти высокоэнергетичные
частицы. Обычно наблюдается несколько групп α -частиц, каждая из которых
имеет строго определенную энергию. Так, почти все α -частицы, вылетающие
из ядер 226Ra, обладают энергией в 4,78 МэВ (мегаэлектрон-вольт) и
небольшая доля α -частиц энергией в 4,60 МэВ. Другой изотоп радия – 221Ra
испускает четыре группы α -частиц с энергиями 6,76, 6,67, 6,61 и 6,59 МэВ.
Это свидетельствует о наличии в ядрах нескольких энергетических уровней, их
разность соответствует энергии излучаемых ядром α -квантов. Известны и
«чистые» альфа-излучатели (например, 222Rn).
По
формуле E = mu2/2 можно подсчитать скорость α-частиц
с определенной энергией. Например, 1 моль α -частиц с Е = 4,78 МэВ
имеет энергию (в единицах СИ) Е = 4,78·106 эВ 96500
Дж/(эВ·моль) = 4,61·1011 Дж/моль и массу m = 0,004 кг/моль,
откуда u α 15200 км/с, что в десятки тысяч раз больше скорости
пистолетной пули. Альфа-частицы обладают самым сильным ионизирующим действием:
сталкиваясь с любыми другими атомами в газе, жидкости или твердом теле, они
«обдирают» с них электроны, создавая заряженные частицы. При этом α-частицы
очень быстро теряют энергию: они задерживаются даже листом бумаги. В воздухе α-излучение
радия проходит всего 3,3 см, α -излучение тория – 2,6 см и т.д. В конечном счете потерявшая кинетическую энергию α-частица захватывает два
электрона и превращается в атом гелия. Первый потенциал ионизации атома гелия
(He – e → He+) составляет 24,6 эВ, второй (He+ – e →
He+2) – 54,4 эВ, это намного больше, чем у любых других атомов. При
захвате электронов α-частицами выделяется огромная энергия (более 7600
кДж/моль), поэтому ни один атом, кроме атомов самого гелия, не в состоянии
удержать свои электроны, если по соседству окажется α -частица.
Очень
большая кинетическая энергия α -частиц позволяет «увидеть» их
невооруженным глазом (или с помощью обычной лупы), впервые это
продемонстрировал в 1903 английский физик и химик Уильям Крукс (1832 – 1919. Он
приклеил на кончик иглы еле видимую глазом крупинку радиевой соли и укрепил
иглу в широкой стеклянной трубке. На одном конце этой трубки, недалеко от
кончика иглы, помещалась пластинка, покрытая слоем люминофора (им служил
сульфид цинка), а на другом конце было увеличительное стекло. Если в темноте
рассматривать люминофор, то видно: все поле зрения усеяно вспыхивающими и
сейчас же гаснущими искрами. Каждая искра – это результат удара одной α -частицы.
Крукс назвал этот прибор спинтарископом (от греч. spintharis – искра и skopeo –
смотрю, наблюдаю). С помощью этого простого метода подсчета α -частиц был
выполнен ряд исследований, например, этим способом можно было довольно точно
определить постоянную Авогадро.
В
ядре протоны и нейтроны удерживаются вместе ядерными силами, Поэтому было
непонятно, каким образом альфа-частица, состоящая из двух протонов и двух
нейтронов, может покинуть ядро. Ответ дал в 1928 американский физик
(эмигрировавший в 1933 из СССР) Джордж (Георгий Антонович) Гамов). По
законам квантовой механики α -частицы, как и любые частицы малой массы,
обладают волновой природой и потому у них есть некоторая небольшая вероятность
оказаться вне ядра, на небольшом (примерно 6·10–12 см)
расстоянии от него. Как только это происходит, на частицу начинает действовать
с кулоновское отталкивание от очень близко находящегося положительно
заряженного ядра.
Альфа-распаду
подвержены, в основном, тяжелые ядра – их известно более 200, α-частицы
испускаются большинством изотопов элементов, следующих за висмутом. Известны ти
более легкие альфа-излучатели, в основном, это атомы редкоземельных элементов.
Но почему из ядра вылетают именно альфа-частицы, а не отдельные протоны?
Качественно это объясняется энергетическим выигрышем при α-распаде (α-частицы
– ядра гелия устойчивы). Количественная же теория α-распада была создана
лишь в 1980-х, в ее разработке принимали участие и отечественные физики,в их
числе Лев Давидович Ландау, Аркадий Бейнусович Мигдал (1911–1991), заведующий
кафедрой ядерной физики Воронежского университета Станислав Георгиевич
Кадменский с сотрудниками.
Вылет
из ядра α-частицы приводит к ядру другого химического элемента, который
смещен в периодической таблице на две клетки влево. В качестве примера можно
привести превращения семи изотопов полония (заряд ядра 84) в разные изотопы
свинца (заряд ядра 82): 218Po → 214Pb, 214Po
→ 210Pb, 210Po → 206Pb, 211Po
→ 207Pb, 215Po →211Pb, 212Po
→ 208Pb, 216Po → 212Pb. Изотопы
свинца 206Pb 207Pb и 208Pb стабильны,
остальные радиоактивны.
Бета-распад
наблюдается как у тяжелых, так и у легких ядер, например, у трития. Эти легкие
частицы (быстрые электроны) обладают более высокой проникающей способностью.
Так, в воздухе β -частицы могут пролететь несколько десятков сантиметров,
в жидких и твердых веществах – от долей миллиметра до примерно 1 см. В отличие от α-частиц, энергетический спектр β -лучей не дискретный. Энергия
вылетающих из ядра электронов может меняться почти от нуля до некоторого
максимального значения, характерного для данного радионуклида. Обычно средняя
энергия β -частиц намного меньше, чем у α -частиц; например, энергия β
-излучения 228Ra составляет 0,04 МэВ. Но бывают и исключения; так β
-излучение короткоживущего нуклида 11Ве несет энергию 11,5 МэВ.
Долго было неясно, каким образом из одинаковых атомов одного и того же элемента
вылетают частицы с разной скоростью. Когда же стало известно понятно строение
атома и атомного ядра, появилась новая загадка: откуда вообще берутся
вылетающие из ядра β -частицы – ведь в ядре никаких электронов нет. После
того как в 1932 английский физик Джеймс Чедвиком открыл нейтрон, отечественные
физики Дмитрий Дмитриевич Иваненко (1904–1994) и Игорь Евгеньевич Тамм и
независимо немецкий физик Вернер Гейзенберг предположили, что атомные ядра
состоят из протонов и нейтронов. В таком случае β -частицы должны
образоваться в результате внутриядерного процесса превращения нейтрона в протон
и электрон: n → p + e. Масса нейтрона немного превышает суммарную массу
протона и электрона, избыток массы, в соответствии с формулой Эйнштейна E
= mc2, дает кинетическую энергию вылетающего из ядра
электрона, поэтому β -распад наблюдается, в основном, у ядер с избыточным
числом нейтронов. Например, нуклид 226Ra – α-излучатель, а все
более тяжелые изотопы радия (227Ra, 228Ra, 229Ra
и 230Ra) – β -излучатели.
Оставалось
выяснить, почему β-частицы, в отличие от α -частиц, имеют сплошной
спектр энергии, это означало, что одни из них обладают очень малой энергией, а
другие – очень большой (и при этом движутся со скоростью, близкую к скорости
света). Более того, суммарная энергия всех этих электронов (она была измерена с
помощью калориметра) оказалась меньше, чем разность энергии исходного ядра и
продукта его распада. Снова физики с толкнулись с «нарушением» закона
сохранения энергии: часть энергии исходного ядра непонятно куда исчезала.
Незыблемый физический закон «спас» в 1931 швейцарский физик Вольфганг Паули,
который предположил, что при β-распаде из ядра вылетают две частицы:
электрон и гипотетическая нейтральная частица – нейтрино с почти нулевой
массой, которая и уносит избыток энергии. Непрерывный спектр β -излучения
объясняется распределением энергии между электронами и этой частицей. Нейтрино
(как потом оказалось, при β-распаде образуется так называемое электронное
антинейтрино 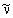 ) очень слабо взаимодействует с
веществом (например, легко пронзает по диаметру земной шар и даже огромную
звезду) и потому долго не обнаруживалось – экспериментально свободные нейтрино
были зарегистрированы только в 1956 г. Таким образом, уточненная схема
бета-распада такова: n → p + ) очень слабо взаимодействует с
веществом (например, легко пронзает по диаметру земной шар и даже огромную
звезду) и потому долго не обнаруживалось – экспериментально свободные нейтрино
были зарегистрированы только в 1956 г. Таким образом, уточненная схема
бета-распада такова: n → p +  . Количественную теорию β-распада
на основе представлений Паули о нейтрино разработал в 1933 итальянский физик Энрико
Ферми, он же предложил название нейтрино (по-итальянски «нейтрончик»). . Количественную теорию β-распада
на основе представлений Паули о нейтрино разработал в 1933 итальянский физик Энрико
Ферми, он же предложил название нейтрино (по-итальянски «нейтрончик»).
Превращение
нейтрона в протон при β-распаде практически не изменяет массу нуклида, но
увеличивает заряд ядра на единицу. Следовательно, образуется новый элемент,
смещенный в периодической таблице на одну клетку вправо, например: 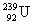 → → 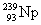 , , 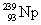 → →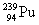 , , 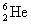 → → 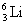 и т.д.
(одновременно из ядра вылетают электрон и антинейтрино). и т.д.
(одновременно из ядра вылетают электрон и антинейтрино).
2.
Другие виды радиоактивности
Помимо
альфа- и бета-распадов, известны и другие типы самопроизвольных радиоактивных
превращений. В 1938 американский физик Луис Уолтер Альварес открыл третий тип
радиоактивного превращения – электронный захват (К-захват). В этом случае ядро
захватывает электрон с ближайшей к нему энергетической оболочки (К-оболочки).
При взаимодействии электрона с протоном образуется нейтрон, а из ядра вылетает
нейтрино, уносящее избыток энергии. Превращение протона в нейтрон не изменяет
массу нуклида, но уменьшает заряд ядра на единицу. Следовательно, образуется
новый элемент, находящийся в периодической таблице на одну клетку левее,
например, из 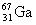 получается стабильный нуклид получается стабильный нуклид 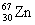 (именно на этом
примере Альварес открыл этот тип радиоактивности). (именно на этом
примере Альварес открыл этот тип радиоактивности).
При
К-захвате в электронной оболочке атома на место исчезнувшего электрона
«спускается» электрон с более высокого энергетического уровня, излишек энергии
либо выделяется в виде рентгеновского излучения, либо расходуется на вылет из
атома более слабо связанных одного или нескольких электронов – так называемых
оже-электронов, по имени французского физика Пьера Оже (1899–1993), открывшего
этот эффект в 1923 (для выбивания внутренних электронов он использовал
ионизирующее излучение).
В
1940 Георгий Николаевич Флеров (1913–1990) и Константин Антонович Петржак
(1907–1998) на примере урана открыли самопроизвольное (спонтанное) деление, при
котором нестабильное ядро распадается на два более легких ядра, массы которых
различаются не очень сильно, например: 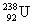 → → 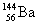 + + 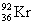 + 2n. Этот тип распада наблюдается
только у урана и более тяжелых элементов – всего более чем у 50 нуклидов. В
случае урана спонтанное деление происходит очень медленно: среднее время жизни
атома 238U составляет 6,5 миллиарда лет. В 1938 немецкий физик и
химик Отто Ган, австрийский радиохимик и физик Лизе Мейтнер (в ее честь назван
элемент Mt – мейтнерий) и немецкий физикохимик Фриц Штрассман (1902–1980)
обнаружили, что при бомбардировке нейтронами ядра урана делятся на осколки,
причем вылетевшие из ядер нейтроны способны вызвать деление соседних ядер
урана, что приводит к цепной реакции). Этот процесс сопровождается выделением
огромной (по сравнению с химическими реакциями) энергии, что привело к созданию
ядерного оружия и строительству АЭС. + 2n. Этот тип распада наблюдается
только у урана и более тяжелых элементов – всего более чем у 50 нуклидов. В
случае урана спонтанное деление происходит очень медленно: среднее время жизни
атома 238U составляет 6,5 миллиарда лет. В 1938 немецкий физик и
химик Отто Ган, австрийский радиохимик и физик Лизе Мейтнер (в ее честь назван
элемент Mt – мейтнерий) и немецкий физикохимик Фриц Штрассман (1902–1980)
обнаружили, что при бомбардировке нейтронами ядра урана делятся на осколки,
причем вылетевшие из ядер нейтроны способны вызвать деление соседних ядер
урана, что приводит к цепной реакции). Этот процесс сопровождается выделением
огромной (по сравнению с химическими реакциями) энергии, что привело к созданию
ядерного оружия и строительству АЭС.
В
1934 дочь Марии Кюри Ирэн Жолио-Кюри и ее муж Фредерик Жолио-Кюри открыли
позитронный распад. В этом процессе один из протонов ядра превращается в
нейтрон и антиэлектрон (позитрон) – частицу с той же массой, но положительно
заряженную; одновременно из ядра вылетает нейтрино: p → n + e+
+ 238. Масса ядра при этом не изменяется, а смещение происходит, отличие от β–-распада,
влево, β+-распад характерен для ядер с избытком протонов (так называемые
нейтронодефицитные ядра). Так, тяжелые изотопы кислорода 19О, 20О
и 21О β–-активны, а его легкие изотопы 14О
и 15О β+ - активны, например: 14O → 14N
+ e+ + 238. Как античастицы, позитроны сразу же уничтожаются
(аннигилируют) при встрече с электронами с образованием двух γ-квантов.
Позитронный распад часто конкурирует с К-захватом.
В
1982 была открыта протонная радиоактивность: испускание ядром протона (это
возможно лишь для некоторых искусственно полученных ядер, обладающих избыточной
энергией). В 1960 физико-химик Виталий Иосифович Гольданский (1923–2001)
теоретически предсказал двухпротонную радиоактивность: выбрасывание ядром двух
протонов со спаренными спинами. Впервые она наблюдалась в 1970. Очень редко
наблюдается и двухнейтронная радиоактивность (обнаружена в 1979).
В
1984 была открыта кластерная радиоактивность (от англ. cluster – гроздь, рой).
При этом, в отличие от спонтанного деления, ядро распадается на осколки с
сильно отличающимися массами, например, из тяжелого ядра вылетают ядра с
массами от 14 до 34. Кластерный распад также наблюдается очень редко, и это в
течение длительного времени затрудняло его обнаружение.
Некоторые
ядра способны распадаться по разным направлениям. Например, 221Rn на
80% распадается с испусканием α-частиц и на 20% – β-частиц, многие
изотопы редкоземельных элементов (137Pr, 141Nd, 141Pm,
142Sm и др.) распадаются либо путем электронного захвата, либо с
испусканием позитрона. Различные виды радиоактивных излучений часто (но не
всегда) сопровождаются γ-излучением. Происходит это потому, что
образующееся ядро может обладать избыточной энергией, от которой оно
освобождается путем испускания гамма-квантов. Энергия γ-излучения лежит в
широких пределах, так, при распаде 226Ra она равна 0,186 МэВ, а при
распаде 11Ве достигает 8 МэВ.
Почти
90% из известных 2500 атомных ядер нестабильны. Нестабильное ядро
самопроизвольно превращается в другие ядра с испусканием частиц. Это свойство
ядер называется радиоактивностью. У больших ядер
нестабильность возникает вследствие конкуренции между притяжением нуклонов
ядерными силами и кулоновским отталкиванием протонов. Не существует стабильных
ядер с зарядовым числом Z > 83 и массовым
числом A > 209. Но радиоактивными могут
оказаться и ядра атомов с существенно меньшими значениями чисел Z
и A. Если ядро содержит значительно больше протонов, чем
нейтронов, то нестабильность обуславливается избытком энергии кулоновского
взаимодействия. Ядра, которые содержали бы большой избыток нейтронов над числом
протонов, оказываются нестабильными вследствие того, что масса нейтрона
превышает массу протона. Увеличение массы ядра приводит к увеличению его
энергии.
Явление
радиоактивности было открыто в 1896 году французским физиком
А. Беккерелем, который обнаружил, что соли урана испускают неизвестное
излучение, способное проникать через непрозрачные для света преграды и вызывать
почернение фотоэмульсии. Через два года французские физики М. и П. Кюри
обнаружили радиоактивность тория и открыли два новых радиоактивных элемента –
полоний 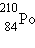 и
радий и
радий 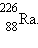
В
последующие годы исследованием природы радиоактивных излучений занимались
многие физики, в том числе Э. Резерфорд и его ученики. Было выяснено, что
радиоактивные ядра могут испускать частицы трех видов: положительно и
отрицательно заряженные и нейтральные. Эти три вида излучений были названы α-,
β- и γ-излучениями. Эти три вида радиоактивных излучений сильно
отличаются друг от друга по способности ионизировать атомы вещества и,
следовательно, по проникающей способности. Наименьшей проникающей способностью
обладает α-излучение. В воздухе при нормальных условиях α-лучи
проходят путь в несколько сантиметров. β-лучи гораздо меньше поглощаются
веществом. Они способны пройти через слой алюминия толщиной в несколько
миллиметров. Наибольшей проникающей способностью обладают γ-лучи, способные
проходить через слой свинца толщиной 5–10 см.
Во
втором десятилетии XX века после открытия Э. Резерфордом ядерного
строения атомов было твердо установлено, что радиоактивность – это свойство атомных ядер. Исследования показали, что α-лучи
представляют поток α-частиц – ядер гелия, β-лучи – это поток
электронов, γ-лучи представляют собой коротковолновое электромагнитное
излучение с чрезвычайно малой длиной волны λ < 10–10 м
и вследствие этого – ярко выраженными корпускулярными свойствами, т.е. является
потоком частиц – γ-квантов.
3.
Альфа-распад
Альфа-распадом
называется самопроизвольное превращение атомного ядра с числом протонов Z и нейтронов N в другое (дочернее) ядро,
содержащее число протонов Z – 2 и нейтронов N – 2. При этом испускается α-частица – ядро
атома гелия 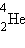 .
Примером такого процесса может служить α-распад радия: .
Примером такого процесса может служить α-распад радия: 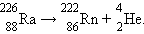 Альфа-частицы,
испускаемые ядрами атомов радия, использовались Резерфордом в опытах по
рассеянию на ядрах тяжелых элементов. Скорость α-частиц, испускаемых при α-распаде
ядер радия, измеренная по кривизне траектории в магнитном поле, приблизительно
равна 1,5·107 м/с, а соответствующая кинетическая энергия около
7,5·10–13 Дж (приблизительно 4,8 МэВ). Эта величина легко
может быть определена по известным значениям масс материнского и дочернего ядер
и ядра гелия. Хотя скорость вылетающей α-частицы огромна, но она все же
составляет только 5% от скорости света, поэтому при расчете можно пользоваться
нерелятивистским выражением для кинетической энергии. Исследования показали,
что радиоактивное вещество может испускать α-частицы с несколькими
дискретными значениями энергий. Это объясняется тем, что ядра могут находиться,
подобно атомам, в разных возбужденных состояниях. В одном из таких возбужденных
состояний может оказаться дочернее ядро при α-распаде. Альфа-частицы,
испускаемые ядрами атомов радия, использовались Резерфордом в опытах по
рассеянию на ядрах тяжелых элементов. Скорость α-частиц, испускаемых при α-распаде
ядер радия, измеренная по кривизне траектории в магнитном поле, приблизительно
равна 1,5·107 м/с, а соответствующая кинетическая энергия около
7,5·10–13 Дж (приблизительно 4,8 МэВ). Эта величина легко
может быть определена по известным значениям масс материнского и дочернего ядер
и ядра гелия. Хотя скорость вылетающей α-частицы огромна, но она все же
составляет только 5% от скорости света, поэтому при расчете можно пользоваться
нерелятивистским выражением для кинетической энергии. Исследования показали,
что радиоактивное вещество может испускать α-частицы с несколькими
дискретными значениями энергий. Это объясняется тем, что ядра могут находиться,
подобно атомам, в разных возбужденных состояниях. В одном из таких возбужденных
состояний может оказаться дочернее ядро при α-распаде.
При
последующем переходе этого ядра в основное состояние испускается γ-квант.
Схема α-распада радия с испусканием α-частиц с двумя значениями
кинетических энергий приведена на рис.2. Таким образом, α-распад ядер во
многих случаях сопровождается γ-излучением.
В
теории α-распада предполагается, что внутри ядер могут образовываться
группы, состоящие из двух протонов и двух нейтронов, т.е. α-частица.
Материнское ядро является для α-частиц потенциальной ямой,
которая ограничена потенциальным барьером. Энергия α-частицы в ядре
недостаточна для преодоления этого барьера (рис.3). Вылет α-частицы из
ядра оказывается возможным только благодаря квантово-механическому явлению,
которое называется туннельным эффектом. Согласно
квантовой механике, существуют отличная от нуля вероятность прохождения частицы
под потенциальным барьером. Явление туннелирования имеет
вероятностный характер.
4. Бета-распад
При
бета-распаде из ядра вылетает электрон. Внутри ядер электроны существовать не
могут, они возникают при β-распаде в результате превращения нейтрона в
протон. Этот процесс может происходить не только внутри ядра, но и со
свободными нейтронами. Среднее время жизни свободного нейтрона составляет около
15 минут. При распаде нейтрон 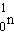 превращается в протон превращается в протон 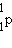 и электрон и электрон 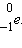
Измерения
показали, что в этом процессе наблюдается кажущееся нарушение закона сохранения
энергии, так как суммарная энергия протона и электрона, возникающих при распаде
нейтрона, меньше энергии нейтрона. В 1931 году В. Паули высказал
предположение, что при распаде нейтрона выделяется еще одна частица с нулевыми
значениями массы и заряда, которая уносит с собой часть энергии. Новая частица
получила название нейтрино (маленький нейтрон). Из-за
отсутствия у нейтрино заряда и массы эта частица очень слабо взаимодействует с
атомами вещества, поэтому ее чрезвычайно трудно обнаружить в эксперименте.
Ионизирующая способность нейтрино столь мала, что один акт ионизации в воздухе
приходится приблизительно на 500 км пути. Эта частица была обнаружена лишь в 1953 г. В настоящее время известно, что существует несколько
разновидностей нейтрино. В процессе распада нейтрона возникает частица, которая
называется электронным антинейтрино. Она
обозначается символом 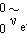 . Поэтому реакция распада нейтрона
записывается в виде . Поэтому реакция распада нейтрона
записывается в виде
Аналогичный
процесс происходит и внутри ядер при β- распаде. Электрон, образующийся в
результате распада одного из ядерных нейтронов, немедленно выбрасывается из
«родительского дома» (ядра) с огромной скоростью, которая может отличаться от
скорости света лишь на доли процента. Так как распределение энергии,
выделяющейся при β-распаде, между электроном, нейтрино и дочерним ядром
носит случайный характер, β-электроны могут иметь различные скорости в
широком интервале.
При
β-распаде зарядовое число Z увеличивается на
единицу, а массовое число A остается неизменным. Дочернее
ядро оказывается ядром одного из изотопов элемента, порядковый номер которого в
таблице Менделеева на единицу превышает порядковый номер исходного ядра.
Типичным примером β-распада может служить превращение изотона тория 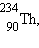 возникающего
при α-распаде урана возникающего
при α-распаде урана 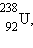 в палладий в палладий 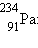
Наряду
с электронным β-распадом обнаружен так называемый позитронный β+-распад,
при котором из ядра вылетают позитрон 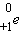 и нейтрино и нейтрино 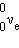 . Позитрон –
это частица-двойник электрона, отличающаяся от него только знаком заряда.
Существование позитрона было предсказано выдающимся физиком П. Дираком в 1928 г. Через несколько лет позитрон был обнаружен в составе космических лучей. Позитроны
возникают в результате реакции превращения протона в нейтрон по следующей
схеме: . Позитрон –
это частица-двойник электрона, отличающаяся от него только знаком заряда.
Существование позитрона было предсказано выдающимся физиком П. Дираком в 1928 г. Через несколько лет позитрон был обнаружен в составе космических лучей. Позитроны
возникают в результате реакции превращения протона в нейтрон по следующей
схеме:
5. Гамма-распад
В
отличие от α- и β-радиоактивности γ-радиоактивность ядер не
связана с изменением внутренней структуры ядра и не сопровождается изменением
зарядового или массового чисел. Как при α-, так и при β-распаде
дочернее ядро может оказаться в некотором возбужденном состоянии и иметь
избыток энергии. Переход ядра из возбужденного состояния в основное
сопровождается испусканием одного или нескольких γ-квантов, энергия
которых может достигать нескольких МэВ.
6.
Закон радиоактивного распада
В
любом образце радиоактивного вещества содержится огромное число радиоактивных
атомов. Так как радиоактивный распад имеет случайный характер и не зависит от
внешних условий, то закон убывания количества N(t) нераспавшихся к данному моменту времени t
ядер может служить важной статистической характеристикой процесса
радиоактивного распада.
Пусть
за малый промежуток времени Δt количество
нераспавшихся ядер N(t) изменилось
на ΔN < 0. Так как вероятность распада
каждого ядра неизменна во времени, что число распадов будет пропорционально
количеству ядер N(t) и промежутку
времени Δt:
Коэффициент
пропорциональности λ – это вероятность распада ядра за время Δt = 1 с. Эта формула означает, что скорость 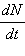 изменения
функции N(t) прямо пропорциональна
самой функции. изменения
функции N(t) прямо пропорциональна
самой функции.
Подобная
зависимость возникает во многих физических задачах (например, при разряде
конденсатора через резистор). Решение этого уравнения приводит к
экспоненциальному закону:
где
N0 – начальное число радиоактивных ядер при t = 0. За время τ = 1 / λ
количество нераспавшихся ядер уменьшится в e ≈ 2,7 раза.
Величину τ называют средним временем жизни
радиоактивного ядра.
Для
практического использования закон радиоактивного распада удобно записать в
другом виде, используя в качестве основания число 2, а не e:
Величина
T называется периодом полураспада.
За время T распадается половина первоначального
количества радиоактивных ядер. Величины T и τ
связаны соотношением
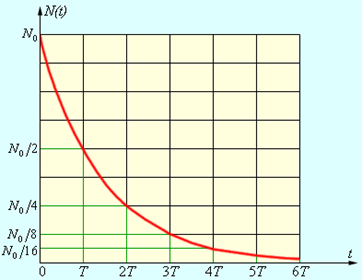
Рис. 4.
иллюстрирует закон радиоактивного распада.
|
|
Рисунок 4.
Закон радиоактивного
распада.
|
Период
полураспада – основная величина, характеризующая скорость радиоактивного
распада. Чем меньше период полураспада, тем интенсивнее протекает распад. Так,
для урана T ≈ 4,5 млрд. лет, а
для радия T ≈ 1600 лет. Поэтому
активность радия значительно выше, чем урана. Существуют радиоактивные элементы
с периодом полураспада в доли секунды.
При
α- и β-радиоактивном распаде дочернее ядро также может оказаться
нестабильным. Поэтому возможны серии последовательных радиоактивных распадов,
которые заканчиваются образованием стабильных ядер. В природе существует
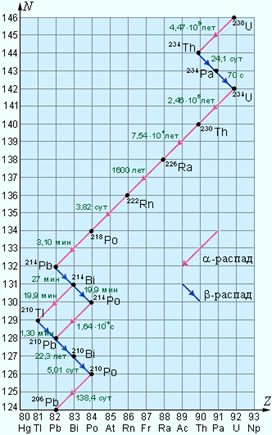
несколько таких серий. Наиболее длинной является серия 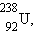 состоящая из 14 последовательных
распадов (8 – альфа-распадов и 6 бета-распадов). Эта серия заканчивается
стабильным изотопом свинца состоящая из 14 последовательных
распадов (8 – альфа-распадов и 6 бета-распадов). Эта серия заканчивается
стабильным изотопом свинца  (рис. 5). (рис. 5).
|
|
Рисунок 5.
Схема распада
радиоактивной серии  Указаны периоды полураспада. Указаны периоды полураспада.
|
В
природе существуют еще несколько радиоактивных серий, аналогичных серии  . Известна
также серия, которая начинается с нептуния . Известна
также серия, которая начинается с нептуния 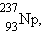 не обнаруженного в естественных
условиях, и заканчивается на висмуте не обнаруженного в естественных
условиях, и заканчивается на висмуте 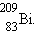 . Эта серия радиоактивных распадов
возникает в ядерных реакторах. . Эта серия радиоактивных распадов
возникает в ядерных реакторах.
Правило смещения. Правило смещения точно указывает, какие именно
превращения претерпевает химический элемент, испуская радиоактивное излучение.
7.
Радиоактивные ряды
Правило
смещения позволило проследить превращения естественных радиоактивных элементов
и выстроить из них три генеалогических дерева, родоначальниками которых
являются уран-238, уран-235 и торий-232. Каждое семейство начинается с
чрезвычайно долгоживущего радиоактивного элемента. Урановое семейство,
например, возглавляет уран с массовым числом 238 и периодом полураспада 4,5·109
лет (в табл. 1 в соответствии с первоначальным названием обозначен как уран I).
| Таблица 1.
Радиоактивное семейство урана |
| Радиоактивный
элемент |
Z |
Химический
элемент |
А |
Тип излуче-
ния
|
Период
полурас-
пада
|
| Уран I |
92 |
Уран |
238 |
|
4,5109
лет
|
|
Уран X1
|
90 |
Торий |
234 |
|
24,1 сут |
|
Уран X2
Уран Z
|
91
91
|
Протактиний
Протактиний
|
234
234
|
– (99,88%)
(0,12%)
|
1,14 мин
,7 ч
|
| Уран II |
92 |
Уран |
234 |
|
2,5105
лет
|
| Ионий |
90 |
Торий |
230 |
|
8104
лет
|
| Радий |
88 |
Радий |
226 |
|
1620 лет |
| Радон |
86 |
Радон |
222 |
|
3,8 сут |
| Радий А |
84 |
Полоний |
218 |
|
3,05 мин |
| Радий В |
82 |
Свинец |
214 |
|
26,8 мин |
|
РадийС
Радий С
|
83
83
|
Висмут
Висмут
|
214
214
|
(99,96%)
(0,04%)
|
19,7 мин
19,7 мин
|
| Радий С |
84 |
Полоний |
214 |
|
1,610–4
с
|
| Радий С |
81 |
Таллий |
210 |
|
1,3 мин |
| Радий D |
82 |
Свинец |
210 |
|
25 лет |
| Радий Е |
83 |
Висмут |
210 |
|
4,85 сут |
| Радий F |
84 |
Полоний |
210 |
|
138 сут |
| Радий G |
82 |
Свинец |
206 |
Стабилен |
|
Семейство урана. На элементах семейства урана можно проследить
большинство обсуждавшихся выше свойств радиоактивных превращений. Так,
например, у третьего члена семейства наблюдается ядерная изомерия. Уран X2,
испуская бета-частицы, превращается в уран II (T = 1,14 мин). Это соответствует
бета-распаду возбужденного состояния протактиния-234. Однако в 0,12% случаев
возбужденный протактиний-234 (уран X2) излучает гамма-квант и
переходит в основное состояние (уран Z). Бета-распад урана Z, также приводящий
к образованию урана II, происходит за 6,7 ч.
Радий
С интересен тем, что может распадаться двумя путями: испуская либо альфа-, либо
бета-частицу. Эти процессы конкурируют между собой, но в 99,96% случаев
происходит бета-распад с образованием радия С. В 0,04% случаев радий С
испускает альфа-частицу и превращается в радий С (RaC).
В свою очередь RaC и RaC путем эмиссии альфа- и
бета-частиц соответственно превращаются в радий D.
Изотопы. Среди членов уранового
семейства встречаются такие, атомы которых имеют одинаковый атомный номер
(одинаковый заряд ядер) и разные массовые числа. Они идентичны по химическим
свойствам, но различаются по характеру радиоактивности. Например, радий B,
радий D и радий G, имеющие одинаковый со свинцом атомный номер 82, подобны
свинцу по химическому поведению. Очевидно, что химические свойства не зависят
от массового числа; они определяются строением электронных оболочек атома
(следовательно, и Z). С другой стороны, массовое число имеет решающее
значение для ядерной стабильности радиоактивных свойств атома. Атомы с
одинаковым атомным номером и разными массовыми числами называются изотопами.
Изотопы радиоактивных элементов были открыты Ф.Содди в 1913, но вскоре Ф.Астон
с помощью масс-спектроскопии доказал, что изотопы имеются и у многих стабильных
элементов.
8.Действие радиоактивного излучения на человека
Радиоактивное
излучение всех видов (альфа, бета, гамма, нейтроны), а также электромагнитная
радиация (рентгеновское излучение) оказывают очень сильное биологическое воздействие
на живые организмы, которое заключается в процессах возбуждения и ионизации
атомов и молекул, входящих в состав живых клеток. Под действием ионизирующей
радиации разрушаются сложные молекулы и клеточные структуры, что приводит к лучевому поражению организма.
Поэтому при работе с любым источником радиации необходимо принимать все меры по
радиационной защите людей, которые могут попасть в зону действия излучения.
Однако
человек может подвергаться действию ионизирующей радиации и в бытовых условиях.
Серьезную опасность для здоровья человека может представлять инертный,
бесцветный, радиоактивный газ радон 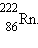 Как видно из схемы, изображенной
на рис.5, радон является продуктом α-распада радия и имеет период
полураспада T = 3,82 сут. Радий в
небольших количествах содержится в почве, в камнях, в различных строительных
конструкциях. Несмотря на сравнительно небольшое время жизни, концентрация
радона непрерывно восполняется за счет новых распадов ядер радия, поэтому радон
может накапливаться в закрытых помещениях. Попадая в легкие, радон испускает α-частицы
и превращается в полоний Как видно из схемы, изображенной
на рис.5, радон является продуктом α-распада радия и имеет период
полураспада T = 3,82 сут. Радий в
небольших количествах содержится в почве, в камнях, в различных строительных
конструкциях. Несмотря на сравнительно небольшое время жизни, концентрация
радона непрерывно восполняется за счет новых распадов ядер радия, поэтому радон
может накапливаться в закрытых помещениях. Попадая в легкие, радон испускает α-частицы
и превращается в полоний 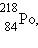 который не является химически
инертным веществом. Далее следует цепь радиоактивных превращений серии урана
(рис. 5). По данным Американской комиссии радиационной безопасности и
контроля, человек в среднем получает 55% ионизирующей радиации за счет радона и
только 11% за счет медицинских обслуживаний. Вклад космических лучей составляет
примерно 8%. Общая доза облучения, которую получает человек за жизнь, во много
раз меньше предельно допустимой дозы (ПДД),
которая устанавливается для людей некоторых профессий, подвергающихся
дополнительному облучению ионизирующей радиацией. который не является химически
инертным веществом. Далее следует цепь радиоактивных превращений серии урана
(рис. 5). По данным Американской комиссии радиационной безопасности и
контроля, человек в среднем получает 55% ионизирующей радиации за счет радона и
только 11% за счет медицинских обслуживаний. Вклад космических лучей составляет
примерно 8%. Общая доза облучения, которую получает человек за жизнь, во много
раз меньше предельно допустимой дозы (ПДД),
которая устанавливается для людей некоторых профессий, подвергающихся
дополнительному облучению ионизирующей радиацией.
9. Применение радиоактивных изотопов
Одним из наиболее выдающихся исследований, проведенных с помощью
«меченых атомов», явилось исследование обмена веществ в организмах. Было
доказано, что за сравнительно небольшое время организм подвергается почти
полному обновлению. Слагающие его атомы заменяются новыми. Лишь железо, как
показали опыты по изотопному исследованию крови, является исключением из этого
правила. Железо входит в состав гемоглобина красных кровяных шариков. При
введении в пищу радиоактивных атомов железа было установлено, что свободный кислород,
выделяемый при фотосинтезе, первоначально входил в состав воды, а не
углекислого газа. Радиоактивные изотопы применяются в медицине как для
постановки диагноза, так и для терапевтических целей. Радиоактивный натрий,
вводимый в небольших количествах в кровь, используется для исследования
кровообращения, йод интенсивно отлагается в щитовидной железе, особенно при
базедовой болезни. Наблюдая с помощью счетчика за отложением радиоактивного
йода, можно быстро поставить диагноз. Большие дозы радиоактивного йода вызывают
частичное разрушение аномально развивающихся тканей, и поэтому радиоактивный
йод используют для лечения базедовой болезни. Интенсивное гамма-излучение
кобальта используется при лечении раковых заболеваний (кобальтовая пушка).
Не менее обширны применения радиоактивных изотопов в
промышленности. Одним из примеров этого может служить следующий способ контроля
износа поршневых колец в двигателях внутреннего сгорания. Облучая поршневое
кольцо нейтронами, вызывают в нем ядерные реакции и делают его радиоактивным.
При работе двигателя частички материала кольца попадают в смазочное масло.
Исследуя уровень радиоактивности масла после определенного времени работы
двигателя, определяют износ кольца. Радиоактивные изотопы позволяют судить о
диффузии металлов, процессах в доменных печах и т. д.
Мощное гамма-излучение радиоактивных препаратов используют для
исследования внутренней структуры металлических отливок с целью обнаружения в
них дефектов.
Все более широкое применение получают радиоактивные изотопы в
сельском хозяйстве. Облучение семян растений (хлопчатника, капусты, редиса и
др.) небольшими дозами гамма-лучей от радиоактивных препаратов приводит к
заметному увеличению урожайности. Большие дозы 'радиации вызывают мутации у
растений и микроорганизмов, что в отдельных случаях приводит к появлению
мутантов с новыми ценными свойствами (радиоселекция). Так выведены ценные сорта
пшеницы, фасоли и других культур, а также получены высоко продуктивные
микроорганизмы, применяемые в производстве антибиотиков. Гамма-излучение
радиоактивных изотопов используется также для борьбы с вредными насекомыми и
для консервации пищевых продуктов. Широкое применение получили «меченые атомы»
в агротехнике. Например, чтобы выяснить, какое из фосфорных удобрений лучше
усваивается растением, помечают различные удобрения радиоактивным фосфором 15
32P. Исследуя затем растения на радиоактивность, можно определить количество
усвоенного ими фосфора из разных сортов удобрения.
Интересным
применением радиоактивности является метод датирования археологических и
геологических находок по концентрации радиоактивных изотопов. Наиболее часто
используется радиоуглеродный метод датирования. Нестабильный изотоп углерода  возникает в
атмосфере вследствие ядерных реакций, вызываемых космическими лучами. Небольшой
процент этого изотопа содержится в воздухе наряду с обычным стабильным изотопом возникает в
атмосфере вследствие ядерных реакций, вызываемых космическими лучами. Небольшой
процент этого изотопа содержится в воздухе наряду с обычным стабильным изотопом
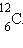 .Растения
и другие организмы потребляют углерод из воздуха, и в них накапливаются оба
изотопа в той же пропорции, как и в воздухе. После гибели растений они
перестают потреблять углерод и нестабильный изотоп в результате β-распада
постепенно превращается в азот .Растения
и другие организмы потребляют углерод из воздуха, и в них накапливаются оба
изотопа в той же пропорции, как и в воздухе. После гибели растений они
перестают потреблять углерод и нестабильный изотоп в результате β-распада
постепенно превращается в азот 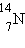 с периодом полураспада
5730 лет. Путем точного измерения относительной концентрации
радиоактивного углерода с периодом полураспада
5730 лет. Путем точного измерения относительной концентрации
радиоактивного углерода 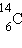 в останках древних организмов
можно определить время их гибели. в останках древних организмов
можно определить время их гибели.
Список
использованной литературы
1. Учение о
радиоактивности. История и современность. М. Наука, 1973 2. Ядерные излучения в науке и
технике. М. Наука, 1984 Фурман В. И. 3. Альфа-распад и родственные ядерные
реакции. М. Наука, 1985
4. Ландсберг Г. С. Элементарный учебник физики. Том III. – М.: Наука, 1986 5. Селезнев Ю. А. Основы элементарной физики. – М.: Наука, 1964. 6. CD ROM «Большая энциклопедия Кирилла и Мефодия», 1997.
7. Кюри М., Радиоактивность, пер. с франц., 2 изд., М. - Л., 1960
8. Мурин А.Н., Введение в радиоактивность, Л., 1955
9. Давыдов А.С., Теория атомного ядра, М., 1958
10. Гайсинский М.Н., Ядерная химия и ее приложения, пер. с франц.,
М., 1961
11. Экспериментальная ядерная физика, под ред. Э. Сегре, пер. с
англ., т. 3, М., 1961; Средства сети INTERNET
|