Курсовая работа: Абсорбционная установка
Курсовая работа: Абсорбционная установка
СОДЕРЖАНИЕ
1. Реферат
2. ВВЕДЕНИЕ
3. ОБЩАЯ ЧАСТЬ
3.1 Способы очистки промышленных газов от газообразных примесей
3.2 Физические основы процесса абсорбции
3.3 Схема абсорбционной установки
3.4 Устройство абсорберов
3.5 Выбор рабочих условий процесса
4. ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ
4.1 Материальный баланс установки
4.2 Расчет средней движущей силы процесса
5. КОНСТРУКТИВНЫЙ РАСЧЕТ
5.1 Расчет скорости газа и диаметра абсорбера
5.2.Расчет высоты светлого слоя жидкости
5.3 Расчет коэффициентов массоотдачи
5.4 Расчет числа тарелок абсорбера
5.5 Выбор расстояния между тарелками и
определение высоты абсорбера
6. ГИДРАВЛИЧЕСКИЙ РАСЧЕТ
6.1 Расчет гидравлического сопротивления тарелок абсорбера
6.2 Расчет и выбор штуцеров
7. ЛИТЕРАТУРА
1.РЕФЕРАТ
Ключевые слова: УСТАНОВКА, АБСОРБЦИЯ, КОЛОННА,
РАСЧЕТ, ТЕХНОЛОГИЯ, АММИАК, ТАРЕЛКА.
В общей части обсуждены
современные методы извлечения компонентов из газовых смесей. Принята
абсорбционная установка непрерывного действия для очистки воздуха от аммиака
производительностью 1.916м3/с. С начальным содержанием NH3 8.7% об. Выбраны основные технологические параметры
процесса. Принята конструкция тарельчатой абсорбционной колонны с ситчатыми тарелками.
В технологическом расчете
определены материальные потоки системы.
В конструктивном расчете
определены основные конструктивные размеры колонны, обеспечивающие заданную
степень разделения.
В гидравлическом расчете
определено гидравлическое сопротивление колонны.
2.ВВЕДЕНИЕ
В данном курсовом проекте
происходит абсорбция аммиака, из воздушной смеси, водой. В результате, на
выходе из абсорбера, получается так называемый нашатырный спирт (аммиачная
вода), широко используемый как в промышленности, так и в народном хозяйстве.
АММИАК (от греч. hals
ammoniakos — нашатырь), NH3, бесцветный газ с резким удушливым запахом;
плотность 0,681г/см3 (-33,35 °С), tпл = –77,7 °С, tкип
= –33,35 °С, ∆Н =23,27 кДж/моль, ∆Н =23,27 кДж/моль, ∆Н =45,94 кДж/моль, ∆S =45,94 кДж/моль, ∆S =192,66 Дж/моль∙К,при давлении
0,9 МПа сжижается при комнатной температуре. Хорошо растворим в воде; водный
раствор — нашатырный спирт. Получают каталитическим синтезом из азота и
водорода под давлением. =192,66 Дж/моль∙К,при давлении
0,9 МПа сжижается при комнатной температуре. Хорошо растворим в воде; водный
раствор — нашатырный спирт. Получают каталитическим синтезом из азота и
водорода под давлением.
Основной промышленный
способ получения NH3- по реакции:
1/2N2 + 3/2Н2 →NH3
Сдвиг равновесия вправо
способствует повышение давления и понижения температуры. Тепловой эффект
реакции при 29,4 МПа составляет 52,38 кДж/моль. Процесс проводят в присутствии
катализатора – Fe,
активированного K2O;Al2O3;CaO и др.
Каталитические яды –
сернистые и кислородосодержащие соединения. Для извесных катализаторов скорость
реакции описывается уравнением Темкина Пыжева:
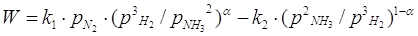 ; ;
Где W - наблюдаемая скорость процесса,
равная разности скоростей оюразования и разложения NH3,
k1 и k2 – константы скорости образования и
разложения аммиака,
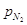 , , 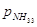 и и
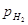 - парциальное давление
соответствующих газов α=0,5 для большинства промышленных катализаторов. - парциальное давление
соответствующих газов α=0,5 для большинства промышленных катализаторов.
Применяют аммиак в
производстве HNO3, мочевины, NH4NO3; (NH4)2CO3; (NH4)2SO4.,
аммофоса, уротропина, как жидкие удобрения, в качестве хладагента. Мировое
производство NH3 составило в 1982 около 89 млн. т, в СССР 17.76, США 14.06.
СРР 3.14, Франции 1.9, Японии 2.01, ФРГ 1.92 млн. т.
Аммиачная вода –– раствор
аммиака в воде. Прозрачная (иногда с желтоватым оттенком) жидкость с резким
запахом, плотность 18,5–25%-ного раствора 0,930–0,910 г/см3 (15 0С);
парциальное давление паров аммиака 0,1 МПа (40 0С); температура
выделения твёрдой фазы от–31,3 до –53,9 0С. С возрастанием давления
растворимость аммиака увеличивается, с повышением температуры уменьшается.
Применят аммиачную воду в
производстве азотной кислоты, мочевины, солей аммония, аммофоса, уротропина и
т.д.. Жидкий аммиак — хладагент, высококонцентрированное удобрение.
При содержании в воздухе
0,5% по объёму аммиак сильно раздражает слизистые оболочки. При остром
отравлении поражаются глаза и дыхательные пути, при хронических отравлениях
наблюдаются расстройство пищеварения, катар верхних дыхательных путей, ослабление
слуха. Жидкий аммиак вызывает сильные ожоги кожи. ПДК=20 мл/м3.
Смесь аммиака с воздухом взрывоопасна, КПВ=15–28%; для воздушно–аммиачных
смесей, содержащих 9–57% по объёму аммиака.
3. ОБЩАЯ ЧАСТЬ
3.1 Способы очистки промышленных газов
от газообразных примесей
Примеси, содержащиеся в
отходящих промышленных газах в газо- или парообразном состоянии, извлекаются
путем поглощения их жидкостями (абсорбция ) или твердыми поглотителями
(адсорбция), а также путем каталитического окисления или сжигания.
Если не требуется особо
тонкой очистки промышленного газа от примесей, то, как правило, используют
абсорбцию. Абсорбцией называется процесс поглощения газа или пара жидким
поглотителем (абсорбентом). Обратный процесс – выделение поглощенного газа из
поглотителя – называется десорбцией. В промышленности абсорбция с последующей
десорбцией широко применяется для выделения из газовых смесей ценных
компонентов, для очистки технологических и горючих газов от вредных примесей,
для санитарной очистки газов и т.д.
В некоторых случаях
десорбцию не проводят, если извлекаемый компонент и поглотитель являются
дешевыми или отбросными продуктами или если в результате абсорбции получается
готовый продукт (например, соляная кислота при абсорбции НСl водой).
3.2 Физические основы процесса
абсорбции
Растворимость газов
зависит от свойств газа и жидкости, от температуры и парциального давления
растворяющегося газа в газовой смеси. Зависимость между растворимостью газа и
его парциальным давлением характеризуется законом Генри, согласно которому
равновесное парциальное давление Р пропорционально содержанию растворенного
газа в растворе Х (мольн. доля):
Р = ЕХ, [3.2.1]
Где Р - парциальное
давление газа над раствором мм. Рт. Ст.;
Х- концентрация газа в
мольных долях;
Е - коэффициент Генри,
зависящий от температуры и от природы газа и жидкости.
Значение Р и Х
удовлетворяющее уравнениям имеют место при достижении равновесия между фазами,
эти следует рассматривать как равновесные. Коэффициент Е зависит от природы
растворяющегося вещества и температуры:
lnE = -q/RT +C; [3.2.2]
где q- теплота растворения газа,
кДж/кмоль;
R-универсальная газовая постоянная,
кДж/кмольос;
Т- температура
растворения, оК;
С - постоянная зависящая
от природы газа и жидкости.
Из равенства [3.2.2]
видно, что с ростом температуры растворимость уменьшается, рис 1
Рис.1 Зависимость между растворимостью
газа в жидкости и парциальным давлением.
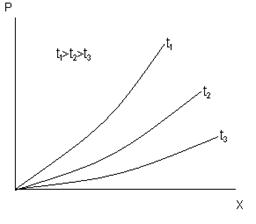
Парциальное давление
растворяемого газа, соответствующее равновесию, может быть заменено равновесной
концентрацией. Согласно закону Дальтона парциальное давление компонентов в газовой
смеси равно общему давлению, умноженному на мольную долю этого компонента в
смеси, т. е:
р= Пу; у=Р/П;
Где П- общее давление
газовой смеси;
у - концентрация
разделяемого компонента;
Сопоставляя уравнения,
получаем:
у=Р/П=Е/Р*Х или у=mx;
где m=Е/Р - константа фазового равновесия.
В химической технике
используют следующие принципиальные схемы абсорбционных установок:-
прямоточные, противоточные, одноступенчатые с рециркуляцией и много ступенчатые
с рециркуляцией.
Для извлечения аммиака из
воздуха используем противоточную схему (рис.2.) по этой схеме в одном конце
аппарата приводится в контакт газ и жидкость, имеющие большие концентрации
распределяемого вещества, а в противоположном конце меньшие.
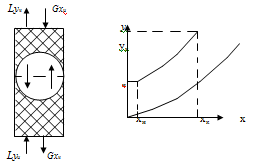
Рис.2 Противоточная схема
абсорбции
3.3 Схема абсорбционной установки
Технологическая схема
процесса абсорбции водой представлена на рис.3
рис.3 ТЕХНОЛОГИЧЕСКАЯ СХЕМА УСТАНОВКИ
1.- вентилятор
(газодувка);
2.- абсорбер;
3.- брызгоотбойник;
4,6.- оросители;
5.- холодильник;
7.- десорбер;
8.- куб абсорбера;
9, 13- емкость для
абсорбента;
10,12- насосы;
11.-
теплообменник-рекуператор.
Газ на абсорбцию подается
газодувкой (или компрессором) 1 в нижнюю часть абсорбера 2, где равномерно
распределяется. Абсорбент из промежуточной емкости 9 насосом 10 подается в
верхнюю часть колонны и равномерно распределяется по поперечному сечению
абсорбера с помощью оросителя 4,6. В колонне осуществляется противоточное
взаимодействие газа и жидкости. Газ после абсорбции выходит из колонны.
Абсорбент стекает в промежуточную емкость 13, откуда насосом 12 направляется на
регенерацию в десорбер 7 после предварительного подогрева в теплообменнике рекуператоре
11. Десорбция абсорбента производится в кубе 8. Перед подачей на орошение
колонны абсорбент, пройдя теплообменник-рекуператор 11, дополнительно
охлаждается в холодильнике 5.
3.4 Устройство абсорберов
При абсорбции процесс
массопередачи протекает на поверхности раздела фаз. Поэтому в аппаратах для
поглощения газов жидкостями (абсорберах) должна быть создана развитая
поверхность соприкосновения между газом и жидкостью.
По способу образования
этой поверхности абсорбционные аппараты можно разделить на поверхностные,
барботажные и распиливающие. При выборе типа абсорбера необходимо в каждом
конкретном случае исходить из физико-химических условий проведения процесса с
учетом технико-экономических факторов.
Исходя из агрессивности
среды, можно выбрать сетчатый тип тарелок. Область применения таких тарелок для
процессов, протекающих при любом давлении и стабильных режимах. Диапазон
устойчивости тарелок 2.
Колоны с тарелками без
сливных устройств.
В тарелки без сливных
устройств газ и жидкость проходят через одни и те же отверстия или щели. На
тарелке одновременно с взаимодействием жидкости и газа путем барботажа
происходит сток части жидкости на нижерасположенную тарелку – "проваливание"
жидкости. Поэтому тарелки такого типа обычно называются провальными. К ним
относятся дырчатые, решетчатые, трубчатые и волнистые тарелки.
Гидродинамический режим
работы провальных тарелок.
Эти режимы можно на
основе зависимости их гидравлического сопротивления от скорости газа при
постоянной плотности орошения. При малых ω жидкость на тарелке не
задерживается, так как мала сила трения между фазами. С увеличением скорости
газа жидкость начинает накапливаться на тарелке и газ барбатирует сквозь
жидкость. В интервале скорости газа, тарела работает в нормальном режиме. При
этом газ и жидкость попеременно проходят через одни и теже отверстия. Если
скорость газа еще больше возрастает, то, в следствии увеличения трения между
газом и жидкостью, резко увеличивается накопление жидкости на тарелке и
соответственно – ее гидравлическое сопротивление, что способствует наступлению
состояния захлебывания.
3.5 Выбор рабочих условий процесса
В качестве поглотителя
для данного процесса используем воду данный поглотитель не агрессивный, хорошо
подвергается регенерации путем нагревания, поэтому нет необходимости
использовать ингибиторы для предотвращения коррозии.
Для поглощения аммиака
водой можно использовать давление 1,013∙105Па [6] так, как
аммиак очень хорошо растворим в воде. Поэтому при данном давлении происходит
полное улавливание аммиака, уменьшаются геометрические размеры аппаратов и оно
является наиболее оптимальным, т.е. затраты на его создание эквивалентны
степени очистки и количеству полученного в ходе процесса аммиака. Тогда при 18оС
и Р=1,013∙10 5Па или 1 атм. Коэффициент распределения составит:
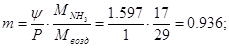
Где 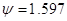 для системы - NH3 - H2O при 33оС. для системы - NH3 - H2O при 33оС.
P - давление процесса, Па
4. ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ
4.1 Материальный Баланс
Проведем пересчет
концентраций и нагрузок по фазам в выбранную для расчета размерность[4.1.1]:
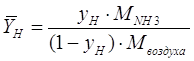 , [4.1.1] , [4.1.1]
Где 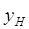 — мольная доля аммиака в
газе на входе в абсорбер, — мольная доля аммиака в
газе на входе в абсорбер, 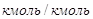 ; ;
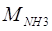 — мольная масса аммиака, — мольная масса аммиака, 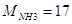 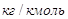
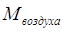 — мольная масса воздуха, — мольная масса воздуха, 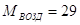 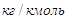 ; ;
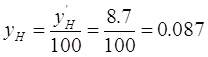
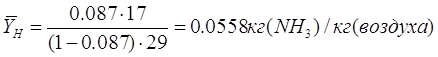
Конечная концентрация
аммиака в газе рассчитывается из регламентированной степени улавливания по
формуле[4.1.2]
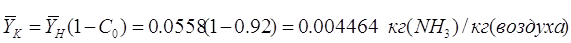
На основании
технико-экономических расчетов коэффициент избытка поглотителя принимают равным:[4.1.3]
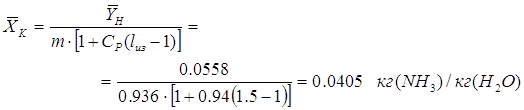
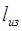 — коэффициент избытка поглотителя. — коэффициент избытка поглотителя.
С учетом заданной степени
регенерации абсорбера 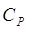 , определим
концентрацию аммиака в регенерированном поглотителе по Ур-нию:[4.1.4] , определим
концентрацию аммиака в регенерированном поглотителе по Ур-нию:[4.1.4]
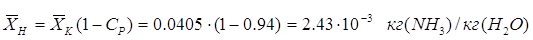
Проверим, не противоречат
выбранные условия параметрам процесса.
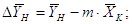
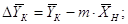
где 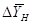 - движущая сила процесса
низа колонны, кг/кг; - движущая сила процесса
низа колонны, кг/кг;
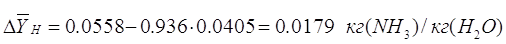
где 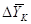 -движущая сила процесса
верха колонны, кг/кг; -движущая сила процесса
верха колонны, кг/кг;
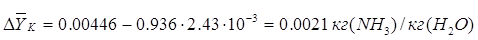 кг/кг; кг/кг;
Условие выполняется.
Рассчитаем массовый
расход инертной части газа.[4.1.5]
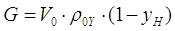 [4.1.5] [4.1.5]
где G- массовый расход инертной части
газа, кг/с;
Vо- объемный расход газа, м3/с;
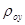 -средняя плотность инертной части
газа, кг/м3; -средняя плотность инертной части
газа, кг/м3;
Определим плотность
инертной части газа.[4.1.6]
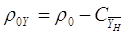 [4.1.6] [4.1.6]
где 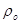 -плотность воздуха при
нормальных условиях, кг/м3; -плотность воздуха при
нормальных условиях, кг/м3;
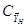 - объемная массовая концентрация
аммиака в воздухе, кг/м3; - объемная массовая концентрация
аммиака в воздухе, кг/м3;
Оприделим массовую
концентрацию в воздухе:[4.1.7]
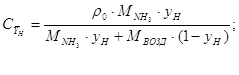 [4.1.7] [4.1.7]
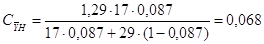 кг/м3; кг/м3;
здесь 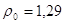 кг/м3; кг/м3;
Тогда:
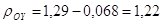 кг/м3; кг/м3;
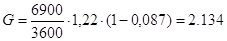 кг/с; кг/с;
Производительность
абсорбера по поглощаемому компоненту:[4.1.8]
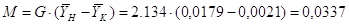 кг/с; [4.1.8] кг/с; [4.1.8]
Определим расход
поглотителя:[4.1.9]
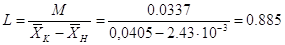 кг/с; [4.1.9] кг/с; [4.1.9]
Тогда соотношение
расходов фаз или удельный расход поглотителя определяется:[4.1.10]
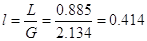 кг/кг [4.1.10] кг/кг [4.1.10]
Расходы поглощающей смеси
на входе и выходе абсорбера, соответственно Lсм.н Lсм.к, определяются выражениями:
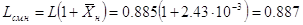 кг смеси/с; кг смеси/с;
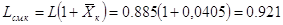 кг смеси/с; кг смеси/с;
Расходы газовой смеси на
входе и выходе абсорбера, соответственно Gсм.н и Gсм.к, будут:
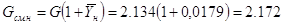 кг смеси/с; кг смеси/с;
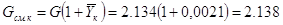 кг смеси/с; кг смеси/с;
4.2 Расчет средней движущей силы процесса
Движущую силу процесса
определяем по формуле:[4.2.1]
 [4.2.1] [4.2.1]
где 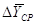 - средняя движущая сила
процесса, кг/кг; - средняя движущая сила
процесса, кг/кг;
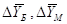 - большая и меньшая движущие силы
процесса соответственно, кг/кг; - большая и меньшая движущие силы
процесса соответственно, кг/кг;
Присваиваем :
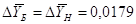 кг/кг; кг/кг; 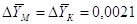 кг/кг; кг/кг;
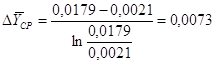 кг/кг; кг/кг;
5. КОНСТРУКТИВНЫЙ РАСЧЕТ
5.1 Расчет скорости газа и диаметра
абсорбера
Скорость газа в интервале
устойчивости раборы провальных тарелок может быть оприделена с помощью
уравнения [5.1.1]
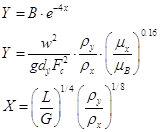 [5.1.1] [5.1.1]
Выбираем сетчатую
провальную тарелку со свободным сечением Fс=0,2 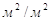 и ширенной щели δ=6мм; при этом dє=2δ=2*0,006=0,012м. и ширенной щели δ=6мм; при этом dє=2δ=2*0,006=0,012м.
В – коэффициент, равный
2,95 для нижнего и 10 верхнего пределов работы тарелки. Наиболее интенсивный
режим работы тарелок соответствует верхнему пределу, когда В=10 однако с учетом
возможного колебания нагрузок по газу принимают В=6-8. Приняв коэффициент В=8,
получим:
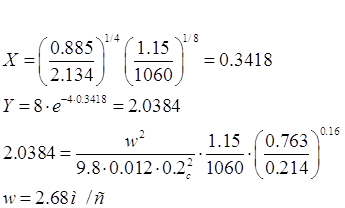
Плотность газа при
условиях в абсорбере составит:
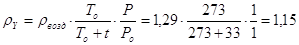 кг/м3; кг/м3;
 ––плотности газа и жидкости
соответственно, ––плотности газа и жидкости
соответственно, 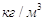 ;1,169 ;1,169
Диаметр абсорбера рассчитывают
из уравнения расхода газа[5.1.2]:
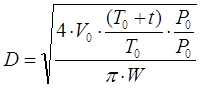 [5.1.2] [5.1.2]
Где V0 – производительность по газу при нормальных условиях, 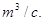
T0 – температура при стандартных условиях, К.
t - температура процесса, К.
P0 – давление при стандартных условиях, Па.
P - давление газа поступающее на установку,Па.
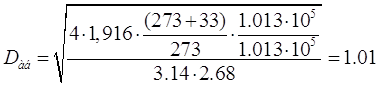 м м
Выбираем стандартный
диаметр обечайки абсорбера D=1,2m. При этом действительная скорость
газа в абсорбере равна[5.1.3]:
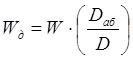 [5.1.3] [5.1.3]
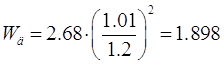 м/с. м/с.
Расчет коэффициента
массопередачи тарельчатых абсорберов проводят по модификационному уравнению
массопередачи для жидкой и газовой относят к единице рабочей площади тарелки.[5.1.4]
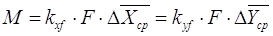 , [5.1.4] , [5.1.4]
где М – Масса
передаваемого вещества через поверхность массопередачи в еденицу времени, кг/с;
F – Суммарная рабочая площадь тарелок
в абсорбере, 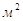
В этом случае необходимое
число тарелок определяют делением суммарной площади тарелок на рабочую площадь
одной тарелки:
 , ,
n – число тарелок;
f - рабочая площадь одной тарелки, 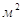
Коэффициент массопередачи
находят по уравнению аддитивности фазовых диффузионных сопротивлений:[5.1.5]
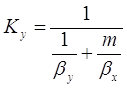 [5.1.5] [5.1.5]
Где 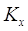 и и 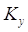 –– коэффициенты
массопередачи, отнесенные к единице рабочей площади тарелки для жидкой и
газовой фаз соответственно –– коэффициенты
массопередачи, отнесенные к единице рабочей площади тарелки для жидкой и
газовой фаз соответственно  ; ;
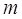 –– коэффициент распределения, –– коэффициент распределения, 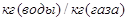 ; ;
 –– коэффициенты массоотдачи, отнесенные
к единице рабочей площади тарелки для жидкой и газовой фаз соответственно, –– коэффициенты массоотдачи, отнесенные
к единице рабочей площади тарелки для жидкой и газовой фаз соответственно, 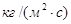 . .
Воспользуемся обобщенным
критериальным уравнением [5.1.6], применимое для различных конструкций барботажных
тарелок:
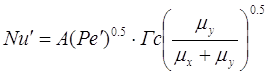 [5.1.6] [5.1.6]
При этом для жидкой фазы:
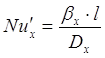 ; ; 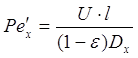
Для газовой фазы:
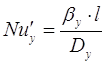 ; ; 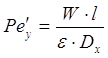
где А – коэффициент
Dx,Dy – коэффициенты молекулярной диффузии распределяемого
компонента соответственно в жидкости и газе, 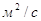 ; ;
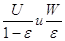 - Средние скорости жидкости и газа в
барботажном слое, м/с; - Средние скорости жидкости и газа в
барботажном слое, м/с;
ε – газосодержание барботажного слоя 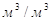 ; ;
Гс=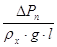 - критерий гидравлического
сопротивления, х-щий относительную величину удельной поверхности массопередачи
на тарелке; - критерий гидравлического
сопротивления, х-щий относительную величину удельной поверхности массопередачи
на тарелке;
ΔPn=ρgh0 – гидравлическое сопротивление
барботажного газо-жидкостного слоя (пены) на тарелке, Па;
h0 – высота слоя светлой жидкости на тарелке, м;
l – характерный линейный
размер,(средний диаметр пузырька) газовой струи в барботажном слое, м.
В интенсивных
гидродинамических режимах лин. Размер l становится практически постоянным. Тогда критериальные уравнения
массоотдачи, приводится в этом случае к удобному для расчета виду:
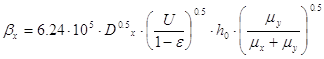 ; [5.1.7] ; [5.1.7]
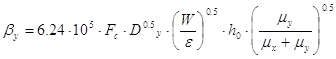 [5.1.8] [5.1.8]
Выбираем сетчатую
провальную тарелку со свободным сечением Fс=0,2 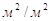 и ширенной щели δ=6мм; при этом dє=2δ=2*0,006=0,012м. и ширенной щели δ=6мм; при этом dє=2δ=2*0,006=0,012м.
Найдем гидравлическое
сопротивление барботажного газожидкостного слоя на тарелки, Па:[5.1.9]
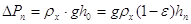 , [5.1.9] , [5.1.9]
где hn – высота газожидкостного барботажного слоя (пены) на тарелке,
м.
Высоту газожидкостного
слоя для провальных тарелок определяют по уравнению:[5.1.10]
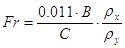 [5.1.10] [5.1.10]
где 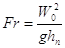 - критерий Фруда; - критерий Фруда;
W0 – скорость газа в свободном сечении (щелях) тарелки, м/с;
В – коэффициент, равный
2,95 для нижнего и 10 верхнего пределов работы тарелки. Наиболее интенсивный
режим работы тарелок соответствует верхнему пределу, когда В=10 однако с учетом
возможного колебания нагрузок по газу принимают В=6-8.
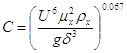 [5.1.11] [5.1.11]
где U – плотность орошения, 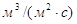 ; ;
g – ускорение свободного падения, 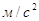 ; ;
σ – поверхностное
натяжение жидкости, Н/м
Плотность орошения для
провальных тарелок, не имеющих переливных устройств, найдем по уравнению:[5.1.12]
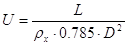 [5.1.12] [5.1.12]
L – расход поглотителя воды кг/с.
Найдем плотность
орошения:
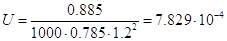
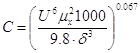 = =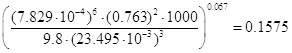
Пересчитаем величину
коэффициента В, которая была принята равной 8, с учетом действительности
скорости газа в колоне:[5.1.13]
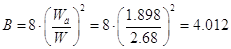 [5.1.13] [5.1.13]
5.2 Расчет высоты светлого слоя
жидкости
Высоту светлого слоя жидкости
на тарелке находят из соотношения:[5.2.1]
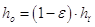 [5.2.1] [5.2.1]
hп – высота газожидкостного барботажного слоя (пены) на тарелке,
м.
Рассчитаем критерий
Фруда:
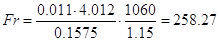
Отсюда находим высоту
газожидкостного слоя:
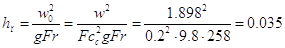 м м
Газосодержание
барботажного слоя находят по уравнению:
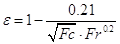
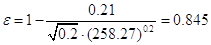 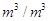
Тогда высота светлого
слоя жидкости:
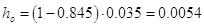 м м
5.3 Расчет коэффициентов массоотдачи
Для расчета коэффициента
массоотдачи, найдем значения коэффициентов молекулярной диффузии по уравнению:[5.3.1]
Коэффициент диффузии
компонента газовой фазы А в газе В можно рассчитать, пользуясь полуэмпирической
зависимостью [5.3.1]:
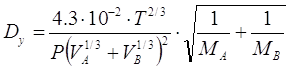 , [5.3.1] , [5.3.1]
Где VA VB – мольные объемы газов А и В соответственно в жидком
состоянии при нормальной температуре кипения,  /кмоль; /кмоль;
МА и МВ – мольные массы газов А и В
соответственно кг/кмоль;
Р – давление в абсорбере,
Па;
Т – температура газа, К.
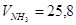 м3/кмоль; м3/кмоль; 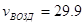 м3/кмоль; м3/кмоль;
Определим Dy для рассматриваемого случая:
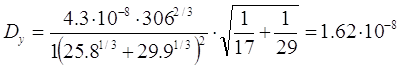
Коэффициент диффузии Dx в разбавленных растворах можем вычислить по уравнению
[4.4.2]
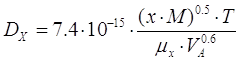 [5.3.2] [5.3.2]
Где М – мольная масса
растворителя, кг/кмоль;
Т – температура
растворителя, К;
VА – мольный объем поглощаемого компонента, 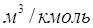 ; ;
x – поправочный компонент (x = 2.6 для воды);
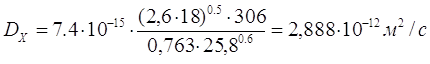
Рассчитав значения
коэффициентов молекулярной диффузии, вычисляем коэффициенты массоотдачи:
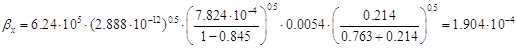 м/с м/с
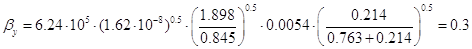 = м/с = м/с
Выразим 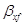 и и 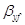 в выбранной для расчета размерности: в выбранной для расчета размерности:
 кг/(м2·с) кг/(м2·с)
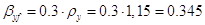 кг/(м2·с) кг/(м2·с)
Коэффициент
массопередачи:
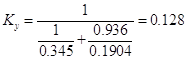
5.4 Расчет числа тарелок абсорбера
Суммарная поверхность
тарелок абсорбера находиться из модифицированного уравнения массопередачи[5.4.1]:
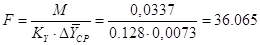 м2 [5.4.1] м2 [5.4.1]
Требуемое число тарелок
[5.4.1]:
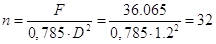 [5.4.2] [5.4.2]
5.5 Выбор расстояния между тарелками и
определение высоты абсорбера
Расстояние между
тарелками барботажного типа принимают равными или несколько большими суммы
высот барботажного слоя и сепарационного пространства:
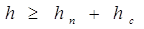
где h – расстояние между тарелками;
hп – высота барботажного слоя, м;
hс – высота сепарационного пространства, м
Высоту сепарационного
пространства вычисляют, исходя из допустимой величиной брызгоуноса с тарелки,
принимаемой равной 0,1 кг жидкости на 1 кг газа.
Значение l для провальных тарелок рассчитывают
по уравнению[5.5.1]:
 ; [5.5.1] ; [5.5.1]
Где f –поправочный множитель, учитывающий
свойства жидкости и равный 0,0565 (ρх /σ)1,1;
σ – в mH/m; коэффициент А и показатели степени m и n
приведены ниже:
А=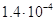
m= 2.56
n= 2.56
С учетом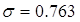 - поверхностное натяжение
жидкой фазы, Н/м будет равна: - поверхностное натяжение
жидкой фазы, Н/м будет равна:
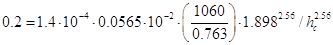
тогда решая это уравнение
относительно hс будет: hс=0,101м,
Тогда расстояние между
тарелками:
h=0,035+0,101=0,136м
В соответствии с
требованиями выбираем стандартное значение
h=200 мм
Высота тарельчатой части
абсорбера определяется по формуле
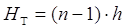
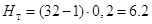 м; м;
Расстояние между днищем
абсорбера и насадкой Zн определяется необходимостью
равномерного распределения газа по поперечному сечению колонны. Расстояние от
верха насадки до крышки абсорбера Zв зависит от
размеров распределительного устройства для орошения насадки и от высоты
сепарационного пространства (в котором часто устанавливают каплеотбойные
устройства для предотвращения брызгоуноса из колонны). Примем эти расстояния
равными соответственно 1,4 и 2,5м.
Тогда общая высота одного абсорбера:
Ha=Нн+Zв+Zн=6,2+1,4+2,5=10,1 м.
6. ГИДРАВЛИЧЕСКИЙ РАСЧЕТ
6.1 Расчет гидравлического
сопротивления тарелок абсорбера
Гидравлическое
сопротивления тарелок абсорбера определяют по формуле:
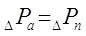 , ,
где 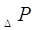 - полное гидравлическое
сопротивление одной тарелки, Па. - полное гидравлическое
сопротивление одной тарелки, Па.
Полное гидравлическое
сопротивление одной тарелки 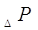 складывается
из трех слагаемых:[5.1.1] складывается
из трех слагаемых:[5.1.1]
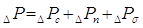 , [6.1.1] , [6.1.1]
где 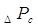 , , 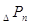 , , 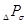 - гидравлическое
сопротивление сухой (неорошаемой) тарелки, газожидкостного слоя (пены) на
тарелке сопротивление, вызванное силами поверхностного натяжения, Па - гидравлическое
сопротивление сухой (неорошаемой) тарелки, газожидкостного слоя (пены) на
тарелке сопротивление, вызванное силами поверхностного натяжения, Па
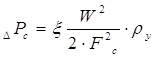 [6.1.2] [6.1.2]
где 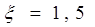 - коэффициент
сопротивления сухой тарелки. - коэффициент
сопротивления сухой тарелки.
Тогда
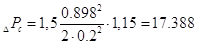 Па Па
Гидравлическое
сопротивление газожидкостного слоя (пены) на тарелке[5.1.3]:
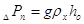 [6.1.3] [6.1.3]
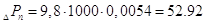 кПа кПа
гидравлическое
сопротивление, обусловленное силами поверхностного натяжения, равно [5.1.4]:
 Па [6.1.4] Па [6.1.4]
Диаметр отверстия для
ситчатой тарелки dє=12, мм.
Тогда полное
гидравлическое сопротивление:
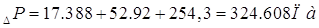
Гидравлическое
сопротивление всех тарелок абсорбера:
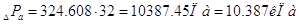
6.2 Расчет и выбор штуцеров
Присоединение
трубопроводов к сосудам и аппаратам осуществляется с помощью труб и штуцеров.
Штуцера не рассчитывают
на прочность, а выбирают исходя из оптимального диаметра и давления среды. Для
каждого случая необходимо исходить из оптимального значения скорости.
Расчет штуцеров для ввода
и вывода абсорбента.
Выберем значение w для абсорбента, равное 1 м/с. Тогда
диаметр штуцера будет:
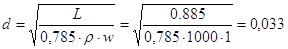 м м
Расчет штуцеров для ввода
и вывода газовой смеси.
Значение w для газовой смеси выберем равной 40
м/с, тогда
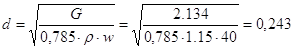 м м
По ОСТ 261404-76
определим основные параметры патрубков стандартных стальных фланцевых
тонкостенных штуцеров:
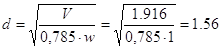
При заданном расходе V и скорости принимаем в напорных
трубопроводах w=1m/c
ОСНОВНЫЕ РАЗМЕРЫ ШТУЦЕРОВ
| Dy, мм |
dT, мм
|
ST, мм
|
HT, мм
|
| 200 |
219 |
6 |
160 |
| 500 |
530 |
12 |
210 |
При условном давлении до 1
МПа
7.ЛИТЕРАТУРА
1. Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи
по курсу процессов и аппаратов химической технологии .- Л: Химия,
1976.-552 с.
2. Плановский А.Н., Рамм В.М., Каган С.З. Процессы и аппараты
химической технологии.- М.: Химия,1968.-847с.
3.Плановский А.Н., Николаев П.И. Процессы и аппараты химической
и нефтехимической технологии.- М.: Химия,1972.-496с.
4.Касаткин А.Г. Основные процессы и аппараты химической
технологии. -М.: Химия, 1971.-750с.
5. Дытнерский Ю.И. Основные процессы и аппараты химической
технологии. Пособие по проектированию .-М.: Химия,1991.- 496с.
6. Лащинский А.А. Конструирование сварных химических
аппаратов. Справочник . -Л.: Машиностроение,1981.-382с.
7. Лащинский А.А., Толчинский А.Р. Основы конструирования и
расчета химической аппаратуры. Справочник . -Л.: Машиностроение,1970.-752с.
|