Учебное пособие: Электронное строение атома. Периодический закон
Учебное пособие: Электронное строение атома. Периодический закон
Лекция № 2 и 3
Электронное
строение атома.
Периодический
закон.
Квантово-механическая
модель атома. Атомные орбитали. Квантовые числа.
Правила
заполнения электронами атомных орбиталей. Валентность.
Периодический
закон. Периодическая система.
Теория
строения атома основана на законах, описывающих движение микрочастиц
(электронов, атомов, молекул) и их систем (например, кристаллов). Массы и
размеры микрочастиц чрезвычайно малы по сравнению с массами и размерами
макроскопических тел. Поэтому свойства и закономерности движения отдельных
микрочастиц отличаются от свойств и закономерностей движения макроскопических
тел, изучаемых классической физикой. Движение и взаимодействие микрочастиц
описывает квантовая механика, которая основывается на представлении о
квантовании энергии, волновом характере движения микрочастиц и вероятностном
(статистическом) методе описания микрообъектов.
Примерно в
начале XX в. исследования явлений (фотоэффект, атомные
спектры) привели к выводу, что энергия распространяется и передаётся,
поглощается и испускается не непрерывно, а дискретно, отдельными порциями –
квантами. Энергия системы микрочастиц также может принимать определённые
значения, которые являются кратными частицами квантов.
Предположение
о квантовании энергии впервые было высказано М. Планком в 1900 г. и было
обосновано Эйнштейном в 1905 г.: энергия кванта 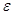 зависит от частоты излучения зависит от частоты излучения 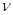 : : 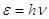 , где (1) , где (1)
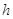 – постоянная
Планка ( – постоянная
Планка (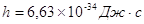 ) )
Частота
колебаний 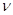 и
длина волны и
длина волны 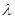 связаны
соотношением: связаны
соотношением: 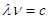 , ,
где 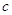 – скорость
света. – скорость
света.
Согласно
соотношению (1), чем меньше 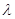 , тем больше энергия кванта , тем больше энергия кванта 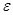 и наоборот. Таким
образом, ультрафиолетовые и рентгеновские лучи обладают большей энергией, чем
скажем радиоволны и инфракрасные лучи. Для описания электромагнитного излучения
привлекают как волновые, так и корпускулярные представления: с одной стороны
монохроматическое излучение распространяется как волна и характеризуется длиной
волны и наоборот. Таким
образом, ультрафиолетовые и рентгеновские лучи обладают большей энергией, чем
скажем радиоволны и инфракрасные лучи. Для описания электромагнитного излучения
привлекают как волновые, так и корпускулярные представления: с одной стороны
монохроматическое излучение распространяется как волна и характеризуется длиной
волны 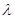 , с
другой стороны оно состоит из микрочастиц – фотонов, переносящих кванты энергии. , с
другой стороны оно состоит из микрочастиц – фотонов, переносящих кванты энергии.
Явление дифракции
электромагнитного излучения доказывает его волновую природу. В то же время
электромагнитное излучение обладает энергией, массой, производит давление. Так,
вычислено, что за 1 год масса Солнца уменьшается за счёт излучения на 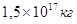 . .
В 1924 г. Луи
де Бройль предложил распространить корпускулярно-волновые представления на все
микрочастицы, т.е. движение любой микрочастицы рассматривать как волновой процесс.
Математически это выражается соотношением де Бройля, согласно которому частице
массой 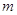 ,
движущейся со скоростью ,
движущейся со скоростью  , соответствует волна длиной , соответствует волна длиной 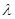 : : 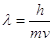 , (2) , (2)
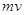 – импульс
частицы. – импульс
частицы.
Гипотеза де
Бройля была экспериментально подтверждена обнаружением дифракционного и
интерферентного эффектов потока электронов.
Согласно соотношению
(2) движению электрона (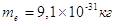 , , 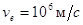 ) отвечает волна длиной ) отвечает волна длиной 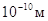 , т.е. её длина
соизмерима с размерами атомов. , т.е. её длина
соизмерима с размерами атомов.
В 1925 г. Шрёдингер
предположил, что состояние движения электрона в атоме должно описываться
уравнением стоячей электромагнитной волны. Он получил уравнение, которое
энергию электрона связывает с пространством Декартовых координат и так
называемой волновой функцией 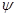 , которая соответствует амплитуде
3-х мерного волнового процесса: , которая соответствует амплитуде
3-х мерного волнового процесса:
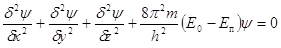 , где , где
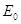 – полная
энергия электрона – полная
энергия электрона
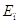 –
потенциальная энергия электрона –
потенциальная энергия электрона
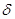 – вторая
частная производная – вторая
частная производная
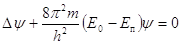
Уравнение Шредингера
позволяет найти волновую функцию 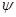 как функцию координат. Физический
смысл волновой функции в том, что квадрат её модуля определяет вероятность
нахождения электрона в элементарном объёме как функцию координат. Физический
смысл волновой функции в том, что квадрат её модуля определяет вероятность
нахождения электрона в элементарном объёме  , т.е. характеризует электронную
плотность.Т. к. электрон обладает свойствами волны и частицы, мы не можем
определить его положение в пространстве в определённый момент времени. Электрон
размазан, т.е. делокализирован в пространстве атома. В этом заключается принцип
Гейзенберга. , т.е. характеризует электронную
плотность.Т. к. электрон обладает свойствами волны и частицы, мы не можем
определить его положение в пространстве в определённый момент времени. Электрон
размазан, т.е. делокализирован в пространстве атома. В этом заключается принцип
Гейзенберга.
Микрочастица,
так же как и волна не имеет одновременно точных значений координат и импульса. Это
проявляется в том, что чем точнее определяется координаты частицы, тем
неопределеннее её импульс, и наоборот. Поэтому мы говорим о максимально
вероятном нахождении электрона в данном месте в определённый момент времени. Та
область пространства, где >90% находится электрон называется атомной
орбиталью. Уравнение Шредингера имеет множество решений, но физически
осмысленное решение только в определённых условиях.
Для описания
стоячей волны, образованной в атоме движущимся электроном, т.е. для нахождения
волновой функции 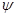 необходимы квантовые числа. необходимы квантовые числа.
В 3-х мерном
пространстве 4-мя квантовыми числами описывается состояние электрона:
Главное
квантовое число 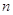 характеризует удалённость
электрона от ядра и определяет его энергию (чем больше характеризует удалённость
электрона от ядра и определяет его энергию (чем больше  , тем больше энергия электрона и
тем меньше энергия связи с ядром). , тем больше энергия электрона и
тем меньше энергия связи с ядром). 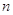 принимает целочисленные значения
от 1 до ¥. принимает целочисленные значения
от 1 до ¥.
Состояние
электрона характеризующееся различными значениями главного квантового числа 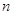 , называется
электронным слоем (электронной оболочкой, энергетическим уровнем). Они
обозначаются цифрами 1, 2, 3, 4, 5, … или соответственно буквами K, L, M, N, O …. , называется
электронным слоем (электронной оболочкой, энергетическим уровнем). Они
обозначаются цифрами 1, 2, 3, 4, 5, … или соответственно буквами K, L, M, N, O ….
Квантовое
состояние атома с наименьшей энергией – основное состояние, а с более высокой –
возбуждённое состояние. Переход электрона с одного уровня на другой
сопровождается либо поглощением, либо выделением энергии: 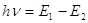 . .
Побочное
квантовое (орбитальное, азимутальное) число 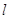 (принимает все целочисленные
значения от 0 до (n-1)). (принимает все целочисленные
значения от 0 до (n-1)).
|
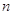
|
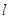
|
Орбиталь |
| 1 |
0 |
1s |
| 2 |
0,1 |
2s,2p |
| 3 |
0,1,2 |
3s,3p,3d |
Состояние
электрона характеризующееся различными значениями побочного квантового числа 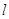 называется энергетическим
подуровнем. В пределах каждого уровня с увеличением называется энергетическим
подуровнем. В пределах каждого уровня с увеличением 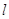 , растёт энергия орбитали. , растёт энергия орбитали.
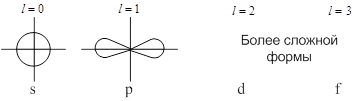
Каждому
значению 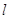 соответствует
определённая форма орбитали (например, при соответствует
определённая форма орбитали (например, при 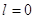 – это сфера, центр которой
совпадает с ядром). – это сфера, центр которой
совпадает с ядром).
Магнитное
квантовое число 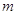 характеризует ориентацию орбитали
в пространстве (принимает все целочисленные значения от - характеризует ориентацию орбитали
в пространстве (принимает все целочисленные значения от - 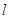 до + до +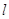 ). ).
Например,
для 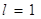 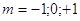 . В пределах
каждого подуровня орбиталь имеет одинаковую энергию. . В пределах
каждого подуровня орбиталь имеет одинаковую энергию.
Спиновое
квантовое число 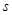 характеризует вращательный
момент, который приобретает электрон в результате собственного вращения вокруг
своей оси (принимает два значения: характеризует вращательный
момент, который приобретает электрон в результате собственного вращения вокруг
своей оси (принимает два значения: 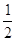 – вращение по часовой стрелке, – вращение по часовой стрелке, 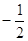 – вращение
против часовой стрелки). – вращение
против часовой стрелки).
Атомные
орбитали заполняются электронами в соответствии с 3-мя принципами:
Принцип
устойчивости (принцип min энергии): Каждая новая орбиталь
заполняется только после того, как будут заполнены все предыдущие, т.е. более
устойчивые (с min энергией) орбитали.
Энергия
атомных орбиталей возрастает следующим образом:
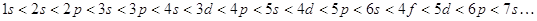
Правило
Клечковского: заполнение электронами атомных орбиталей происходит в соответствии
с увеличением суммы главного 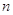 и побочного и побочного 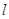 квантовых чисел; если квантовых чисел; если 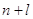 одинакова, то
атомная орбиталь заполняется от больших одинакова, то
атомная орбиталь заполняется от больших 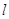 и меньших и меньших 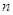 к меньшим к меньшим 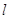 и большим и большим 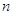 . .
|
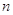
|

|
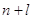
|
Орбиталь |
| 1 |
0 |
1 |
1s |
| 2 |
0 |
2 |
2s |
| 1 |
3 |
2p |
| 3 |
0 |
3 |
3s |
| 1 |
4 |
3p |
| 2 |
5 |
3d |
| 4 |
0 |
4 |
4s |
| 1 |
5 |
4p |
| 2 |
6 |
4d |
| 3 |
7 |
4f |
| 5 |
0 |
5 |
5s |
| 1 |
6 |
5p |
| 2 |
7 |
5d |
| 3 |
8 |
5f |
| 4 |
9 |
5g |
| 6 |
0 |
6 |
6s |
Принцип
Паули: в атоме не может быть 2 электрона, у которых 4 одинаковых квантовых
числа. Следовательно, на 1-ой орбитали могут находиться не более 2-х электронов,
отличающихся друг от друга значением спинового квантового числа. Отсюда
следует, что максимальное количество электронов на энергетическом уровне 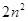 , на
энергетическом подуровне , на
энергетическом подуровне 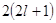 . .
Пример:
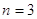 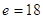 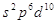
Правило Хунда:
электроны располагаются на орбиталях равной энергии таким образом, чтобы их
суммарный спин был максимальный. Это означает, что первоначально электроны
заполняют все свободные орбитали данного подуровня по 1-му, имея при этом
параллельные спины, и только потом происходит заполнение этих орбиталей 2-ми
электронами.
Пример:
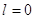 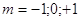 Px Py Pz Px Py Pz
|
|
K |
L |
M |
|
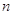
|
1 |
2 |
|
|
|
3 |
|
|
|
|
|
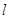
|
0 |
0 |
1 |
|
|
0 |
1 |
|
|
2 |
|
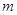
|
0 |
0 |
-1 |
0 |
+1 |
0 |
-1 |
0 |
+1 |
|
|
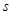
|
↓↑ |
↓↑ |
↓↑ |
↓↑ |
↓↑ |
↓↑ |
↓↑ |
↓↑ |
↓↑ |
|
|
|
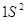
|
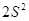
|
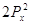
|
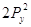
|
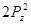
|
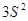
|
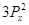
|

|
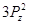
|
|
Количество
неспаренных электронов на внешнем уровне определяет валентность элемента, т.е. способность
образовывать химические связи с другими атомами. В большинстве случаев, но не
всегда.
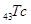 5 5 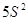 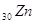 4 4 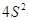
4 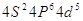 3 3 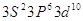
3 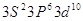 2 2 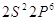
2 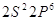 1 1 
1 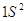
Периодический
закон (1869 г): свойства простых тел, а также свойства и формы соединений
элементов находятся в периодической зависимости от величины атомных весов
элементов.
До появления
сведений о сложном строении атома основной характеристикой элемента служил
атомный вес (относительная атомная масса). Развитие теории строения атома
привело к установлению того факта, что главной характеристикой атома является положительный
заряд ядра.
В
современной формулировке периодический закон звучит: свойства химических
элементов, а также формулы и свойства образуемых ими соединений находятся в
периодической зависимости от величины заряда ядер их атомов.
Физической
основой структуры периодической системы элементов служит определённая
последовательность формирования электронных конфигураций атомов по мере роста
порядкового номера элемента.
В
зависимости от того, какой энергетический подуровень заполняется электронами
последним, различают 4 типа элементов:
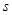 –
элементы (последним заполняется –
элементы (последним заполняется 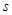 -подуровень внешнего
энергетического уровня) -подуровень внешнего
энергетического уровня)
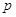 – элементы (последним
заполняется – элементы (последним
заполняется 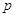 -подуровень
внешнего энергетического уровня) -подуровень
внешнего энергетического уровня)
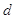 – элементы
(последним заполняется – элементы
(последним заполняется 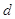 -подуровень предпоследнего энергетического
уровня) -подуровень предпоследнего энергетического
уровня)
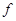 – элементы
(последним заполняется – элементы
(последним заполняется 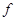 -подуровень 3-го снаружи энергетического
уровня). -подуровень 3-го снаружи энергетического
уровня).
Горизонтально
располагаются периоды – последовательный ряд элементов, электронная конфигурация
внешнего энергетического уровня которых изменяется от 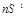 до до 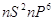 . Номер периода совпадает со
значением главного квантового числа . Номер периода совпадает со
значением главного квантового числа 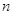 внешнего энергетического уровня. внешнего энергетического уровня.
Вертикально
располагаются группы – элементы имеющие сходное электронное строение. У
элементов главной подгруппы последним заполняется 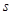 и и 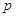 подуровни внешнего
энергетического уровня, у элементов побочной подгруппы происходит заполнение
внутренних подуровни внешнего
энергетического уровня, у элементов побочной подгруппы происходит заполнение
внутренних 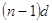 и и
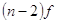 подуровней.
Одинаковый номер группы, как правило, определяет число электронов, которое
может участвовать в образовании химических связей. подуровней.
Одинаковый номер группы, как правило, определяет число электронов, которое
может участвовать в образовании химических связей.
Вопросы для самоконтроля
Квантово-механическая
модель атома.
Уравнения де
Бройля и Шредингера.
Принцип
неопределенности Гейзенберга.
Атомная
орбиталь, квантовые числа.
Правила
заполнения электронами атомных орбиталей (принцип минимальной энергии, правило
Клечковского, правила Паули и Гунда).
Периодический
закон Д.И. Менделеева. Периодическая таблица (периоды и группы).
|