Курсовая работа: Теоретичні основи генно-модифікованих продуктів
Курсовая работа: Теоретичні основи генно-модифікованих продуктів
Зміст
Вступ: Стан і перспективи розвитку генної інженерії в
Україні та за кордоном.
1. Теоретичні основи генно-модифікованих продуктів.
1.1. Ген як елементарна одиниця спадковості
1.2. Генетичний код
1.3. Структурна організація генному
1.4. Кланування генів
2. Генно-інженерні підходи до створення інтенсивних
технологій в харчовій галузі
2.1. Використання генної інженерії у м’ясній і
молочній промисловості
2.2. Використання генної інженерії у рослинництві
2.3. Методи генної інженерії мікроорганізмів
2.4. Позитивні і негативні наслідки використання ГМП
3. Методи застосування генної інженерії в медицині
3.1. Біоматеріали
3.2. Генна інженерія в епідеміології
4. Вплив генно-модифікованих продуктів на стан здоров’я
людини
5. Висновки
Список літератури
Вступ
За прогнозами демографів, в 2000 р. населення Землі становило
6,2 млрд. чол., а до 2025 р. повинне досягти 8,3 млрд. Вчені зайняті
розв’язанням проблеми пошуку нових сільгосппродуктів, яких буде багато і які
вирощувати й захищати від шкідливих впливів навколишнього середовища полегшає
легені.
Як усунути навислу над світом і ще не цілком усвідомлену нами
погрозу голоду? Розширювати посівні площі, будувати нові ферми? Але адже Земля
й так забудована й розорана уздовж і поперек. Підвищувати врожайність зернових
і виробництво м'яса традиційними способами? Ні, так теж проблему не вирішити.
Адже врожайність основних світових культур - пшениці й рису досягла межі. А
нескінченні "м'ясні скандали" - те з коров'ячим сказом, то з
малайзійськими свинями, то з бельгійськими курми - показують, що робити якісну
яловичину, свинину й птаха стає усе сутужніше.
"Ми завалимо
мир нашою їжею й урятуємо його від голоду", - упевнено говорять
представники американської компанії "Монсанто" і інших світових
лідерів у виробництві генетично модифікованої їжі. Що ж насправді являє собою
ця загадкова їжа й наскільки обгрунтовані викликувані нею побоювання? Що ж таке
генна інженерія і який механізм її дії? У загальному поданні генна інженерія -
це нова, революційна технологія, за допомогою якої вчені можуть витягати гени з
одного організму й впроваджувати їх у будь-який іншій. Пересадження генів
змінює програму організму-одержувача, і його клітини починають робити різні
речовини, які, у свою чергу, створюють нові характеристики усередині цього
організму. За допомогою цього методу дослідники можуть міняти особливі
властивості й характеристики в потрібному їм напрямку: наприклад, вони можуть
вивести сорт соєвих бобів, стійких до впливу гербіцидів.
Дослідники з дуже більшою наснагою узялися використати генну
інженерію для створення більше живильних продуктів харчування ліквідації певних
хвороб, у тому числі й у свійських тварин, сподіваючись у такий спосіб
поліпшити життя людини на Землі. Але в дійсності, незважаючи на те що гени
можуть бути витягнуті й правильно схрещені, у житті дуже важко прогнозувати
наслідку вживляння генів у чужий організм. Такі операції можуть стати причиною
мутацій, у результаті яких придушується діяльність природних генів організму.
Впроваджені гени можуть також викликати несподівані побічні ефекти: генетично
модифікована їжа може, приміром, містити токсини й алергени або мати знижену
поживність, і в результаті споживачі занедужують або навіть, як уже траплялося,
умирають. Крім того, організми, виведені за допомогою генної інженерії, здатні
самостійно розмножуватися й схрещуватися із природними, що не перетерпіли генне
втручання популяціями, викликаючи при цьому необоротні біологічні зміни у всієї
екосистеми Землі. Так уважають багато вчених, і зокрема д-р наук, проф.
молекулярної біології в Університеті Менеджменту Махариши (Фэарфилд, Айова)
Джон Фейган, що одержав понад 2,5 млн. дол. державних субсидій на проведення
досліджень в області генної регуляції й вивчення молекулярного механізму
виникнення ракових новотворів.
Чи відрізняються генетично модифіковані культури по смаку й
зовнішньому вигляді від звичайних? Анітрошки. Їхня відмінність розпізнається
лише на рівні ДНК. Принцип генно-інженерного методу полягає в тім, що із
клітини-донора виділяють гени, відповідальні за те або інша властивість, і
вводять у клітини сільськогосподарських культур або тварин. Модифікована
клітина потім стає основою для створення нового виду Рослини або тварини, що
володіє бажаними властивостями.
Так, наприклад, генетично змінена соя має імунітет до
хімічних гербіцидів. Вражаючи бур'яни, вони не заподіюють ніякої шкоди самій
корисній рослині. В Азії, наприклад, виростає мутованой рис, що добре
переносить посуху й засолені ґрунти. Швейцарський концерн «Новартис» почав
вирощувати кукурудзу, що виділяє власна отрута проти польових шкідників. В
Америці виведений картопля, що при прожарюванні усмоктує менше жиру. А
голландська картопля з «досадженим» геном дуже стійка до вірусних захворювань.
У цей час створений ряд трансгенних культур: соя, кукурудза, бавовна, рапс,
томати, картопля. Світовий товарообіг цих культур за період з 1995 по 1998 р.
зріс в 20 разів і в 1998 р. склав 1,2-1,5 млрд. дол. За експертними оцінками,
уже в 2000 р. ця сума досягла 3 млрд. дол. Список сортів трансгенних рослин, що
пройшли польові випробування й уже оброблюваних у Європі й Америці, росте так
само стрімко, як і пов'язані із цією галуззю науки слухи, страхи й надії
людства.
Правда, уряди й громадськість у різних країнах ставляться до
проблеми трансгенеза по-різному. Якщо, наприклад, у США розширюються рамки
законопроектів, що допускають включення продуктів трансгенного сільського господарства
в комерційний оборот, а самі вирощують такі рослини на більших площах, то в
країнах Європейського союзу поки тільки визнають необхідність науково
обґрунтованої оцінки безпеки рослин і тварин, одержуваних у результаті
трансгенеза.
Уже сьогодні трансгенні продукти в значній мірі становлять
харчування американців (сир, м'ясо, ті ж гамбургери, не говорячи про сою,
кукурудзу, томати, картоплі). Поля трансгенних кукурудзи й картоплі займають у
США й чи Канаді не 30 % посівних площ.
Більше того, у тих же Сполучених Штатах дозволено не
вказувати на етикетці походження харчової сировини, оскільки творці глибоко
впевнені (і змогли це довести своєму Міністерству охорони здоров'я) у безпеці
трансгенної їжі.
Трохи інший - більше критичний - підхід у європейців. Він
викликаний поруч факторів. Перший - чисто економічний, пов'язаний з
конкуренцією й захистом ринку від американців, що лідирують у біотехнологіях.
Інші фактори пов'язані з так званими протестами різних громадських організацій
проти виробництва трансгенних продуктів.
Неформальним світовим лідером у боротьбі з генетично зміненою
продукцією стала Великобританія, що після історії з «коров'ячим сказом»
проявляє особливу розбірливість у відношенні того, що надходить на її обідній
стіл. Сам принц Чарльз, відомий своєю пристрастю до фермерства, написав більшу
статтю в лондонську газету «Дейли мейл», у якій обрушився на генетично
модифіковані продукти і їхніх виробників. «Людство вторгається в заборонну
зону, що належить Богу й одному тільки Богу, - уважає принц Чарльз, - і може
бути за це жорстоко покарано... Чи потрібна нам у цій країні генетично
модифікована їжа? На підставі того, що ми про неї знаємо й що ми дотепер
бачили, можна із упевненістю сказати - не потрібна зовсім!» - викликує принц.
Здавалося б, після такої потужної антиреклами навряд чи в
когось із англійців повинне виникнути бажання споживати «трансгенні культури».
Проте британський уряд, що підтримує тісні зв'язки з біотехнологічними
компаніями, робить все можливе, щоб перекласти негативне відношення до
«диявольської їжі». У ситуацію втрутився прем'єр-міністр Тоні Блер, що кинув
свій авторитет на чашу ваг у суперечці прихильників і супротивників
«трансгенних культур». «Генетично модифікована їжа може бути дешевше й
здоровіше, - заявив Блер у звертанні до націй. Прем'єр-міністр повідомив, що
він сам і його родина із задоволенням їдять такі продукти.
У цілому супротивники генетично модифікованих продуктів в
Beликобритании поки беруть гору над її прихильниками. Компанії «Нестле», «Макс
енд Спенсер», «Уайтроуз» заявили, що починають шукати постачальників «чистих»
продуктів. А найбільші мережі супермаркетів «Теско», «Юнілевер», «Дж.Сайнсбери
Плс» оголосили про те, що забирають зі своїх полиць будь-яку продукцію, де є
хоч один компонент, створений генною інженерією.
Тим часом на Заході найбільш затяті супротивники
біотехнології активно пручаються вторгненню генетики в сферу споживання: по
ночах, проникнувши на експериментальні поля, ріжуть під корінь урожай або
топчуть посіви. А західні союзи споживачів домагаються того, щоб продавці
постачали їстівних мутантів спеціальними етикетками: "нехай покупець сам
вирішує, які продукти купувати - звичайні або генетичні". Росії прийде
самої потурбуватися про власну безпеку.
15 травня 1999 р. 36 американських сенаторів -
більше третини Сенату США - направили президентові Клінтону лист, у якому в
різкій формі зажадали, щоб він устав на захист американських виробників
генетично модифікованих продуктів. Президент повинен запобігти « торговельну
війну, що насувається, з Європи і підняти питання на майбутній зустрічі країн
«великої вісімки» у Бонні, заявили сенатори. Вони зажадали від Клінтона також
зайняти тверду позицію на всіх інших міжнародних форумах.
Лист сенаторів збігся за часом з оприлюдненим у Лондоні
висновком британських лікарів, які заявили, що генетично змінені продукти
повинні мати спеціальне маркування й перероблятися харчовою промисловістю
окремо, не змішуючись із «нормальними» харчовими інгредієнтами. Якщо США
відмовляться виконати ці умови, Великобританія, на думку лікарів, повинна
повністю заборонити ввіз американських генетично модифікованих продуктів.
Страсті навколо генетично зміненої їжі сьогодні киплять не тільки в Європі,
причому вони стосуються не тільки зернових, овочів, але й м'яса.
Саме тому в європейському підході до трансгенезу велике
значення надається роз'яснювальній роботі. Стурбованому населенню втолковуєтся,
зокрема, що в трансгенні рослини ніколи не вводили й не збираються вводити ген
людини або тварин. При цьому основні страхи самих медиків і біологів із приводу
трансгенеза зв'язані, по-перше, з непередбаченими ефектами прояву гена - іншими
словами, з можливостями зміни хімічного складу, зниження харчової цінності
продукту й інших його споживчих властивостей.
Крім того, у результаті генної модифікації можуть
синтезуватися якісь компоненти, що викликають алергійні реакції або з'являться
небезпечні з'єднання, що володіють мутагенним, канцерогенним або токсичним
ефектом,
Росія теж не поспішає налагоджувати масові вирощування й
продаж трансгенних рослин - чи те з розсудливого консерватизму, чи те через
відсутність засобів і на науку, і на сільське господарство.
Для того щоб упорядкувати й взяти під державний контроль ввіз
у Росію генетично модифікованих продуктів, з 1 липня 1999 р. Мінздрав РФ вирішив реєструвати імпортні продукти харчування, виготовлені із сировини з
генетично зміненою структурою. Імпортери, що ввозять таку продукцію в Росію,
зобов'язані сертифікувати її в НДІ харчування РАМН або в державному центрі
«Біоинженерія» РАН. Саме в цих двох організаціях проводиться медико-генетична
експертиза. Якщо експерти порахують ті або інші продукти безпечними, імпортер
одержить документ, що дозволяє ввозити їх у Росію.
«Реєстрація генетично модифікованих продуктів - міра,
покликана попередити появу на прилавках їжі, що несе погрозу здоров'ю людини»,
- заявив журналістам головний санітарний лікар Російської Федерації Г.Г.
Онищенко. За його словами, дотепер лікарі в нас не зіштовхувалися із захворюваннями,
викликаними вживанням цих продуктів. Проте «це не виходить, що вони нешкідливі,
просто люди не завжди звертаються до лікарів».
«Ми буде цікавити та сама «генна вставка», завдяки якій
рослина або тварина одержали нову властивість. Наша мета - неї
охарактеризувати», - уважає директор центра «Біоинженерія» РАН К.Г. Скрябін.
За словами К.Г. Скрябіна, в очолюваному їм центрі є база
даних з інформацією про всіх зареєстровані у світі трансгенних культурах.
Вітчизняних трансгенних культур, дозволених для комерційного
використання, поки немає. На даному етапі в Росії проводяться випробування
восьми сортів таких рослин - сої, кукурудзи, цукрового буряка, картоплі,
причому із трьох сортів картоплі всього один - вітчизняний.
«На початку XXI століття в країні складається важка
економічна ситуація, а підвищити врожай ми можемо тільки за допомогою
трансгенних культур. Завдання вчених - зробити так, щоб вони були економічно
ефективні й безпечні», - відзначає акад. РАСХН К.Г. Скрябін.
У цей час у багатьох закордонних і вітчизняних лабораторіях
отриманий ряд трансгенних тварин з новими біологічними й технологічними
властивостями. При цьому вивчається вплив генної модифікації на безпеку таких
тварин і їхня можлива комерціалізація. Ці широкі дослідження активно ведуться
на вівцях і великій рогатій худобі в Австралії, США, Англії.
З 1996 р. у Росії діє закон «Про державне регулювання в
області генної інженерії», у якому визначені стандарти безпеки генетично
модифікованих продуктів. Наприклад, посадити трансгенние рослини для
випробувань можна тільки з дозволу Міжвідомчої комісії із проблем
генно-інженерної діяльності на іспитових полях, оточених забором, з охороною.
Введення системи контролю й всебічної експертизи харчової
продукції з генетично модифікованих джерел викликано в першу чергу турботою про
безпеку людей, - уважає заступник директора Медико-генетичного наукового центра
РАМН, д-р наук, проф. С.А. Шишкін. Убудовані в генетичний код мікроорганізмів,
рослин і тварин генно-інженерні конструкції теоретично можуть бути
небезпечними. Важко сказати, у яких саме формах це може виявитися. Приміром,
людина, що вживала продукти або ліки на основі такої сировини, може перестати
адекватно реагувати на певні ліки, тобто придбати лікарську стійкість. Тому всі
подібні продукти повинні проходити всебічну експертизу. Дуже важливо, що
проблема поставлена саме зараз, поки суспільство ще не зіштовхнулося на
практиці з теоретично можливими труднощами. Наші вчені давно стурбовані
можливими наслідками генної інженерії.
Тільки після перевірки
на мутагенність і канцерогенність, а також надання матеріалів досліджень на
тваринах і людях-добровольцях, підприємства-виробники й імпортери такої
продукції можуть розраховувати на одержання офіційного реєстраційного
посвідчення. Воно буде видаватися компетентними органами на 3 роки, а після
благополучної перереєстрації - на 5 років. Після того як новий порядок почне
діяти, споживачі зможуть жадати від продавця генетично модифікованої продукції
офіційне свідчення безпеки його товару.
Варто підтримувати декларацію Громадської організації
"лікарі й учені проти модифікованих за допомогою генної інженерії
продуктів харчування", у якій звернене увага громадськості на наступне:
·
НЕПРАВИЛЬНО
експлуатувати технологію, що може непередбачено викликати поява небезпечних для
здоров'я речовин, перш ніж не буде ретельно вивчена можливість такого ризику.
·
НЕПРАВИЛЬНО
експлуатувати технологію, що може зробити необоротний вплив на навколишнє
середовище, перш ніж не буде доведено, що дана технологія не заподіє серйозного
збитку навколишньому середовищу.
·
НЕПРАВИЛЬНО
піддавати людей і навколишнє середовище навіть найменшої небезпеки, зважаючи на
те, що в цей час наявні продукти харчування, модифіковані за допомогою генної
інженерії, не представляють цінності або вона незначна.
·
НЕПРАВИЛЬНО
сьогодні виправдувати експлуатацію потенційно небезпечної технології, приводячи
в обґрунтування науково недоведена думка, що ця технологія може дати корисні
продукти в майбутньому.
Однак це не означає, що дослідження в цій області й дослідній
перевірці їхніх результатів повинні бути припинені. Звісно ні. Особливої уваги
заслуговують наступні аспекти. Перший - медико-генетичної, оцінюючої зміни в
генотипі даної рослини або тварину й можливість їхній наступного впливу на
людину. Другий - технологічний, що встановлює, що отриманий цим методом продукт
не міняє свої технологічні властивості.
І третій - медико-біологічна оцінка впливу трансгенних
продуктів на імунний статус організму, систему ферментного захисту клітини.
Тільки після вивчення якісних показників продуктів генної інженерії, у тому
числі на декількох поколіннях лабораторних тварин, почнеться процес державної
реєстрації й дозволу до широкого використання при обов'язковому подальшому
моніторингу. Таке думка академіка РАМН В.А. Тутельяна.
Застосування продуктів харчування, отриманих за допомогою
генної інженерії, настільки серйозно, що навіть при наявності всіх розв'язних
документів, необхідна певна законодавча база, що дозволяє у випадках появи
негативних наслідків з юридичної точки зору вирішити проблему, що створилася.
1.
Теоретичні
основи генно-модифікованих продуктів
Генетична інженерія - це нова галузь молекулярної біології,
яка розробляє методи перенесення генетичного матеріалу від одного живого
організму до іншого з метою одержання нової генетичної інформації та управління
спадковістю.) Розвиток генетичної інженерії пов'язаний з досягненнями сучасної
генетики, мікробіології, біохімії та інших наук. Початок генетичної інженерії
покладений П.Бергом в 1972 р., який здержав перші гібридні (рекомбінантні) ДНК.
У нас використовують два терміни - генетична інженерія та
генна інженерія. Слід зазначити, що назву "генетична інженерія"
використовують в більш широкому понятті, тобто зона включає і генну інженерію.
При цьому до генної інженерії не відносять перебудову генома звичайними
генетичними методами, тобто мутаціями, рекомбінаціями.
Раніш для
переносу генів використовували в основному метод статевої гібридизації.
Генетична інженерія дозволяє, на відміну від статевої гібридизації, вводити в
геном організму тільки конкретний ген будь-якого походження поза зв'язку зі
статевою сумісністю донора та реципієнта, виключає необхідність довгострокових
беккросів та відборів для видалення непотрібних ознак та, в кінцевому рахунку,
розширює можливості, прискорює та значно полегшує проблему покращення сортів та
порід.
За останні роки генетична інженерія досягла істотного прогресу. Центр досліджень
перейшов з прокаріотичних на еукаріотичні системи. Інтенсивно досліджуються
структура та функція генів, які визначають економічно важливі ознаки
сільськогосподарських рослин та тварин.
Зараз вже виділено та детально охарактеризовано біля сотні
різних структурних генів. Методами молекулярної біології, в основному шляхом
синтезу кДНК на ЇРНК, отримані копії геномних генів (клони), досліжуються
оптимальні шляхи перенесення в організм чужорідної генетичної інформації, її
експресія в новому генетичному середовищі, а також засоби виявлення та відбору трансформованих
генотипів.
Перенесення генів здійснюється у багатьох видів рослин шляхом
використання як технології рекомбінантної ДНК, так і соматичної гібридизації.
Сформувалися два
альтернативних напрямки у використанні технології рекомбінантної ДНК: введення
генів шляхом векторних систем та пряме введення ДНК до рослинних клітин. Ці
технології знаходяться на стадії модельних експериментів, однак ряд розробок
вже мають практичне використання в селекції. Найбільш тріумфальні успіхи
генетичної інженерії пов'язані з мікробіологічним синтезом просто організованих
білків тваринного (людського) походження (гормони, ферменти, інтерферон та
ін.).
З точки зору
операційної технології рекомбінантні ДНК можна поділити на декілька головних
компонентів: індивідуальні гени, регуляторні елементи, векторні та селекційні
системи.
Таблиця 1 Прогрес генетичної інженерії в різних сферах біології.
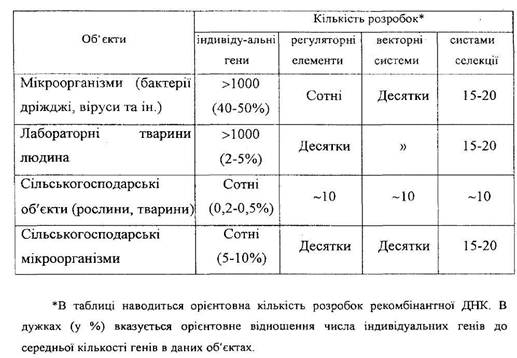
Перенесення та
експресія індивідуальних добре охарактеризованих генів, власне, і складає
кінцеву мету будь яких генно-інженерних маніпуляцій. Регуляторні елементи у
представників різних родів, не кажучи вже про більш значні таксономічні
одиниці, можуть значно розрізнятися. Тому перед перенесенням гену (наприклад,
бактеріального) в чужорідне генетичне оточення (наприклад, в рослинну клітину) в
гені необхідно замінити
бактеріальні регуляторні елементи на рослинні, так як в іншому випадку
перенесений ген не буде експресуватися. Подібній модифікації необхідно н ряді
випадків піддавати також і структурну частину ієну, оскільки у рослин та тварин
вона в типовому випадку складається з так званих інтронів та екзонів, при цьому
тільки останні ділянки гена кодують поліпептидний ланцюг білку, а перші - вирізаються
(видаляються) в процесі дозрівання ДНК. Імовірно, що ген з невидаленими інтронами,
що належить до оукаріотичної клітини, не може кодувати синтез відповідного білку
в клітині бактерії. Третім істотним елементом генно-інженерних маніпуляцій є спеціальні
пекторні системи, які забезпечують високоефективне перенесення чужорідного гену
в реципієнтну клітину та мого стабільне закріплення або шляхом інтеграції з
клітинною ДНК, або шляхом набуття статусу автономного ядерного або
цитоплазматичного елементу. Та, нарешті, четвертим важливим фактором технології
рекомбінантної ДНК є система селекції або детекції тих химерних клітин або організмів,
в які включився та функціонує чужорідний ген.
Для
вирішення головних завдань біотехнології необхідно сконцентрувати увагу на
питанні використання індивідуальних генів, молекулярних механізмів формування
основних селекційно-вагомих показників та регуляторних елементів, так як вони
визначають експресію генів в онтогенезі еукаріот.
Особливу увагу слід приділити розробці складових технології
рекомбінантної ДНК, в першу чергу різноманітних векторних систем та систем
селекції, при цьому не допустити розриву між фундаментальними та прикладними
розробками; для цього необхідно забезпечити пріоритетність науковим працям в
галузі мікробіології та вірусології. Тоді можна очікувати, що генетична
інженерія стане лідируючою наукою, яка буде використовуватися в технологічних
процесах отримання нових біологічно активних речовин, сироваток, різноманітних
ліків та іншого
При обговоренні переваг методів клітинної та генетичної
інженерії для створення на їх базі сучасних напрямків біотехнології
неодноразово висловлювалась думка, що з двох біоінженерій клітинна по ряду причин
забезпечує більш швидке отримання практично вагомих результатів. Це
висловлювання, яке є правильним у загальній формі, потребує істотних доробок.
Дійсно, строки реалізації ряду вагомих біотехнологічних розробок на базі
методів клітинної інженерії знаходяться в межах початку та кінця 90-х років, а
деякі з них впроваджуються в практику вже зараз. Так, наприклад, безвірусне насінництво ряду сільськогосподарських культур
або трансплантація ембріонів с/г тварин. Технологія рекомбінантної ДНК, в
протилежність напівемпіричним підходам клітинної інженерії, спроможна реалізовувати
свій вагомий науковий потенціал тільки при детальній молекулярно-біологічній та
генетичний вивченості об'єктів та господарсько вагомих ознак, які є предметом генно-інженерного
експерименту. Це як раз і зумовлює строки реалізації більшої частини розробок генетичної
інженерії на початок 2000-х років.
Однак, існує можливість
(і вона частково використується) для значного прискорення результатів генетичної
інженерії. Джерелом цього прискорення можуть стати інтенсивні дослідження
мікроорганізмів та вірусів, які мають практичне значення, а також стабільний пошук
простих моногенних ознак рослин та тварин, за якими просто вести селекцію. У цьому
випадку мова не йде про мікробіологічний синтез фізіологічно активних речовин
на основі технології рекомбінатної ДНК типу гормонів, антибіотиків та ферментів,
які використовуються у виробництві. У загальній формі віруси та мікроби
відіграють дуже важливу роль у життєдіяльності тварин та рослин, виступаючи в
ролі симбіонтів або паразитів. Тому, маніпулюючи з просто організованим
генетичним матеріалом вірусів та мікробів, можливо в значних масштабах впливати
на життєдіяльність та продуктивність цих об'єктів, обходячи обмеження, які віддаляють
строки реалізації розробок генетичної інженерії при безпосередніх маніпуляціях
з генетичним матеріалом рослин та тварин.
На порозі польових випробувань знаходиться проект, націлений на створення "біологічних
пестицидів" - рекомбінантних клітин Pseodomonas fluorescens, які входять до
асоційованої сапрофітної мікрофлори ряду культурних рослин, куди вбудований ген
ентомопатогенного токсину Васіllus thiringiensis. Можна вказати також на успішні
спроби боротьби з ранніми заморозками шляхом генетичної модифікації клітин Pseodomonas
syringae , які являють собою сапрофітну мікрофлору багатьох рослин, яка
відповідає за уражуючий ефект ранніх заморозків. Особливий білок, що секретується
цими бактеріями, служить центрами кристалізації льоду, в результаті чого вода
на поверхні рослини замерзає, як звичайно, не при -4°, а при температурі 0°С. Рекомбінантні
клітини Рs. syringae, які загубили здатність секретувати білок-кристалізатор льоду,
будуть першими химерними організмами, які вийдуть з лабораторії у довкілля.
Значну практичну
вагу для інтенсивних біотехнологій має стійкість культурних рослин до
гербіцидів, яка може досягатися двома шляхами: або за рахунок значного
руйнування гербіциду в клітині, або за рахунок непроникненності клітин для конкретного
гербіциду. Зараз гербіцидостійкість може бути досягнена шляхом перенесення в
культурні рослини або бактеріального гену, або мутантного рослинного гtну, що
руйнують такі розповсюджені гербіциди, як гліфосат та сульфоніл-сечовина, У
процесі розробок знаходяться і рекомбінантні плазміди, які спроможні
попереджувати утворення корончатих галів у рослин. Строки реалізації інших
генно-інженерних проектів, так чи інакше пов'язаних з мікроорганізмами,
відносяться до початку третього тисячоліття.
Що стосується
генів виших еукаріот, то відносно швидко можуть бути реалізовані інтерфероновий
та гормональний проекти, як у формі продуктів мікробного синтезу, так і у формі
генів, що переносяться до організму. У випадку інтерферону продукт мікробного
синтезу в ряді експериментів підвищував стійкість рослинних клітин до
фітовірусних інфекцій, і можна розраховувати, що подібний ефект забезпечить
безпосереднє введення інтерферонового гену до рослин. Препарати типу гормону
росту при введенні тваринам стимулюють їх ріст. Отримання гігантських форм може
бути досягнено, як це продемонстровано в експериментах на лабораторних
тваринах, також при введенні гена гормону росту, який забезпечує посилений
синтез цього регулятора в організмі. Інші генно-інженерні проекти наведені в
таблиці 3 та розраховані на більш довгострокові терміни реалізації.
ГЕН ЯК ЕЛЕМЕНТАРНА ОДИНИЦЯ
СПАДКОВОСТІ
Раніше вважалося, що гени являють собою частину хромосом і є
неподільною одиницею з такими ознаками: здатністю визначати ознаки організму,
здатністю до рекомбінації, тобто до переміщення з однієї гомологічної хромосоми
в іншу при кросинговері, та здатністю до мутації з утворенням нових алельних
генів. Надалі виявилося, що ген - це складна система, в якій зазначені
особливості неподільні.
Ген складається з окремих ніби сходинок, що блискуче підтвердилося
новими дослідженнями. Ген являє собою частину молекули ДНК і складається з
сотень пар нуклеотидів. Ген як функціональну одиницю американський генетик С.Бензер запропонував назвати
цистроном. Саме цистрон визначає послідовність амінокислот у коленому
специфічному білку.
Цистрон у свою чергу підрозділяється на гранично малі в
лінійному вимірі одиниці - рекони, які здатні до рекомбінації при кросинговері.
Виділяють, крім того, поняття мутон - це найменша частина гена, здатна до
мінливості (мутації). Розміри рекону та мутону можуть становити одну або кілька
пар нуклеотидів, цистрону -сотні і тисячі пар нуклеотидів.
Виявляється, що
різні функції -гена пов'язані з відрізками ланцюга ДНК різного розміру. Ген має
складну структуру, в середині якої можуть відбуватися процеси мутації та
рекомбінації. Виявлені також гени, які не контролюють синтез визначених білкіп,
але регулюють цей процес. Таким чином, виникла необхідність роз'єднати гени на
дві категорії: структурні та функціональні.
Стурктурні гени визначають послідовність амінокислот у
поліпептидному ланцюзі (тобто, колінеарність). У тих бактерій, де вони вивчені,
структурні гени, як правило, розміщені в хромосомі в послідовності відповідно
до кодованих реакцій.
Функціональні гени, мабуть, не утворюють специфічних
продуктів, які можна виявити в цитоплазмі. Ці гени контролюють функцію інших
генів. Один з функціональних генів одержав назву гена-оператора.
За уявленнями, введеними в науку Ф.Жакобом та Ж.Моно,
ген-оператор і ряд структурних генів, розміщених поряд у лінійній
послідовності, складають оперон. Оперон - це одиниця зчитування генетичної
інформації, тобто з кожного оперона знімається своя молекула ІРНК. Функція
гена-оператора, в свою чергу, регулюється геном-регулятором. Він кодує синтез
білка-репресора. Наявність чи вісутність цього білка, який приєднується до
гена-оператора, визначає початок або припинення зчитування інформації.
Колінеарність - властивість, зумовлена відповідністю між послідовностями кодонів нуклеїнових кислот та
амінокислот поліпептидних ланцюгів. Тобто колінеарність - це властивість, яка
створює таку саму послідовність амінокислот у білку, в якій відповідні кодони
розміщуються в гені. Це значить, що положення кожної амінокислоти у
поліпептидному ланцюзі залежить від особливої ділянки гена. Генетичний код
вважається колінеарним, якщо кодони нуклеїнових кислот та відповідні їм
амінокислоти в білку розміщені в однаковому лінійному порядку.
Явище колінеарності доведено експериментально. Так,
встановлено, що серповидноклітинна анемія, при якій пошкоджується будова
молекули гемоглобіну, зумовлюється зміною розміщення нуклеотидів у гені, який
відповідає за синтез гемоглобіну.
Завдяки концепції колінеарності можна визначити приблизний
порядок нуклеотидів всередині гена та в ІРНК, якщо відомий склад поліпептидів.
Навпаки, визначивши склад нуклеотидів ДНК, можна прогнозувати амінокислотний
склад білка. Виходячи з цього, зміна порядку нуклеотидів у гені (його мутація)
веде до зміни амінокислотного складу білків.
Під впливом
різних фізичних та хімічних агентів, а також при нормальному біосинтезі білка в
клітині можуть виникати пошкодження. Виявилося, що клітини мають механізми
виправлення пошкоджень у нитках ДНК. Така їх здатність одержала назву
репарації.
Вперше здатність до репарації була виявлена у бактерій, на
які впливали ультрафіолетовими променями. Внаслідок опромінювання цілісність
молекул ДНК порушується, оскільки в ній виникають димери, тобто з'єднані між
собою сусідні піримідинові основи. Ці димери виникають між: двома тимінами,
тиміном та цитозином, двома цитозинами, тиміном та урацилом, цитозином та
урацилом, двома урацилами. Проте опромінені клітини на світлі виживають
набагато краще, ніж у темряві. Після ретельного аналізу причин цього
встановили, що в опромінених клітинах на світлі відбувається репарація (явище
світлової репарації). Вона здійснюється спеціальним ферментом, який активується
квантами видимого світла. Фермент з'єднується з пошкодженою ДНК, роз'єднує
зв'язки, що виникли у димерах, та відновлює цілісність ДНК.
Пізніше була виявлена темнова репарація, тобто властивість
клітин ліквідувати пошкодження ДНК без участі видимого світла. Темнова
репарація здійснюється комплексом із п'яти ферментів: який "впізнає"
хімічні зміни на ділянці в ланцюзі ДНК; здійснює "вирізування" пошкодженої
ділянки; видаляє цю ділянку; синтезує нову за принципом комплементарності та
з'єднує кінці старого ланцюга і відновленої ділянки.
Під час світлової
репарації виправляються тільки ті пошкодження, які виникають під впливом
ультрафіолетових променів, при темповій - такі, що виникають під дією
іонізуючої радіації, хімічних речовин та інших факторів. Темнова репарація
виявлена як у прокаріотів, так і в клітинах еукаріотів (тварин та людей), у
яких вона вивчається в культурах тканин. Питання про те, чому одні пошкодження
репаруються, а інші ні, залишається відкритим. Якщо репарація не відбувається,
то клітина гине або виникає мутація.
1.2 ГЕНЕТИЧНИЙ КОД
З моделі структури ДНК, запропонованої Уотсоном і Кріком,
відомо, що генетична інформація передається за допомогою якоїсь специфічної
послідовності нуклеотидів її молекули. Вперше питання про код було поставлене
Гамовим у 1953 р.
Початок прямого
генетико-біохімічного аналізу кодонів було покладено в 1961 р. Ніренбергом та
Маттеї, які створили найпростіші синтетичні полімери й замінили ними нативні
молекули іРНК в системі компонентів клітин бактерій та суміші амінокислот. У
суміші кожного типу одна з амінокислот була помічена радіоактивним вуглецем
С14, інші дев'ятнадцять не мали позначення. Було встановлено, що синтетичний
полірибонуклеотид, складений тільки з урацилу (поліуридилова кислота - УУУУУ), визначає
синтез білка, в
якому кожна амінокислоти була фенілаланіном. Виходячи з цього, встановили, що
триплет УУУ є кодоном для фенілаланіну.
У наступних подібних експериментах було визначено, що
поліаденінова кислота містить код для лізину, а поліцитидинова - для проліну.
Наступні досліди, де як штучні ІРНК виступали полінуклеотиди змішаного складу
(наприклад, полі-АУ), виявили зв'язок між рядом інших поєднань нуклеотидів та
конкретними амінокислотами.
Синтетичні полінуклеотиди створюють з використанням ферменту
полінуклеотидфосфорилази, який зв'язує нуклеотиди у випадковому порядку. Для
перших експериментів цього було достатньо, оскільки в них використовували синтетичні
полінуклеотиди, складені з одного типу нуклеотидів. Потім були знайдені шляхи
складніших синтезів молекул з різних нуклеотидів із різними положеннями.
Нову методику
широко використав Очоа із співробітниками, що дало їм можливість визначити
триплети для всіх 20 амінокислот (табл.4). При цьому було зазначено, що код має
вироджений характер, який означає здатність для однієї й тієї ж кислоти бути
кодованою кількома різними триплетами. Наприклад, є амінокислоти, які мають по
шість кодонів; п'ять амінокислот, кожна з яких кодується чотирма різними
кодонами. Так, аланін кодується триплетами ГЦУ, ГЦЦ, ГЦА, ГЦГ, куди в усіх випадках
входять нуклеотиди цитозину та гуаніну. Поряд з тим є амінокислоти, що
кодуються трьома, двома і тільки дві - одним триплетом азотистих основ.
Крім того, триплети УАА, УАГ, УГА не кодують амінокислоти, а є
своєрідними "крапками" в процесі зчитування інформації. Якщо процес синтезу
наближається до такої "крапки" в молекулі ДНК, синтез даного поліпептидного
ланцюга припиняється. Після "крапки" починає синтезуватися нова молекула
білка. Процес зчитування інформації відбувається в одному і тому ж напрямі. Так,
якщо в молекулах азотисті основи розміщені в такому порядку: ААА, ЦЦЦ, УГУ, УЦУ,
то це значить, що закодовані такі послідовно розміщені амінокислоти: лізин
(ААА), пролін (ЦЦЦ), цистин (УГУ), серін (УЦУ). Саме в цій послідовності вони повинні
розміщуватися в поліпептидному ланцюзі при синтезі білка. Якщо в першому
триплеті ІРНК буде втрачено один аденін, то порядок основ набуває вигляду ААЦЦЦУГУУЦУ.
Внаслідок цього склад всіх триплетів змінюється. Так, перший стане не ААА, а
ААЦ. Подібний триплет кодує амінокислоту аспарагін, а не лізин, як було раніше.
Другий стане вже не ЦЦЦ, а ЦЦГ і так далі. У деяких умовах іn vitro код може бути двозначним, тобто один
триплет може кодувати кілька амінокислот. Кодон УУУ в звичайних умовах кодує амінокислоту
фенілаланін. Проте якщо рибосоми обробити
стрептоміцином, то цей кодон починає також кодувати ізолейцин і серин. Знижена
температура та висока концентрація іонів Мg++ також зумовлюють
двозначність у дії кодонів.
Таблиця
Генетичний код послідовності нуклеотидів у триплетних кодонах
інформаційної РНК, який визначає певну амінокислоту
| Перший |
|
|
Третій нуклеотид |
(на 3'- кінці |
кодону) |
| нуклеотид (на 5'-кінці кодону) |
Другий гуклео-тид |
У |
|
ц |
|
А |
|
г |
| У |
У |
Фен |
|
Фен |
|
Лей |
|
Лей |
|
|
ц |
Сер |
|
Сер |
|
Сер |
|
Сер |
|
|
А |
Тир |
|
Тир |
|
Термінатор (знак закінчення) |
|
Термінатор (знак закінчення) |
|
|
Г |
Цис |
|
Цис |
|
Арг |
|
Три |
|
|
У |
Лей |
|
Лей |
|
Лей |
|
Лей |
| Ц |
Ц |
Про |
|
Про |
|
Про |
|
Про |
|
|
А |
Гіс |
|
Пс |
|
Глі |
|
Глі |
|
|
Г |
Арг |
|
Арг |
|
Арг |
|
Арг |
|
|
У |
Іле |
|
Іле |
|
Іле |
|
Мет |
| А |
Ц |
Тре |
|
Тре |
|
Тре |
|
Тре |
|
|
А |
Асп |
|
Асп |
|
Ліз |
|
Ліз |
|
|
Г |
Сер |
|
Сер |
|
Арг |
|
Арг |
|
|
У |
Вал |
|
Вал |
|
Вал |
|
Вал |
| г |
Ц |
Ала |
|
Ала |
|
Ала |
|
Ала |
|
|
А |
Асп |
|
Асп |
|
Глу |
|
Глу |
|
|
Г |
Глі |
|
Глі |
|
Глі |
|
Глі |
Генетичний код
характеризується неперекритістю. Цей принцип був доведений дослідженням
мутацій, які порушують синтез білків. У випадку перекриття коду зміна в одній
парі нуклеотидів неминуче повинна спричинити порушення в трансляції трьох
амінокислот, бо у коді, що перехрещується, кожний з нуклеотидів входить до
трьох кодонів. Насправді експериментами доведено, що мутації змінюють
транслювання тільки однієї амінокислоти, що чітко вказує на неперекритість
коду. Для поняття принципів генетичного коду значний інтерес являють дані по
заміщенню амінокислот внаслідок зміни всередині триплетів.
У Е. соlі (кишкової палички, яка є в кишечнику всіх
організмів) були одержані шість мутантів, що мали різні дефекти у
триптофансинтетазі, причиною яких стали заміщення гліцину в специфічній точці
поліпептидного ланцюга. Ці мутації відрізняються від попереднього стану зміною
одного нуклеотиду. Якщо ця гіпотеза правильна, то вона може бути перевірена в
дослідах по рекомбінації, оскільки кросинговер всередині триплетів повинен
змінювати його код. Наприклад, схрещування між мутацією В, кодуючою аргінін, та
мутацією С, кодуючою валін, повинні дати рекомбінантні триплети, які будуть
кодувати серин та гліцин: мутант В - УГЦ -аргінін; мутант С - УУГ - гліцин.
У випадку кросинговеру на іншій ділянці (ГЦ і УГ) повинні
з'явитися рекомбінанти - перший блок кросинговеру: ЦГГ - дикий тип - гліцин;
другий -додатковий кросинговер: УУЦ - мутант - серин. У наступних дослідах ці
рекомбінанти були виявлені і повністю відповідали передбаченням.
У випадках
серповидноклітинності гемоглобіну у людини серед 300 амінокислот, які входять
до складу гемоглобіну, тільки одна замінена мутацією. У гемоглобіні С в цьому місці
з'являється інша амінокислота - лізин (рис.1)
(Численними
дослідженнями встановлена дивовижна універсальність генетичного коду. Він
однаково проявляє себе в системах, одержаних з вірусів, бактерій, водоростей та
ссавців. Очевидно, він єдиний для всього органічного світу, що є одним з
найпереконливіших доказів загального походження всієї живої природи.
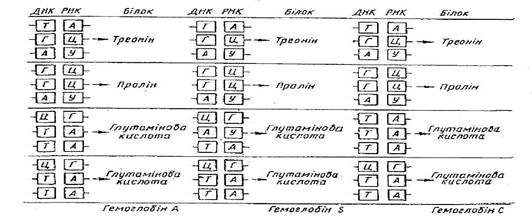
Рис.
1 Зміна нуклеотидів у кодових триплетах у цистроні, що визначає молекулу
гемоглобіну у людини
1.3
СТРУКТУРНА ОРГАНІЗАЦІЯ ГЕНОМА
Під геномом розуміють
сукупність носіїв спадкової інформації, що міститься в клітині. ДНК прокаріот
оточена слабо зв’язаним з нею основним білком і ніяк структурно не організована.
Характерна морфологія еукаріотичних хромосом свідчить, що вони організовані значно
складніше, ніж: геноми прокаріотичних клітин. У еукаріотів більша частина ДНК знаходиться
у міцному комплексі з білками та утворює нуклеопротеїдні волокна, які називаються
хроматином. У переважній більшості клітин хроматинові білки представлені
гістонів. Гістоні –цс невеликі за розміром (50-200 амінокислотних залишків)
основні білки з позитивним зарядом (зумовлений наявністю трьох амінокислот:
аргініну, лізину, гістидину). Утворення комплексу з ДНК (що має негативний заряд)
відбувається за рахунок іонних зв’язків між; фосфатною групою полінуклеотидного
ланцюга та аміногрупою поліпептиду. Гістоні розділяють на п’ять типів: Н1, Н2А,
Н2В, НЗ, Н4, які відрізняються один від одного кількістю амінокислот та відношенням
лізин : аргінін. Цікаво, що структура гістонів НЗ та Н4 з проростків гороху і з
тімусу теляти, як довели Сміт та Де Ланж, дуже подібні, тобто послідовність
амінокислот збереглася протягом приблизно 3-6*108 років з часу
розділення всього живого на рослини та тварини. Ця консервативність свідчить, що
зазначені гістони виконують дуже важливу функцію, яка виникла на початку
еволюції еукаріот і збереглася до нашого часу. Білкам властива здатність до
зміни заряду, форми молекул, до утворення водневих зв’язків, що може мати
важливе значення у регуляції доступності ДНК до реплікації та транскрипції.
Слід зазначити, що, на відміну від ядерної ДНК, ДНК
мітохондрій та хлоропластів не зв’язана з гістонів (як ДНК прокаріот), що
підтверджує гіпотезу симбіотичного походження цих органоїдів.
Виходячи з даних, одержаних різними методами, Корнберг (1974)
висловив припущення, що хроматин складається з повторюваних субодиниць, кожна з
яких містить 200 пар нуклеотидів та по дві молекули гістонів Н2А, Н2В, НЗ, Н4.
Повторювані одиниці називають нуклеосомами. Більша частина ДНК намотана на
гістонову серцевину, решта, так звана міжнуклеосомна ДНК, з’єднує сусідні
нуклеосоми та забезпечує гнучкість гістонів нитки. Таким чином, хроматинова
нитка являє собою гнучкий ланцюг гістонів, що нагадує намистини на нитці.
В 60-х роках цього століття почались інтенсивні дослідження
по локалізації конкретних генів на хромосомах для побудови хромосомних карт. Як
встановлено, в геномі людини нараховується близько 500 тис. різних структурних
генів, тобто генів, в яких закодована інформація про амінокислотну
послідовність білків; кількість ДНК в ядрі клітини така, що відповідає числу
генів, яка в 50-100 раз більша.
Значна кількість ДНК приходиться на повторювані послідовності
нулеотидів, які можуть грати в хромосомі регуляторну, структурну або
функціональну роль.
Реєструючи порушення, які викликаються мутаціями генів,
вдалося виявити більше 900 генних локусів із загального числа 500 тис.
структурних генів (геном людини), до якого входять гени, які кодують всі
ферменти внутрішнього метаболізму, всі структурні білки та всі білки, яким
властиві спеціальні функції, такі як гемоглобіни та імуноглобуліни, а також
ферменти, які беруть участь в утворенні фібрил колагену (її роколагенпептидаза,
глюкозилтрансфераза, лізнлоксидаза) та в утворенні нуклеїнових кислот (ДНК- та
РНК-полімераза).
Істотна частина постульованої кількості генів приходиться на
регуляторні гени.
Положення генних
локусів на хромосомах людини визначали на основі аналізу гетерозигот та
вивчення родин (варіації в межах виду), а пізніше – за допомогою гібридних
клітин, які утворюються в результаті злиття соматичних клітин. Зручним
інструментом досліджень був також метод гібридизації нуклеїнових кислот: таким
засобом на хромосомах 13, 14, 15, 21 та 22 були локалізовані гени 183 та 283
рРНК, а на хромосомі 1 –гени 53 рРНК. Цим же методом встановлено, що гени а- та
р-ланцюгів гемоглобіну знаходяться на хромосомах 2 та 4 або 5. Метод
гібридизації нуклеїнових кислот дозволяє картувати гени гістонів,
імуноглобулінів та колагенів.
Клонування нуклеїнових кислот та наступна гібридизація їх з
фрагментами хромосом також можуть бути корисними для точної локалізації генів
та побудови докладної карти геному.
Результати
подібних досліджень будуть досить важливими для прогресу медицини, який буде
залежати від повного розуміння функціонування геному. Дійсно, ряд хвороб
пов’язані з наявністю дефектів певних генів. Лікування або попередження
генетичних порушень потребує загальних знань структури, функціонування та
регуляції роботи генів.
1.4 КЛОНУВАННЯ ГЕНІВ
Основою
проведення генно-інженерних досліджень є молекула ДНК, що показана на схемах
(рис. 2-3 ).При цьому роботи виконують в певній послідовності : спочатку
виділяють гени з окремих клітин або синтезують їх поза організмом, потім
включають нові гени у вектор, поєднують ДНК гена і вектора і одержують
рекомбінантну ДНК; далі переносять визначені гени в геном клітини-хазяїна,
проводять копіювання і розмноження виділених або синтезованих генів у складі
вектора (клонування генів) і одержують генний продукт шляхом експериментальної
експресії чужорідного гена в реципієнтній клітині. Відомо два шляхи виділення
генів та створення ргкомбінантної ДНК.
Перший - за допомогою хімічного синтезу, а другий, більш поширений,
грунтується на використанні особливих ферментів (рестриктаз), які мають
властивість розпізнавати чужорідну ДНК, що проникла в організм, і розщеплювати
її у відповідних ділянках. В результаті утворюються фрагменти різноманітних
розмірів, які різняться між собою за довжиною. Відомо близько 500 ферментів рестриктаз
і кожний розщеплює ДНК специфічно. Хоча багато з них за специфічністю подібні, проте
кількість сайтів (ділянок) розщеплення становить близько 120. Зазначені ферменти
позбавлені видової специфічності. Завдяки цьому можна поєднувати в одне ціле фрагменти
ДНК будь-якого походження і подолати природний видовий бар'єр. На рисунку 5
схематично зображено дію ферменту на молекулу ДНК, що зумовлює відокремлення
від неї частини нуклеотидів.
Частини й розриви ниток ДНК лігизують (склеюють) за допомогою
ферменту лігази. Особливістю виділених ділянок нуклеотидів (генів) є так звані
липкі кінці, через що їх можна приєднати до ділянок ДНК плазмід (для рослин і
бактерій) або фагів (тварин). Таким чином створюється вектор для перенесення
виділених генів у клітину-реципієнт.
Відомо інший шлях одержання фрагментів ДНК з липкими кінцями.
Для цього виділені або штучно синтезовані ділянки ДНК обробляють ендонуклеазою,
яка укорочує її з обох боків. Потім за допомогою ферменту
полінуклеотидтрансферази добудовують до цих кінців ділянки аденінових і
тимідинових нуклеотидів. Одержану молекулу рекомбінантної ДНК використовують
для перенесення чужорідного гена в бактеріальну клітину. Така схема була
використана для генів інсуліну, інтерферону, імуноглобуліну.
Молекули ДНК,
які мають власний апарат реплікації і здатні доставляти в клітину потрібні
гени, реплікувати їх, були названі векторами. Найбільш поширені вектори – це
різноманітні плазміди, які часто спостерігаються у бактерій. Вектори для клітин
ссавців будуються на основі вірусів, адено- та ретровірусів.
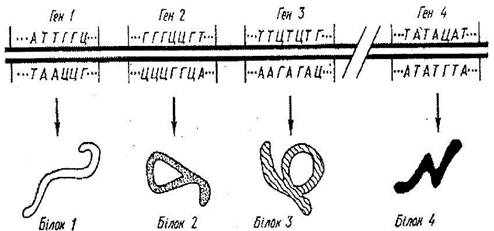
Рис.3 Молекула
ДНК, поділена на гени
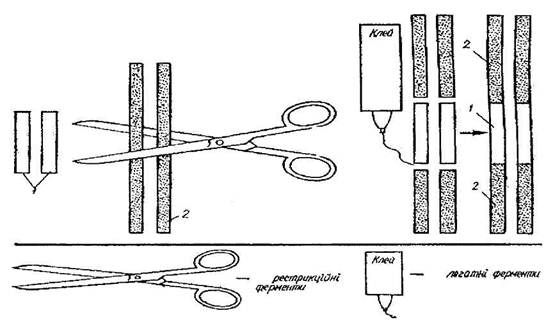
Рис.4
Процес утворення рекомбінантної ДНК
1-бактеріальна
ДНК; 2-рослинна ДНК.
Потрібно
враховувати, що наявність навіть введення гена у хромосому організма-хазяїна ще
не дає можливості одержувати продукти його синтезу.
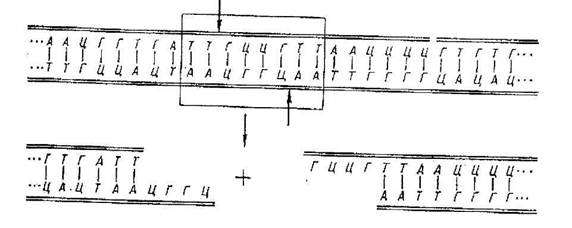
Рис.5
Рестрикційні ферменти розпізнають послідовності, виділені прямокутником, і
вирізують ДНК на місці, зазначеному стрілками
Для
того, щоб ген міг функціонувати, він повинен поряд з частиною, де закодована
інформація, мати ще регуляторну ділянку. Це, так звані промотор та термінатор.
З промотора починається зчитування інформації (транскрипція), а в термінаторі
закодовано закінченння транскрипції з даного гена. Нині створено цілий «арсенал»
клонованих промоторів, які дають можливість забезпечити проявлення генів у
різних типах клітині.
Слід
враховувати також, що не всі молекули плазмідної ДНК можуть мати вставки чужої
ДНК і відповідно не будуть рекомбінантними. Більшість плазмід відновлює вихідну
кільцеву структуру. Тому, перш за все необхідно відібрати бактерії, що містять
рекомбінантні плазміди.
Для
відбору рекомбінантних ДНК найбільш поширеною є система, при якій чужорідну ДНК
вбудовують в частину плазмідного гена, що кодує стійкість проти певного
антибіотика, наприклад, ампіциліну. У випадку вбудовування чужорідної ДНК цей
ген перестає нормально функціонувати, що свідчить про наявність рекомбінантної
ДНК.
і
Молекули рекомбінантної плазміди розмножуються в клітині. В процесі ділення бактеріальної
клітини вони розподіляються між дочірними клітинами і в кожній з них знову відновлюють
свою кількість. В результаті створюються колонії бактерій, кожна з яких містить
багато копій рекомбінантної ДНК. У кожному такому клоні міститься лише один відрізок
ДНК тварини або рослини, який випадково потрапив у вихідну бактерію.
При
цьому такий клон містить 1-2 гени, а якщо врахувати, що клонів значна
кількість, то вони теоретично представляють всі гени, що є в геномі тварини.
Отже, для створення банку генів кроля, що характеризує всю
молекулу ДНК або весь геном, необхідно 920000 клонів, для банку класичного
об'єкта генетичної інженерії - кишкової палички - 1300. Для генома ссавців
потрібен банк генів з фрагментами ДНК 0,8-1 млн. клонів)
Перший банк генів було створено для Е. соlі у 1976 р; потім
-для інших видів, в тому числі і для великої рогатої худоби. Також було
створено бібліотеки клонів ДНК гіпофіза і гормона росту .
Велике
значення мало одержання за допомогою генетичної інженерії інтерферону для людини.
Відомо, що інтерферон - це білок, який характеризується універсальною
антивірусною дією. Але до останнього часу не була відома амінокислотна
послідовність цього білка та не розроблена методика одержання його у чистому
вигляді. Тому на першому етапі в крові людини виділили інтерферонову
інформаційну РНК, на якій за допомогою ревертази синтезували ген інтерферону.
На другому етапі зазначений ген ввели в плазміду і одержали високопродуктивний
у-штам бактерій, що виробляв штучний інтерферон. Після того, як була визначена
його амінокислотна послідовність та склад нуклеотидів, цей ген було синтезовано
хімічним шляхом.
2.
ГЕННО-ІНЖЕНЕРНІ
ПІДХОДИ ДО СТВОРЕННЯ ІНТЕНСИВНИХ ТЕХНОЛОГІЙ В ХАРЧОВІЙ ГАЛУЗІ
Сформована у світі ситуація з м'ясною сировиною приводить до
дефіциту тваринного білка в раціоні харчування населення. Тому в технології
виробництва харчових продуктів досить актуальне комбінування білків тваринного
й рослинного походження, які економічно сполучать у собі високу харчову
цінність і забезпечують виробництво готової продукції відповідно до вимог
споживача до її якості.
Створення комбінованих варених ковбасних виробів з
використанням функціональних рослинних білків не суперечить рекомендаціям
Комісії «Кодекс Аліментариус» ФАО/ВІЗ, у яких, зокрема, декларується їхня
кількість, як замінників м'яса, не більше 50%. По технологічних,
органолептичних і фізико-хімічних показниках такі вироби повинні бути адекватні
групі традиційних варених ковбасних виробів.
Останнім часом в усім світі зросло споживання генетично
модифікованих джерел (ГМИ) рослинної сировини. В 2005р. загальна площа посівних
площ під трансгенними культурами у світі перевищила 90 млн. га.
Домінуючими трансгенними культурами, використовуваними як
продовольча сировина, є соя, рапс і кукурудза. Лідируюче положення в цьому ряді
займають білки сої завдяки їхнім функціональним властивостям, харчовій цінності
й низкою собівартості.
У Росії після проходження відповідної процедури реєстрації
дозволена до ввозу, переробці й використанню в продуктах харчування, що
випускається у світі в промислових масштабах генетично модифікована (ГМ) соя,
стійка до гербіцидів, а також продукти її переробки.
У цей час серед продуктів переробки ГМ сої, найбільше часто
використовуваних у виробництві м'ясних виробів, лідирують соєві білкові
концентрати. Активне застосування в технологіях виробництва м'ясних продуктів
ГМ соєвих білкових концентратів (ГМСК) обумовлено, насамперед, їх технологічною
й економічною доцільністю. Але при такому широкомасштабному поширенні ГМСК, особливо
гостро коштує питання підвищення якості й забезпечення безпеки продуктів з
їхнім використанням.
У зв'язку із цим у даній статті представлені результати
досліджень, спрямованих на забезпечення найбільш ефективного використання ГМСК
у технології вироблення варених ковбас.
Відповідно до
розпорядження головного державного санітарного лікаря РФ «Про порядок
гігієнічної оцінки й реєстрації харчової продукції, отриманої з генетично
модифікованих джерел» від 6 квітня 1999 р. №7, у МГУПБ групою співробітників під керівництвом акад. РАСХН Рогова И. А., проведена технологічна оцінка ГМ
насінь сої, стійких до гербіцидів, що показала відсутність достовірних
розходжень у властивостях випробуваних зразків і їх ізогенних аналогів на
підставі того, що:
• вони не
відрізняються по компонентному складі від контрольних зразків насінь сої;
• вихід білка,
його амінокислотний і фракційний склад, а також термодинамічні параметри
окремих фракцій практично збігаються для всіх досліджених зразків насінь сої;
• ліпіди,
екстраговані з досліджених зразків насінь сої, мають приблизно однаковий
жирнокислотний склад, характерний для даного виду сировини.
Було доведено, що
генетична модифікація насінь сої не впливає на структурні характеристики її
білкових і ліпідних складових.
Вивчення
особливостей поводження ГМСК у реальних багатокомпонентних харчових системах у
сполученні із традиційними білковими компонентами тваринного походження, на наш
погляд, є логічним продовженням проведених раніше досліджень і досить актуально
у світлі стрімкого розвитку сучасної біотехнології.
У зв'язку із цим
нами були проведені дослідження кількісного впливу білкового концентрату на
харчову цінність, фізико-хімічні й органолептичні характеристики комбінованої
мясорослинної системи.
Досліджували
якісні характеристики зразків, що містять від 20 до 35% суспензії ГМСК у складі
рецептури. Як контроль використали варену ковбасу 1-го сорту «Їдальня»,
основними складеними компонентами рецептури якої є яловичина й свинина. Заміна
м'ясної сировини була проведена з урахуванням вимог технології виробництва й
економії сировини. Рецептури досліджуваних зразків представлені в табл. 1.
Сіль і спеції
вносили відповідно до рецептури традиційного м'ясного продукту з розрахунку на
основну несолону сировину.
У табл. 2
представлені результати якісних характеристик сирого фаршу, що містить різну
кількість суспензії ГМСК.
Підвищення рівня
внесення суспензії ГМСК приводить до перерозподілу у фарші масових часток
основних макроживильних речовин: незначному збільшенню масових часток білка,
вуглеводів, золи й зниженню змісту жиру у всіх зразках.
Абсолютні
величини показника напруги стандартної пенетрації (НСП) для зразків, що містять
20 і 25% суспензії ГМСК, свідчать про те, що їхня структура ідентична
структурі, властивому фаршу традиційних варених ковбас. Введення 30 і 35%
суспензії ГМСК у рецептури негативно позначилося на структурі й, як наслідок,
на зовнішньому вигляді досліджуваних зразків.
Жоден зі зразків
не був лімітований по амінокислотному складі білка.
На наступному
етапі проводили органолептичну оцінку термообробленого фаршу. Результати
досліджень представлені в табл. 3.
Результати
досліджень, наведені в табл. 3, свідчать про те, що практично всі зразки, за
винятком 4-ого, одержали досить високі оцінки по таких органолептичних
показниках, як цвіт, захід і смак готових продуктів. Найвищі оцінки одержали
зразки 1 і 2 з 20 і 25% змістом суспензії ГМСК.
Найбільш
прийнятної, з точки зору споживчих властивостей комбінованого м'ясного
продукту, по харчовій цінності, структурно-механічним і органолептичним
показникам, а також економічної ефективності, була рецептура 2, що містить 25%
суспензії ГМСК.
На наступному
етапі представлялося доцільним проведення порівняльного аналізу харчової
цінності вареної ковбаси, виробленої по даній рецептурі з ковбасою «Їдальня»
1 -го сорту,
рецептура якої не передбачає використання рослинного білка.
За аналогією з
попередньою роботою досліджували якісні показники двох зразків:
1 - контрольний
зразок (без рослинного білка);
2 - зразок, що
містить суспензію ГМСК.
Введення
суспензії ГМСК позитивно позначається на загальному розподілі складених
компонентів і має деяку перевагу в порівнянні з контролем відносно масової
частки жиру, зниження якого є позитивним чинником згідно із сучасними
тенденціями в області здорового харчування.
Одним з основних
показників, що визначають біологічну цінність харчових продуктів, є ступінь
переварювання білків у шлунково-кишковому тракті протеолітичними ферментами.
Результати визначення перетравності білків травними ферментами in vitro дають
можливість передбачати ступінь утилізації білків організмом.
Можна відзначити,
що варена ковбаса, рецептурним компонентом якої є суспензія ГМСК.
характеризується трохи більше низьким значенням перетравності пепсином і трипсином
у порівнянні з контролем, що пояснюється присутністю в складі суспензії ГМСК,
також як і в його ізогенном аналогу, інгібіторів протеаз шлунково-кишкового
тракту.
У цей час в усім світі росте виробництво харчових продуктів з
генетично модифікованих джерел (ГМИ).
Тільки за період з 1996 по 2003 р. загальна площа під
трансгенними культурами збільшилася в 40 разів.
Лідируючі позиції у виробництві ГМИ займають США (68%),
Аргентина (11,8%), Канада (6%) і Китай (3%) [1]. Зрозуміло, що такі продукти
проникають на ринок продовольства й у Росії. Наука, що дозволяє створювати ГМИ,
- генна інженерія, що часто називають сучасною біотехнологією.
Генетично модифіковані організми - це живі організми, яким
шляхом впровадження чужорідних генів були додані нові фенотипічні ознаки.
Ці фенотипічні ознаки ГМИ, невластиві вихідного виду,
викликають побоювання в окремих фахівців, які затверджують, що такого роду
втручання в природні природні процеси може згубно позначитися на споживачах
генетично модифікованих продуктів. Неясний і екологічний збиток від такого виду
діяльності.
Виробники ГМИ й ряд учених - біологів, генетиків, навпаки,
декларують безпека даного виду продукції для здоров'я й життя людини.
Найчастіше трансгенной модифікації піддають сою. Соєві
білкові препарати (борошно, текстурати, ізоляти, концентрати) широко
використають у виробництві харчових продуктів. Переважна більшість м'ясних
продуктів сьогодні містять у своєму складі соєві інгредієнти.
У цей час у промисловому масштабі випускається 9 ліній
генетично модифікованої сої, стійкої до гербіцидів невиборчої дії - гліфосату
(марка "Раунд Ап") і глюфосикату.
Міністерством охорони здоров'я й соціального розвитку РФ
дозволено без обмеження використати в їжу продукти, що містять
гліфосаттолерантну сою ліній 40-3-2 («Мон Санто», США), А 2704-12 і А 5547-127
(«Байер Кроп Сайнс», Німеччина).
По дослідженнях Інституту харчування РАМН специфічний білок,
що утвориться при генетичній модифікації сої, повністю руйнується в
шлунково-кишковому тракті лабораторних тварин [2].
Відповідно до
випробувань, проведеним у МГУ прикладної біотехнології, генетично модифіковані
соєві продукти по своїх споживчих властивостях мало відрізняються від
традиційної сировини [3]. Однак, оскільки безпека трансгенних продуктів не
встановлена, у споживача повинен бути вибір між нативними продуктами й
продуктами, отриманими за допомогою біотехнологічних методів.
Інформація про трансгенних компоненти в складі харчових
продуктів повинна бути максимально відкритої для споживача. Тим часом дані
моніторингу, проведені в РФ, показують, що виробники не завжди маркірують свою
продукцію належним чином, часто не дають інформації для споживача про
використання у виробництві продукту генетично модифікованих інгредієнтів [2].
Вивчення продовольчого ринку м. Хабаровська показало, що
інформація про наявність ГМИ при маркуванні більшості харчових продуктів
відсутній.
Нами досліджені 1400 зразків м'ясних, молочних і
кондитерських продуктів вітчизняних і закордонних виробників, і не було
виявлено інформації про зміст у них ГМИ, хоча, по даним Роспотребнадзора по
Хабаровському краї, генетично модифіковані соєві препарати в край надходили.
Оборот генетично модифікованих продуктів у РФ регламентується
рядом федеральних законів і нормативних актів, у тому числі законами «Про державне
регулювання генно-інженерної діяльності»; «Про санітарно-епідеміологічне
благополуччя населення»; «Про якість і безпеку харчових продуктів»; «Про захист
прав споживачів».
Відповідно до доповнень до Санпін 2.3.2.1078-01 з 1 вересня 2002р. уведене обов'язкове маркування харчових продуктів, у виробництві яких
використані ГМИ. При цьому нормативним документом Санпін 2,3.2.1842-2004
установлений граничний рівень маркування продуктів, які містять у рецептурі
більше 0.9% компонентів із ГМИ.
Система оцінки безпеки харчової продукції із ГМИ припускає
проведення моніторингу за оборотом такої продукції.
З метою попередження порушення санітарного законодавства при
обороті харчових продуктів, отриманих із ГМИ, і відповідно до федеральних
законів "Про санітарно-епідеміологічне благополуччя населення», «Про
якість і безпеку харчових продуктів», "Про захист прав споживачів»
організовані лабораторії при регіональних органах Роспотребнадзору.
Однак установлений порядок перевірки продукції на наявність
ГМИ на етапі обов'язкової сертифікації малоефективний. Він не забезпечує
надійного заслону обороту харчових продуктів із трансгенними інгредієнтами без
відповідного маркування.
Крім того, здійснення робіт з ідентифікації ГМИ в атестованих
іспитових центрах обмежують їх слабка матеріально-технічна база й висока
вартість проведених аналізів.
Разом з тим для визначення наявності ГМИ в цей час існує
багато методів - близько 200, у тому числі 44 методу для визначення трансгенной
сої. Найбільше поширення одержали імунологічні (ELISA, Western) і Днк-методи
(Southerm і ПЦР)[1].
Доступним, надійним і найбільш кращим методом визначення ГМП
в продуктах харчування є полімеразно-ланцюгова реакція (ПЦР), проведення якої
вимагає невелику кількість досліджуваного зразка.
Журнал «М'ясна індустрія» неодноразово піднімав питання про
властивості білків із ГМИ й проблемах ідентифікації м'ясних продуктів, у тому
числі за допомогою методу ПЦР [3,4.5].
У РФ затверджені й діють два національних стандарти на методи
ідентифікації ГМП. засновані на застосуванні ПЦР: ДЕРЖСТАНДАРТ Р 52173-2003
«Сировина й продукти харчові. Метод ідентифікації ГМП рослинного походження» і
ДЕРЖСТАНДАРТ Р 52174-2003 «Біологічна безпека. Сировина й продукти харчові.
Метод ідентифікації ГМП рослинного походження із застосуванням біологічного
мікрочипа».
Проведення досліджень за допомогою ПЦР не представляє значних
труднощів і може бути здійснене у звичайній біологічній лабораторії при
наявності набору Пцр-тест-системи, виробництво якого освоєно ГУ ЦНІІ
епідеміології Міністерства охорони здоров'я й соціального розвитку РФ.
Ціль наших досліджень - визначити наявність або відсутність
ГМИ в різних видах м'ясних продуктів, соєвих аналогах м'яса й соєвих білкових
препаратів, використовуваних у м'ясній промисловості м. Хабаровська.
Дослідження проводили в лабораторії експертизи продовольчих
товарів Хабаровської державної академії економіки й права й Пцр-лаборатории
Далекосхідного державного медичного університету при участі й підтримці
Міністерства харчової промисловості й споживчого ринку Хабаровського краю.
Усього випробувано 33 зразка з 12 видів харчових продуктів.
Одночасно вивчали вірогідність представленої інформації щодо
змісту в м'ясних продуктах харчових добавок рослинного походження.
Дослідження проводили якісним методом, що дозволяє виявити
присутність ГМИ в кількості 0,1%. Застосовували Пцр-тест-систему «Ампли Сене
ПЛАНТ-СКРИН» і комплект реагентів для ампліфікації «ГМ соя 40-3-2».
При цьому виявляли наявність рекомбінантної ДНК
(353-промотор), а також ідентифікували ДНК, властиву генетично модифікованій
сої сорту Roundup Ready (лінія 40-3-2). дозволеної до використання в харчовій
промисловості Росії.
З 33 зразків наявність рослинних інгредієнтів (соєвих білків)
було зазначено в 25 об'єктах. Фактично встановлена присутність соєвих добавок в
32 зразках. Тільки в м'ясній начинці чебуреків (ТОВ «Мерилен») соєві
інгредієнти були відсутні.
Регулювати реологічні характеристики й поліпшувати стійкість
при зберіганні кисломолочних напоїв, запобігати розшарування продукту й
спонтанне відділення сироватки дозволяє використання стабілізуючих речовин і
їхніх комбінацій. Традиційно для стабілізації молочних продуктів використаються
камеді - ріжкового дерева, гуарова й ксантанова, карагінан, агар, желатин. Хоча
перераховані стабілізуючі речовини дають бажаний технологічний ефект уже при
відносно низьких концентраціях, їхнє використання відбивається на собівартості
продукту у зв'язку з їхньою високою вартістю. Вигідніше в ціновому відношенні є
крохмаль. Але крохмалі утворять клейстери невисокої в'язкості, що спричиняється
необхідність використання підвищених доз цієї речовини. При збільшенні дози
введення понад 2,0% відчувається характерний присмак уведеного крохмалю. З
метою розширення технологічних здатностей крохмалі піддають модифікації.
Різноманітні способи обробки нативних крохмалів (фізичні, хімічні, біологічні)
дозволяють істотно змінити їхня будова й властивості, до яких у першу чергу
належать гідрофільность (у тому числі здатність розчинятися в холодній воді),
здатність до клейстеризації й гелеутворенню, стійкість до нагрівання й впливу
кислот.
По змінах, які відбуваються в нативних крохмалях, виділяють
чотири основні модифікації: набрякання, деполімеризація, стабілізація
(утворення похідних без поперечного зшивання молекул), утворення поперечно
зшитих
полімерних ланцюгів. На відміну від нативних рослинних
крохмалів, які вважаються харчовими продуктами, модифіковані крохмалі
ставляться до харчових добавок.
Відповідно до стандартів (ДСТУ 4380:2005) модифіковані крохмалі
розділяють на групи по різних ознаках.
Залежно від характеру перетворень, які відбулися в структурі
крохмалю, його умовно розділяють на:
• крохмаль, отриманий у результаті порушення структури;
• перманганат і інших. Окислений крохмаль залежно від застосовуваного
окислювача може бути: желейним, рідкокиплячим, окисленим і ін.);
• гідролізованний крохмаль - крохмаль, одержуваний частковим
гідролізом крохмалю за допомогою кислот, лугів і ферментів;
• декстрини - з'єднання, одержувані шляхом термічної обробки
крохмалю в присутності каталізатора. (Декстрини ділять на кислотні, сольові й
лужні.);
• поперечнозвязаний крохмаль одержують шляхом обробки
крохмалю ди- або поліфункціональними реагентами, такими як формальдегід,
хлороксид фосфору й іншими, де два або більше полімерні ланцюги зв'язані між
собою;
• ацетилированний крохмаль (ацетати крохмалю) одержують
шляхом взаємодії крохмалю з оцтовою кислотою або іншими ацетилірованими
реагентами;
• оксилалкилірований крохмаль - простий ефір, одержують у
результаті взаємодії крохмалю й окису етилена або пропиляна;
• фосфатний
крохмаль - прості й складні ефіри, монокрахмалофосфати й дикрахмалофосфати,
одержують шляхом взаємодії крохмалю з фосфорною кислотою або її солями;
• сукцинати крохмалю - складні ефіри крохмалю й бурштинової
кислоти.
Модифіковані крохмалі можуть застосовуватися як самостійно,
так і в комбінації з іншими стабілізуючими речовинами.
Авторами вивчена можливість використання модифікованих
крохмалів вітчизняного виробництва в технологіях кисломолочних напоїв і напоїв
на основі молочної сироватки.
Для досліджень використали ацетильований (амілацетат) і
окислений (оксиаміл ОПВ) картопляний і кукурудзяний крохмалі виробництва
приватного багатопрофільного підприємства "Вімал" (м. Чернігів).
Амілацетат є універсальним згущувачем, має низький ступінь
заміщення, дає можливість утворення стабільних прозорих клейстерів, стійких при
низьких РН, високих температурах і інтенсивній механічній обробці. Оксиаміл ОПВ
одержують шляхом "м'якого" окислювання нативного крохмалю перекисом
водню, його характерна риса - утворення міцних холодців.
Досліджувані крохмалі утворювали клейстери при нагріванні до
температури 85?С. Попередніми дослідженнями встановлена оптимальна концентрація
клейстеру модифікованих крохмалів для введення до складу продуктів - 5%. При
збільшенні концентрації клейстери характеризувалися високою в'язкістю й
втрачали плинність, що технологічно недоцільно.
Відомо, що крохмальні клейстери чутливі до
високотемпературної обробки, тому на наступному етапі досліджували зміну
показника динамічної в'язкості крохмальних клейстерів у різних температурних
режимах.
Для цього досліджували зразки клейстерів амілацетату М1 з
однаковою концентрацією (4%) і різними температурами теплової обробки (75, 80,
85, 90, 95)?З (мал. 1).
В'язкість клейстерів при підвищенні температури теплової
обробки збільшується. Так, при підвищенні температури з 70 до 75?З в'язкість
збільшується на 0,04 Па·с, а с 80 до 90єС - на 0,1 Па·с. При подальшому підвищенні температури
до 950С показник динамічної в'язкості дещо знижується, що вказує на
можливі зміни структури крохмального клейстеру. Зразки розчинів крохмалів інших
модифікацій показали аналогічні результати.
Таким чином, рекомендована температура теплової обробки
розчинів крохмалів (температура клейстеризації) становить (88 ± 2)?С.
Досліджено показник динамічної в'язкості клейстерів
модифікованих крохмалів, порівняльна характеристику яких наведена на мал. 2.
Аналізуючи отримані результати, можна зробити висновок, що
найкращі показники динамічної в'язкості мав зразок картопляного крохмалю
модифікації Амілацетат М1, що пояснюється утвореними їм більше міцними
структурними зв'язками. У хімічному відношенні модифікований крохмаль є
полімерним з'єднанням, макромолекулах якого рівномірно розташовані гідрофільні
групи, які взаємодіють із іонами водню й металів, особливо кальцію,
неорганічними молекулами меншої молекулярної маси.
Тому в наступних дослідженнях увага приділяли саме цій
модифікації крохмалю. Аналогічні дані отримані при використанні як розчинник
молока цільної й молочної сироватки. Клейстери, отримані на основі незбираного
молока, мали найвищі показники динамічної в'язкості (0,57 Па·с), клейстери на
основі молочноі сиворотки — 0,34 Па·с, на основі води — 0,22 Па·с, що пояснюється самим високим
змістом сухих речовин (масова частка сухих речовин молочної сиворотки складає
6,3%, цільного молока — 11,5%).
Отримані дані
дають підставу говорити про можливість використання позначених вітчизняних
модифікованих крохмалів у технологіях свіжих і ферментованих молочних напоїв, а
також напоїв на основі молочної сироватки. Використання модифікованих крохмалів
дозволить поліпшити смакові якості, формувати реологічні характеристики
кисломолочних напоїв, знизити їхню собівартість.
2.1 ВИКОРИСТАННЯ ГЕННОЇ ІНЖЕНЕРІЇ В М’ЯСНІЙ ТА МОЛОЧНІЙ
ПРОМИСЛОВОСТІ
Останніми роками в нашій крані збільшився попит на високоякісні
делікатесні продукти з м'яса птахів, зокрема перепелів.
Розведення перепелів - перспективний напрям м'ясного птахівництва.
Висококалорійне м'ясо перепелів по живильних, дієтичних і смакових якостях
перевершує куряче м'ясо і індичатину. Воно корисніше курячого, в ньому більше
таких вітамінів, як В1,В2, В6, каротину, мікроелементів, незамінних
амінокислот. М'ясо перепелів містить значно менше з’єднувальної тканини, тому
воно відрізняється більшою ніжністю і кращою засвоюваністю. Відомо, що
споживання м'яса перепелів позитивно впливає на імунну систему людини,
підвищуючи стійкість організму до бактерійних і вірусних инфекціям. Стійкість
перепелів до інфекцій дозволяє містити їх, не вдаючись до вакцинації, що виключає
накопичення лікарських речовин в м'ясі.
Перепелине яйце - комора живильних речовин. В одному грамі цього яйця в
порівнянні з курячим міститься більше вітамінів:
А - в 2,5 рази, В1 -в 2,8 рази і В2 - в 2,2 рази. В п'яти перепелиних
яйцях, по масі рівних одному курячому, в 5 разів вище рівень фосфору і кальцію,
в 4,5 рази - залоза. Значно більше в яйцях перепелів міді, кобальту і
амінокислот, в них практично відсутній холестерин.
Присутній в яйцях перепелів білок овомукоід здатний пригнічувати
алергічні реакції.
Яйця не схильні зараженню сальмонелою і завдяки високому вмісту лізоциму
зберігаються при кімнатній температурі до півтора місяця. При їх зберіганні
може відбутися тільки деяке усихання вмісту яйця. При вирощуванні перепелів
особливе значення має повноцінне годування. Вуглеводи - основна складова
частина корму для цього птаха. Недолік вуглеводів в кормах викликає у перепелів
слабкість м'язів, пасивність, втрату апетиту, зниження температури тіла і в
подальшому може привести до різних захворювань.
Одними з вуглеводних компонентов, які повинні містити корма для
перепелів, є маннани. У великій кількості вони містяться в клітинних стінках
вищих рослин. Манноза (епімер глюкози) - структурний елемент маннана, володіє
імуностимулюючими, радіопротекторними властивостями і гіполіпідемічною дією,
сприяє зростанню птаха. Більшість видів сальмонел і ешерихій здатні
прикріплятися до поверхневих вуглеводів, а також до маннози, що подається з
кормом, що захищає кишечник від патогенних бактерій.
Адсорбенти на основі маннози міцно зв'язують мікотоксини. Таким чином,
внесення вуглеводів, зокрема маннози, в раціон харчування птахів покращує
продуктивність, сприяє зростанню і розвитку сильной імунної системи, зводячи до
минимуму ризик захворювань. У Воронежській державній технологічній академії на
кафедрі мікробіології і біохімії був вивчений фермент, який розщеплює маннани
рослинного происхождения. D-Маннаназа (1,4- -D-маннан манногидролаза)
неврегульований гідролізує зв'язки 1,4-р-0-манно-пиранозида в головному ланцюзі
полисахаридов: маннана, глюкоманнана, галактоманнана і галактоглюко-маннана, що
приводить в основному до виділення маннотриози і манно-біози. Ці олігосахариди
представляють сприятливі чинники зростання для кишкової мікрофлори людини і,
як наслідок , можуть використовуватися при виробництві кормів. Розроблений спосіб
виділення ферменту р-маннанази і схему його очищення з культуральної рідини
Тrichoderта harzianит, вивчили вплив рН і температури на його активність, а
також визначили рН- і термостабільність ферменту [1]. Був отриманий ферментний
препарат Р-маннанази з питомою активністю 271,5 од. на 1 мг білка. Вихід по
активності даного ферменту склав 3,8% [2]. Вивчення впливу температури і рН на
зміну констант швидкості інактивації свідчить про те, що р-маннаназа володіє
високою рН- і термостабильностью, що вигодно відрізняє отриманий фермент від
раніше відомих маннаназ. Наибольшую стабільність фермент проявляв при температурі
50°С в області рН 4,0-5,0. В цих умовах зберігалося 40% його активності
протягом 24 ч. При дослідженні процесу ферментативного гідролізу
маннансо-тримаючої сировини визначили, що оптимальними умовами для гідролізу
маннанов служать температура 60 З при рН 4,5 і дозування ферментного препарату
15 од. на 1 г субстрату. Ферментативний гідроліз протеікав інтенсивно: протягом
2 г гідролізу ступінь гідролізу субстратів в яких є маннаназа складала близько
90%. Основними маннанутримуюючими компонентами в комбикормах для перепелів є
зернобобові культури: кукурудза, горох і пшениця. Що містяться в них маннани
практично не засвоюються птахом і негативно впливають на засвоєння енергії і
протеїнів, а також зростання перепелів. У зв'язку з цим доцільно
використовувати при виробництві кормів для перепелів ферментні препарати, які
розщеплюють некрохмальні полісахариди, зокрема маннани.
На базі птицефабрики «Интерптица» був проведений науково-господарчий
досвід по годуванню перепелів з використанням маннозоутримуюючих гідролізатів,
отриманих ферментативним шляхом. Маннозоутримуючий гідролізат змішували з
іншими компонентами кормової суміші для перепелів дослідних груп в цеху
птахофабрики. З перепелів японської сірої породи склали контрольну і дві
дослідні групи. Дослідні групи птахів (2 клітки по 35 голів) були сформовані за
принципом аналогів (порода, вік, жива маса). Цих перепелів годували отриманим
комбікормом з 35-денного віку протягом трьох місяців. Перша дослідна група
одержувала біомо-дифіцирований корм щодня, а друга - через день. Рецептури
кормових сумішей для досвідчених і контрольної груп перепелів практично не
відрізнялися, окрім введення в раціон годування перепелам дослідних груп
маннозоутримуючих гідролізатов в різних дозах. Залежність ступеня гідролізу маннозоутримуючих
компонентів від тривалості гідролізу
При проведенні досліджень визначали:
·
живу
масу перепелів {щотижня, зважуючи кожного птаха);
·
збереження
поголів'я (щодня, враховуючи відмінок і вибраковування);
·
споживання
кормів перепелами (щодня з урахуванням надходження кормів і їх залишків по
групах);
·
яйценоскість
птаха (щодня в кожній групі);
·
м'ясну
продуктивність(забій і повне анатомічне оброблення тушок птаха по 6 голів з
кожної групи);
·
масу
внутрішніх органів;
·
категорію
тушок;
·
рентабельність
виробництва м'яса перепелів з урахуванням діючих цін.
Дослідженнями встановлено, що перепели дослідних груп з’дали корму менше
в порівнянні з аналогами контрольної групи на 4,1-3,0% в першій досвідченій
групі і на 3,5-2,4% в другій.
Збереження поголів'я в контроль ний і досвідчених групах за період
вирощування складала 97,0-98,7% і не залежала від раціону годування.
Залежно від кількості введеного гідролізату інтенсивність яйценоскості
збільшувалася. Яйценоскість середньої несучки в порівнянні з контрольною була
більше в досвідчених групах: в першій на 2,1%. в другій на 1,5%.
2.2
ВИКОРИСТАННЯ ГЕННОЇ ІНЖЕНЕРІЇ У РОСЛИННИЦТВІ
Ідея використання
генетично змінених рослин у сільському господарстві, а виробів із них - у
харчовій промисловості спочатку була фантастично привабливою: за допомогою
генетичних маніпуляцій змінити культури так, щоб вони здатні були самі
захистити себе від шкідників та хвороб. Це дало б змогу не застосовувати у
процесі виробництва сільськогосподарської продукції шкідливих для довкілля і
людини засобів захисту рослин, підвищити їх врожайність, посилити бажані якості
- такі, наприклад, як стійкість під час зберігання та смак.
Першими
генетично модифікованими стали помідори Ан-ті-Матч, що з'явилися на ринку
Сполучених Штатів 1994 року. В Англії з них виготовляють томатну пасту, а в
Німеччині дозволено лише деякі їхні варіанти з більш-менш твердою м'якоттю.
Лише
в Німеччині вчені провели вже понад 130 польових дослідів, щоб перевірити, чи
справді нові форми рослин, створені у генетичних лабораторіях, мають бажані
якості, і чи можуть вони давати задовільні врожаї. Найчастіше експериментували
при цьому з генетично зміненим ріпаком. Та переважна більшість дослідників
дійшла висновку, що впровадження генетично змінених рослин помилково і навіть
небезпечно. Вони застерігають від неконтрольованого поширення трансгенних
рослин для вирощування їх у польових умовах.
На
думку науковців, від впровадження генетично змінених рослин існує небезпека, по-перше,
появи речовин отруйних або алергенних для так званих нецільових організмів,
тобто не тих, проти яких вони були спрямовані. Наприклад, в одного із генетично змінених
сортів сої виявлено так званий парагоріховий ген, здатний спричиняти алергічні
захворювання у багатьох людей. На щастя, його було виявлено ще до надходження
цього сорту на ринок.
По-друге,
можуть виникнути шкідники та збудники хвороб, що стануть резистентними до
трансгенних рослин. Генетично змінені культури спроможні передати свої біохімічні
захисні властивості стосовно пестицидів, вірусів або паразитів спорідненим
дикорослим рослинам. У результаті може, наприклад, з'явитися супербур'ян, який
поширюватиметься катастрофічними темпами й буде стійким до всіх винайдених
людьми засобів знищення.
Єдиного міжнародного протоколу біологічної безпеки ще не
існує, а вірогідність того, що його буде прийнято найближчим часом, практично
відсутня. Насамперед США, Канада й Австралія зірвали конференцію ООН,
присвячену біологічній безпеці генетично змінених продуктів. Ці держави
уникають перешкод для бізнесу з боку країн, що розвиваються, які прагнуть
захистити видову різноманітність свого рослинного світу від чужого втручання,
в тому числі "генетичного піратства". Агрохімічні концерни промислово
розвинених країн дуже зацікавлені в експорті генетично зміненого посівного матеріалу
в країни "третього світу". Особливо Сполученим Штатам інтенсивний
експорт забезпечує шанси поліпшити негативний торговельний баланс. Поки що в
конфлікті між довгостроковими екологічними та короткочасними економічними
цілями перемагають економічні чинники і укладення відповідної угоди блокується.
До трьох уже названих держав приєдналися Аргентина, Чилі та
Уругвай, які сподіваються, що використання генетично зміненого посівного матеріалу
дасть новий поштовх до розвитку їхнього сільського господарства.
Харчові продукти, виготовлені з генетично модифікованої
сировини, також можуть становити небезпеку для здоров'я. Принаймні саме про це свідчать
результати нещодавніх експериментів англійських учених. Пацюки, яких годували
генетично зміненою картоплею, частіше хворіли й повільніше росли. Особливі
побоювання викликає вплив такої їжі на імунну систему.
Незалежно
від думки споживачів, генно-інженерна промисловість виробництва харчових продуктів
інтенсивно розвивається. У майбутньому планують виробляти за допомогою генної
інженерії вітаміни та різні добавки, які майже непомітно надходитимуть на
споживчий ринок. На думку фахівців концерну Nestle, через деякий час у всьому
світі не можна буде знайти жодного виду рослинної сировини, одержаного без
застосування біотехнології.
МАЙЖЕ всі продукти, які ми споживаємо, вже певною мірою
генетично змінені. На полицях магазинів найчастіше можна побачити модифіковану
кукурудзу, ріпак, картоплю, помідори та сою і вироби з них. У Сполучених Штатах
давно продають трансгенні помідори, так звані FІаvг-Sаvг-Тоmаtе.
У Канаді та деяких інших країнах у значних обсягах вирощують
генетично змінений ріпак та стійку до комах шкідників "ВТ-кукурудзу", що містить
ген резистентності до антибіотиків. Продаж цих рослин і виготовлених із них
продуктів дозволений і в Німеччині. їх переробляють на олії, крупи, крохмаль та
глюкозний сироп. До харчових продуктів, виготовлених із застосуванням
гентехніки, що вже набули значного поширення на європейському ринку, належать
насамперед соєві боби. Премікси з них містять понад 20 тисяч найменувань харчових
виробів у тому числі, хлібобулочні, дієтичні, швид-козаморожені готові страви,
чіпси, соуси, майонези, маргарини, готові салати, шоколад. У кондитерській
промисловості соєвий лецитин (Е322) широко застосовують як природний
емульгатор. А продукти з крохмалем або підсолоджувачами, виготовленими з
кукурудзи, -це порошки для пудингів, порошкові супи, різні види борошна, напої,
мармелади, ласощі. З добавками або допоміжними речовинами на основі генетично
змінених мікроорганізмів виготовляють, наприклад, хімозин для сирів, амілази
для хлібопекарського виробництва, ферменти для фруктових соків і червоного
вина. Крім кукурудзи, ріпака та сої, найближчим часом на європейському ринку
з'являться також генетично змінені рис, цукрові буряки, різні овочі та фрукти й
продукти з них. Водночас споживач має право вирішувати, чи готовий він до цих
новацій. А щоб він міг зробити належний вибір, необхідне чітке й недвозначне
маркування генетично змінених харчових продуктів..
Європейська Комісія прийняла постанову Європейського
Парламенту і Ради Європи 258/97 "Про нові види харчових продуктів та нові
інгредієнти харчових продуктів" від 27 січня 1997 року, яку називають також "Постановою Novel Fооd".
Цей документ вимагає обов'язкового маркування генетично змінених продуктів для
всіх країн - членів Європейського Союзу. Продукти повинні мати відповідні
позначки, коли вони самі генетично змінені, або містять генетично змінені
організми (наприклад, йогурт з генетично зміненими молочнокислими бактеріями).
Та з цього правила є цілий ряд винятків. Наприклад, продукти харчування,
виготовлені з генетично змінених складових, не підлягають обов'язковому
маркуванню, якщо вони ідентичні відповідним звичайним продуктам. Зокрема, не
маркують олії з генетично зміненої сої, які не містять генетично модифікованого
вихідного продукту. Не обов'язково позначати харчові добавки, наприклад,
ароматичні речовини.
Спосіб виявлення
генетично змінених продуктів - аналіз ДНК або протеїнів. Проблема полягає в тому, що в
багатьох випадках сліди біотехнічних маніпуляцій повністю зникають у процесі
переробки і приготування. Колииявлення такого втручання вже неможливе,
спеціальне маркування також не потрібно.
Досі немає єдиних вимог щодо форми, місцезнаходження і
точного змісту етикеток для модифікованих продуктів або якогось особливого
символу для їх позначення. Лише для складових з кукурудзи та сої існують певні
приписи. Вони повинні мати вказівку "з генетично зміненої кукурудзи"
або "з генетично змінених соєвих бобів". Цей текст може бути вміщений
як примітка під переліком інгредієнтів і має бути надрукований шрифтом такої
самої величини, а відповідні компоненти переліку позначають зірочкою.
Оскільки дискусія навколо нових європейських нормативних
документів щодо надання дозволу для впровадження генетично змінених організмів
ще не закінчилась, де-факто існує мораторій на надходження на ринок нових
продуктів. Вже більше року в країнах Європейського Союзу не видано жодного
дозволу на них. Тому біотехнічна промисловість країн Європи вимагає створення
єдиної центральної європейської установи, що зайнялася б видачею дозволів на
виробництво та реалізацію генетично змінених харчових продуктів - на зразок
американського Управління харчових продуктів та лікувальних засобів, науковій
компетентності якого однаково довіряють споживачі та промисловість.
Для того, щоб гарантувати безпеку генетично змінених
продуктів для здоров'я людей, країни ЄС законодавчо впровадили і впроваджують
цілий ряд регулюю- чих заходів. Уряд Великобританії заявив, що усі генетич-но змінені
харчові продукти піддаватимуть прискіпливим дослідженням перед тим, як
відповідні органи дадуть дозвіл на їхній продаж. У Німеччині за оцінку та
урахування ризиків у сфері генетично змінених продуктів відповідає Державний
інститут охорони здоров'я споживачів і ветеринарної медицини. З 1 серпня 1998 року у країні набув чинності нормативний документ про обов'язкове
|маркування генетично змінених продуктів. Крім того, прагнучи більшої
прозорості та поінформованості споживачів, бундесрат Німеччини в березні 1998
року поставив питання щодо маркування виробів, виготовлених "без
гентехніки". Відповідні продукти не можуть містити як самі генетично
змінені організми, так і складові, виготовлені з генетично зміненої сировини -
добавки, ферменти, розчинники або ароматичні речовини. Однак з певним, не таким
уже й неістотним обмеженням: не беруться до уваги залишки рослинних засобів,
ветеринарних препаратів та забруднювачів навколишнього середовища, створених із
застосуванням генетичних технологій.
Втім, зараз широко обговорюють, приміром, у Німеччині, що
саме має право виробник написати на етикетці: "без гентехніки", як
запропонував бундесрат, чи "вільний від гентехніки"? Адже досить
однієї насінини, занесеної вітром чи комахою з сусіднього поля на те, де
вирощують рослини із не зміненим геном, - і всю продукцію з цього поля вже не
можна буде назвати "вільною від гентехніки". І чому віддадуть
перевагу споживачі - вимагатимуть вони обов'язкового етикетування харчових
продуктів у Європі як "вільної від гентехніки" або задовольняться
позначкою "без гентехніки", яка ні до чого не зобов'язує? А якщо одні
й ті самі бджоли відвідуватимуть плодові насадження, утримувані за екологічною
технологією, та поля генетично зміненого ріпаку, маркування одержаного від них
меду етикеткою "без гентехніки" лише вводитиме в оману покупців.
Цілковиту впевненість у генетичній чистоті кожного
конкретного продукту забезпечує лише повний аналіз, щоб виявити найменше
забруднення чужорідним матеріалом. Це копітка й дорога праця. Тому поки що фахівці зійшлися на
компромісному формулюванні на етикетці "без гентехніки". Така
позначка лише закликає виробників відмовитися від використання модифікованих
компонентів, але не гарантує повної їх відсутності у готових харчових
продуктах.
Про це свідчать,
наприклад, і перевірки Центральної ради споживачів у Німеччині. Час від часу на
полицях магазинів виявляють не позначені належним чином тран-сгенні вироби фірм
Nestle, Frosta, Marks&Spencer, Ot-tens, Mora, McCain та ін.
2.3
МЕТОДИ ГЕННОЇ ІНЖЕНЕРІЇ МІКРООРГАНІЗМІВ
Науково-технічний розвиток харчової промисловості зумовлений
рівнем технологій усіх його галузей, зокрема пивобезалкогольної. За масовістю
виробництва та об'ємами споживання напої займають значне місце в раціоні
харчування. Згідно з численними дослідженнями в галузі фізіології харчування
найбільш раціональна форма таких продуктів - безалкогольні напої, від
біохімічного та мікробіологічного складу яких значною мірою залежить стан
здоров'я населення. Тому проблема створення й виробництва безалкогольних напоїв
загальнооздоровчого призначення має виняткове значення в розвитку харчової
промисловості. З точку зору біохімічного та мікробіологічного складу найбільш
повноцінними можна вважати ферментовані напої - продукти культивування моно-
або асоційованих культур мікроорганізмів. Це зумовлено здатністю їх продукувати
необхідні для нормального функціонування організму людини біологічно активні
речовини. Основна їх відмінність і перевага над звичайними напоями купажування
полягає в тому, що ці речовини не вносять штучно, вони утворюються в процесі
бродіння. Крім того, широкий спектр їх якісного складу дає змогу поповнити
організм людини дефіцитними біологічно активними речовинами.
Однак до цього
часу відповідної уваги розвитку даної галузі не приділяли, тож технологічний і
технічний рівень їх виробництва досить низький.
Недостатній також
асортимент таких напоїв представлений лише хлібним квасом на житній основі.
Водночас завдяки розробці і впровадженню новітніх технологій, цілеспрямованому
підбору та виділенню чистих культур мікроорганізмів, використанню нетрадиційної
рослинної сировини можна значно інтенсифікувати розвиток безалкогольної галузі,
одержати повноцінні, збалансовані за біохімічним і мікробіологічним складом
відповідно до потреб організму людини напої.
Питання підбору, виділення й дослідження штамів
мікроорганізмів для виробництва ферментованих напоїв - основні в створенні
нових біотехнологій. Здебільшого як закваску на підприємствах використовують пресовані
хлібопекарські дріжджі, не адаптовані до технології квасоваріння, або
комбіновану закваску з дріжджів Saccharomyces cerevisae рас М чи С-2 і
молочнокислих бактерій роду ВеtаЬасtегіum 11 і 13. Ці штами були виділені й
вивчені Л.Чеканом ще в 20-х роках минулого століття, тож за такий тривалий
термін культивування вони втратили свої технологічні властивості: бродильну
активність, синтез незамінних амінокислот та інших біологічно активних речовин,
швидкість розмноження тощо.
У НУХТI у
співпраці із співробітниками ІМВ НАН України та НДІ геронтології Академії
медичних наук проведено комплекс досліджень щодо виділення та підбору
перспективних для виробництва ферментованих безалкогольних напоїв чистих
культур дріжджів і молочнокислих бактерій.
У процесі
досліджень у лабораторних, дослідно-промислових і виробничих умовах
використовували як загальноприйняті методи, так і ті, що раніше при
дослідженнях ферментованих напоїв не застосовували і були модифіковані в
процесі роботи. При виділенні, підборі й дослідженні культур мікроорганізмів
керувались прийнятими в мікробіології нормами й правилами.
При цьому вивчали здатність культур мікроорганізмів есективно
розвиватись у субстратах з різної вуглеводовмісної сировини. Встановлено
доцільність її використання та попередньо відібрано штами дріжджів виду
Sсегevisiae і молочнокислих бактерій видів Е.fаесіиm.
Для розробки технологій нових ферментованих напоїв використано
нові дріжджі Saccharomyces cerevisae, штами Р-87, К-87 і КМ-94 та молочнокислі
бактерії Streptococcus diacetilactis, Епtегососсus fаесіuт К-77та LасtоЬасіІІus
рlаntаrum АН 11/16.
При дослідженні
технологічних властивостей виділених штамів дріжджів виявлено їх значні
переваги над виробничими культурами, зокрема, генеративної здатності,
бродильної активності (див. рисунок), здатності надавати напоям відмінних
органолептичних показників тощо.
Запропоновано використовувати принципово нові для ферментованих
напоїв культури молочнокислих бактерій, зокрема гетероферментативні
ароматоутворюючі Streptococcus diacetilactis та гомоерментативні Епtегососсus
fаесіuт К-77та LасtоЬасіІІus рlаntаrum АН 11/16.
Доцільність використання
ароматоутворюючих молочнокислих бактерій підтверджується їх здатністю активно
розвиватись в умовах, характерних для технологій ферментованих напоїв і
надавати їм відмінних смакоа-роматичних властивостей.
Використання
гомоферментативних молочнокислих бактерій зумовлено їх високою біологічною та
антагоністичною активністю до сторонньої мікрофлори , що дає змогу надати
напоям принципово нової якості й забезпечити їх лікувально-профілактичні
властивості.
У результаті проведених досліджень визначено технологічну
придатність нових штамів мікроорганізмів до використання в технології
ферментованих напоїв та оптимальні умови їх культивування. Встановлено значні переваги
нових асоціацій дріжджів і молочнокислих бактерій перед традиційними:
скорочення терміну приготування виробничих культур мікроорганізмів у 1,3-1,8
раза; зменшення тривалості зброджування сусла в 1,5-1,6 раза, завдяки чому без
додаткових капітальних витрат можна збільшити випуск готової продукції на
25-30%; досягти економії витрат цукру на культивування мікроорганізмів на
25-30%; збільшити мінімальний термін використання асоціацій з 14 діб до 5-6
місяців; поліпшити мікробіологічну чистоту виробництва та бактеріологічні і
органолептичні показники готових напоїв тощо.
Проведені у
виробничих умовах дослідження підтвердили високу ефективність використання
запропонованих рас мікроорганізмів у технологіях безалкогольних ферментованих
напоїв.
2.4
ПОЗИТИВНІ ТА НЕГАТИВНІ НАСЛІДКИ ВИКОРИСТАННЯ ГМП
Картопля, що не
їсть колорадський жук; помідори, стійкі до морозів; кукурудза, не чутлива до
ядохімікатів, - все це не що інше, як генетично модифіковані організми (ГМО).
Сьогодні їх більше 120, і зустрічаються вони не тільки в закритих лабораторіях
і на експериментальних полігонах, але й на прилавках ринків і магазинів. Це при
тім, що вчені не можуть поручитися за їхню стовідсоткову безпеку. Так є або не
є ГМО? У чому плюси, а в чому їхні мінуси?
Генетично модифіковані продукти позбавлять людство від голоду
Це основний плюс
генної інженерії. Населення земної кулі неухильно росте, і, за прогнозами фахівців,
у недалекому майбутньому перенаселену планету чекає голод. Оскільки штучно
скорочувати приріст населення нереально, учені вирішили вдосконалити
агротехнології, адже бур'яни, шкідники, погана погода й різні захворювання
наносять урожаю велика втрата. Саме для цього минулого винайдені генетично
модифіковані рослини. Суть нових технологій така: у ДНК одного живого організму
пересаджується фрагмент ДНК іншого, у результаті чого перший здобуває нові
якості. Так, помідорам підсадили ген камбали, і вони стали морозотривкими, а в
кукурудзу ввели гени скорпіона, які зробили її невразливої для шкідників. ДНК
свині «збагатили» генами шпинату, сподіваючись, що м'ясо вийде більше пісним, а
в геном картоплі додали ген ґрунтового мікроорганізму, щоб він був неїстівним
для колорадського жука.
Організми зі зміненим генотипом можуть мутувати
Великий мінус.
Генетики визнають, що втручання в геном живих організмів не може пройти
безвісти, тому що кожний ген у молекулі ДНК за щось відповідає. Міняючи цю
зроблену структуру за своїм розсудом, людина порушує налагоджений природою
механізм. Чим це обернеться в майбутньому, припустити дуже важко, хоча наочний
приклад уже є. Так, генетично змінений лосось, що був виведений американськими
вченими, крім величезних розмірів і значної ваги (до 250 кг) придбав ще одну особливість - став ущипливо-зеленого цвіту. Причому таке офарблення
поширилося не тільки на верхні шари шкіри рибини, але й на її внутрішні органи.
Так що мутацій можна чекати й від інших «перероблених» організмів, головне -
щоб вони були необразливими.
Більшість ГМ-білків чужорідні. Вони чаші всього виявляються
токсичними й викликають алергію
Вирощувати трансгени набагато дешевше
Безсумнівний
плюс. В економічному плані генна інженерія - суцільна вигода. По-перше, строки
виведення нового сорту скоротилися до мінімуму: тепер на появу поліпшеного
варіанта організму йде 2-3 року замість 10, які доводиться затрачати під час
традиційного схрещування. А. це значить, що заощаджується й час, і гроші, які
звичайно йдуть на селекційні роботи. По-друге, трансгенам, стійким до
комах-шкідників, не потрібні ядохімікати - знову-таки, що вимагають витрат.
По-третє, урожайність невибагливих генетично модифікованих організмів на 15-25%
вище, ніж у звичайних. Коротше, вирощуючи ГМ-сорту, аграрії затрачають в 6 разів менше грошей, чим на натуральні (біологічні) рослини.
ГМО викликають алергію
Ще один мінус. В
останні роки в усім світі значно зросла кількість аллергіків. Основні причини,
на думку фахівців, - безконтрольний прийом ліків, харчових добавок і вживання
трансгенних продуктів. ГМО викликають алергію насамперед тому, що після
пересадження нових фрагментів у молекулу ДНК, що є молекулою білка, утворять
нові форми протеїнів. А з більшістю ГМ-білків людин ніколи не доводилося
зіштовхуватися - по суті, вони для нього чужорідні. Чи так варто дивуватися, що
такі протеїни не переварюються в нашім організмі, чаші всього виявляються
токсичними й викликають алергію?
Вирощуючи ГМ-сорти, аграрії затрачають в 6 разів менше грошей, чим на біологічні рослини
У деяких сортах трансгенів занадто багато сільхозхімії
Це мінус. Учені
вивели кілька сортів модифікованої кукурудзи й сої, нечутливих до високих
концентрацій гербіцидів (ядохімікатів, що знищують бур'яни). Це ноу-хау
остаточно розв'язало руки аграріям, які раніше боялися переборщити з «хімією»,
щоб разом з бур'янами не загинули й культурні рослини. Нові сорти можна
поливати слонячими дозами гербіцидів. У результаті в ГМ-кукурудзі й сої накопичується
величезна кількість ядохімікатів, які, як відомо, здатні викликати захворювання
серцево-судинної й нервової систем, збої в роботі печінки, бруньок і навіть
рак.
Модифіковані рослини корисніше, ніж натуральні
Безумовний плюс.
Боротьба за врожай- не єдине завдання генетиків: деякі фахівці прагнуть
збільшити корисні якості продуктів. В одних вони штучно підвищили дозу
вітамінів і мікроелементів, в інші - живильну цінність, а на треті взагалі
поклали «місію» ліків. Так, американські вчені вирішили вивести нову породу
ГМ-курей, яйця яких будуть містити в собі речовини, що перешкоджають розвитку
онкологічних захворювань. Подібні вдосконалення із захватом приймають жителі
Нового Світу й Країни висхідного сонця - вони готові купувати ГМ-продукти хоч
сьогодні. А от консервативні європейці, незважаючи на рекламу, з підозрою
ставляться до подібного роду їжі.
Трансгенні рослини порушують екологію
Безумовний мінус.
Деякі сорти трансгенних рослин згубно діють на шкідників. Однак від контакту з
їхнім пилком гинуть і корисні комахи - сонечка, бджоли, метелики-монархи. Мало
того - фахівці не виключають можливості «пагона» чужорідного гена в дику
природу. Якими будуть наслідку - важко представити, одне ясно напевно генетичне
забруднення здатне порушити природний баланс і привести до екологічної
катастрофи, наслідку якої можуть бути набагато небезпечніше хімічного й
радіоактивного забруднення.
ГМО можуть виявитися смертельними для людини
Величезний мінус.
Супротивники генної інженерії вважають, що в нас є вагомі підстави побоюватися
білків бактеріального характеру, впроваджених у ГМ-картоплі. Така страшна
отрута як ботулін, – теж всього-на-всього білок, виділюваний бактерією, причому
його амінокислоти людський організм не сприймає й у підсумку гине. Тому
говорити про безпеку трансгенного картоплі не можна доти, поки ми не з'ясуємо, чи
не виробляють підсаджені в нього бактерії яких-небудь незвичайних амінокислот.
Втім, прихильники генної інженерії вважають подібні песимістичні прогнози
надуманими.
Вибираючи продукти харчування, звертайте увагу на впакування,
особливо якщо
мова йде про товари зі США, Аргентини й Канади
Трансгени нелегально поширюються по Україні
Мінус. У нас, як
і у всій Європі, ГМО не дарують. Сьогодні в Україні діють два закони, що
захищають права споживачів: перший забороняє вирощування трансгенних організмів
на нашій землі, а другий наполягає на обов'язковому маркуванні всіх продуктів,
що містять ГМО. Відповідно до законів, на впакуванні ГМ-продуктів, продаваних в
українських магазинах, повинне бути написане: «Не містить ГМО». Хоча припустимі
й інші варіанти: «Генетично модифікована продукція», «Продукція, отримана з
генетично модифікованих джерел» або «Продукція, що містить компоненти з
генетично модифікованих джерел». Тому, вибираючи продукти харчування, звертайте
увагу на впакування, особливо якщо мова йде про товари зі США, Аргентини й
Канади - основних виробників ГМО. Втім, навіть ретельно вивчивши етикетку,
споживач однаково ризикує купити трансгенний продукт. Українські гігієністи
затверджують, що багато виробників ковбас додають у м'ясний фарш соєвий білок,
що дуже часто виявляється генетично модифікованим. При цьому така інформація
найчастіше ховається на підставі того, що рецептура продукту - комерційна
таємниця.
3.
МЕТОДИ ЗАСТОСУВАННЯ ГЕНЕТИЧНОЇ ІНЖЕНЕРІЇ В МЕДИЦИНІ
Методи генетичної інженерії відкривають нові можливості
медицинської діагностики. Наприклад, ДНК або РНК вірусу можуть бути виділені у
дуже малій кількості для вивчення їх складу, послідовності нуклеотидів,
механізму реплікації; одержані при цьому дані, ймовірно, дозволять розрізняти
багато типів вірусів, і подібний метод буде виконувати важливу роль в
епідеміології та медицинській діагностиці.
Ці та інші більш загальні методи, пов'язані з синтезом
нуклеїнових кислот, корисні також для дослідження функцій мозку на
молекулярному рівні. У ряді лабораторій зв'язуванням антисироватки проти
пептидних гормонів з певними ділянками мозку ці гормони були знайдені в мозку.
Можна синтезувати ДНК-копії, послідовності нуклеотидів яких відповідають амінокислотним
послідовностям поліпептидних гормонів, а потім ввести їх у клітини мозку, які,
згідно з припущеннями, синтезують ці гормони. Якщо це дійсно так, молекули ДНК
будуть зв'язувати мРНК гормонів і чим ближче подібність між гормоном та
речовиною, що синтезується в мозку, тим міцніше ДНК-копії будуть зв'язуватися з
мРНК. Це дозволить проаналізувати послідовності нуклеотидів виявлених таким
чином мРНК та встановили відмінності між уже відомими поліпептидними гормонами
і речовинами, що утворюються в клітинах мозку. Такий молекулярний підхід значно
ефективніший, ніж традиційні імунологічні підходи, які полягають перш за все в
очищенні поліпептидних гормонів, потім в одержанні антитіл проти них, які
тільки після цього використовуються для дослідження мозку або його клітин з
яких він складається.
Заслуговують на увагу дослідження в цій області, які
проводять Вілла-Комарофф в Медицинській школі Масачусетського університету
(Бустер). Одержавши з ракової пухлини підшлункової залози ДНК-копію гену
інсуліну пацюка та використовуючи її в якості проби, Вілла-Комарофф зробила
спробу знайти мРНК інсуліну в мозку; мета експерименту полягала в тому, щоб
розв'язати суперечку між нейробіологами, які використовують імунологічні
методи, про те, чи присутній в мозку інсулін. Вілла-Комарофф встановила, що
інсулінова ДНК-проба зв'язувалась з двома мРНК із мозку дорослих пацюків, але
ці мРНК кодували не інсулін. Разом з колегами вона продовжила експерименти на
ембріонах мишей та новонароджених тваринах і знайшла в них у мозку п'ять різних
мРНК, які нагадували мРНК інсуліну; в мозку дорослих тварин ці мРНК не були
знайдені. В мозку ембріонів людини вона відкрила дві мРНК, нагадуючі мРНК
інсуліну. Роль пептидів, що кодуються цими мРНК, була невідомою. Вілла-Комарофф
припустила, що вони можуть бути факторами росту, і їх біологічну функцію
вдасться встановити після синтезу цих білків в клітинах бактерій.
Гудмен з Масачусетського головного госпіталю здійснив пошук у
мозку соматостатину. Цей гормон був раніше знайдений в гіпоталамусі та
острівцях Лангерганса в підшлунковій залозі. Гудмену вдалося виділити мРНК із
островків підшлункової залози морського диявола, потім він синтезував її
ДНК-копію і, використовуючи її в якості проби, знайшов мРНК соматостатину в
мозку жаби. За допомогою цієї ж ДНК-проби він виділив мРНК соматостатину з
карциноми мозку пацюка; це дало йому можливість синтезувати ДНК-копію мРНК
соматостатину ссавця й ідентифікувати гормон у мозку пацюка. В подібних
дослідженнях Робертс в Колумбійському університеті спробував відшукати
рілізінг-фактор лютеїнізуючого гормону (РФЛГ), Герберт в Орегонському
університеті - енкефалін, Лунд в Масачусетському головному госпіталі -
глюкагон. Таким чином, з'ясувалося, що поліпептидні гормони утворюються не
тільки в ендокринних залозах, звідки вони транспортуються з током крові до
органів-мішеней, але й присутні також у мозку. Функцію їх в мозку ще необхідно
з'ясувати, з цією метою вчені використовують сучасні методи молекулярної
біології.
3.1 БІОМАТЕРІАЛИ
Протези та штучні пристрої для заміни пошкоджених частин тіла
або компенсації їх дисфункції виготовляються з полімерів (поліефірів,
силіконів, метілполіметакріламіду, поліетілену), сплавів металів (нержавіючої
сталі, сплавів хрому, кобальту і молібдену, титану та титанових сплавів), кераміки
(глинозему, склокераміки) та композитних матеріалів (вуглець вуглецевих,
полімерно-графітних або скляних волокон). Реакція тканини на контакт з цими
матеріалами може викликати необхідність видалення протез. Щоб уникнути подібних
небажаних реакцій або суттєво їх знизити, вчені розробили матеріали нового типу
- біоматеріали.
Ці біосумісні матеріали призначені для "роботи в умовах
біологічної напруги" і тому пристосовані для багатьох цілей. У області
серцевої та артеріальної хірургії дослідження біоматеріалів спрямовані на
розробку нових засобів, які надають антикоагулянтних властивостей поверхні
полімерів, таких, як полістирен, поліетилен та полісахариди. Для цього
використовуються сполуки, здатні, подібно гепарину, перешкоджати скипанню
крові. Для попередження серцевих нападів у якості венцевих мостиків можуть бути
використані трубки дуже малого діаметру, виготовлені з таких полімерів.
Використання сплавів металів для протезування суглобів дуже ускладнено,
поскільки за своїми механічним властивостям вони дуже відрізняються від кісток.
Кераміка і особливо кальцинований глинозем мають відмінну біосумісність, вони дуже
стійкі до зношування, але легко ламаються. Такі біоматеріали, як похідні фосфату
кальцію та гідроксіапатіти, зі структурою, подібною до структури кістки, можуть
заселятися клітинами кісткової тканини завдяки своїй пористості та хімічній
подібності до кісткової тканини. З 1974 р. виробляються складні суміші, до складу
яких входять гідроксиапатити, фосфоалюмінати кальцію та фторапатити. Помітна роль
у створенні замінників сухожиль та зв'язок буде належати волокнам, виготовленим
з вуглець-вуглецевих сумішей, та пластинкам різної жорсткості, одержаним з вуглець-вуглецевих
та епоксивуглецевих сумішей, а також полімерно-вуглецевим волокнам, що підлягають
біодеградації. Використання полімерів, що підлягають біодеградації, наприклад, сополімерів
гліколової та молочної кислот, дозволить уникнути повторних операцій для
видалення пластинок, встановлених під час першої операції.
Нові біоматеріали знайшли також застосування у виробництві
тонких та гнучких контактних лінз; їх виготовляють з макромолекулярних гелів,
вміст води в яких складає більше 80%, це забезпечує достатню дифузію кисню та
двоокису вуглецю.
Подальший прогрес в цій галузі дозволить розширити сферу
застосування таких лінз, покращити корекцію зору і навіть відмовитись від введення штучних кришталиків
хворим після хірургічного лікування катаракти.
Замінники крові є предметом активних досліджень в США та
Західній Європі: розробляються "штучні клітини", які складаються з
гемоглобіну, зануреного в мікроскопічні гранули із синтетичних полімерів;
фторвуглецеві сполуки, що транспортують кисень; у якості замінників сироватки
використовуються декстрани та желатіни. Однак ці речовини не завжди добре
переносяться, тому можуть бути, синтезовані розчинні полімери, які легко
підлягають біодеградації, наприклад, сополімери гліколевої та молочної кислот,
які використовуються замість кетгуту для внутрішніх швів при хірургічних
операціях.
Для всіх подібних досліджень біоматеріалів вкрай необхідна
співпраця спеціалістів та техніків, які працюють в різних областях; методи
генетичної інженерії та біотехнологічні процеси можуть привести до значного
прогресу в цій важливій області, яка має економічний, соціальний та етичний
аспекти. Ці роботи є складовою частиною досліджень та досягнень, які
започаткували медицинську та біологічну інженерію, необхідну технологічну
основу подальшого прогресу в області медицини.
Ці різноманітні прикладні праці відіграють суттєву роль в
медицині майбутнього, яка буде не просто "мистецтвом" діагностики та
лікування захворювань; вже тепер її орієнтація все більш зміщується на
попередженні захворювань на основі результатів
біологічних досліджень, які виявляють причини та розвиток хвороб.
Відкриття широкого спектру речовин з
терапевтичною і дуже точною дією, присутніх в нормі в організмі, таких як
антидепресанти, ендорфіни, гормони і продукти імунної системи, поклало шлях до
створення "природної" терапії, при якій ці нативні речовини з
організму людини будуть компенсувати фізіологічні дефекти, що спричиняють
більшість патологічних станів. Ця природна терапія відрізняється від терапії на
основі рослинних речовин, частина яких високотоксична. Вона полягає у введенні
та стимуляції або, навпаки, пригніченні гормонів, ферментів, хімічних
медіаторів, необхідних для функціонування організму, дефекти і порушення
рівноваги в якому є причиною патологічних станів та більшості хвороб. Ось чому
методи генетичної інженерії покликані зробити вагомий внесок в розвиток
медицини, полегшуючи синтез в клітинах мікроорганізмів або в культурі клітин
таких гормонів, медіаторів та факторів, які відповідають за природні засоби
захисту організму. Таким чином, відпадає необхідність у складному да дорогому
хімічному синтезі цих сполук.
3.2 ГЕНЕТИЧНА ІНЖЕНЕРІЯ В
ЕПІДЕМІОЛОГІЇ
Дж. Сіла, англійський вчений, який одним з перших припустив
вірусне походження СНІДу (1984), стверджує, що це не просто епідемія, а
пандемія, яка може найближчим часом (через 20—ЗО років) знищити 50% населення
земної кулі.
Першими, хто встановив і виділив вірус СНІДу, були французькі
та американські вчені. Це РНК- вмісний вірус, який своєю морфологією, структурою
геному й деякими іншими ознаками подібний до ретровірусів, підродина
лентивірусів (патогенний вірус вісна овець) та належить до родини лімфотропних
ретровірусів. Зазначені патогени спричинюють імунодепресивні та неопластичні захворювання
людини і тварини після тривалої лактації як екзогенні віруси, що уражують зрілі
Т-лімфоцити .
За даними Жданова (1987), до підродини лентивірусів належать
патогени імунодефіциту людини, мавпи, вірус інфекційної анемії коней, вірус
вісна овець, вірус артриту, енцефаліту кіз. Це так звані повільні інфекції, що
й зумовило назву лентивірусів. Інкубаційний період у них триває місяцями й
роками, і тому ця хвороба має перебіг, подібний до хронічної.
Геном вірусу ВІЛ (вірус імунодефіциту людини) за своєю
структурою складніший геному будь-якого з відомих ретровірусів.
Геном вірусу СНІД близький до структури HTLV—1 HTLV-II і вміщує
додатково, як мінімум чотири гени tat — (трансактивуючий ген) — виконує
подвійну функцію: регулює транскрипцію вірусних генів — утворення матричної РНК
і впливає на синтез вірусних протеїнів. Аrt — контролює рівновагу між різними
мРНК при їх синтезі. Функції генів short ореn reading frame 3'ort (З'ореn
reading frame) ще не визначені. Гени tat та аrt є преривними, а за ними
розташований ще один ген — З'orf. Допоміжні гени підвищують активність вірусу
СНІД, підсилюють діяльність генів у багато разів та прискорюють розповсюдження
хвороби.
За даними Сепашвілі (1988), гени можуть кодувати один або
кілька білків і в останньому випадку спочатку синтезують
поліпротеїни-попередники, потім з них протеазами нарізають кінцеві продукти —
білки, які далі підлягають глікозуванню та фосфорилуванню.
Лімфоцити — основні клітинні форми імунної системи, які
забезпечують захист гомеостазу організму від чужорідних антигенів. Залежно від
місця дозрівання вони поділяються на Т- і В-лімфоцити. В свою чергу розрізняють
три різновидності Т-лімфоцитів. Це Т-кіллери ("вбивці"), які руйнують
чужорідні клітини; Т-супрессори або Т 8 клітини, функція яких пов'язана з
блокуванням антитілоутворення В-лімфоцитами та пригніченням реакцій клітинного
імунітету; Т-хелпери, Т 4 клітини, які продукують медіатори клітинного
імунітету, стимулюють реакції імунітету і сприяють становленню гуморального
імунітету.
Як
встановлено, Т-хелпери відіграють найважливішу роль у регуляції активності всіх
елементів імунної системи. Роль пускового механізму в патогенезі захворіння
відіграє цитопатична дія ВІЛ та Т-хелпери (наприклад, ЦНС травного каналу,
очей).
У розвитку СНІДу важливе значення мають генетичн: фактори,
один з яких — групоспецифічний компонент (ГСК] або фактор, який зв'язує вітамін
Б та являє собою білок з трьома загальними поширеними алелями — 1Р; 1; 2. СНІД
не розвивається при наявності ГСК-2 в гомозиготному стані. Вважають що ГСК-2 є
можливим показником захисту проти розвитку СНІДу, тоді коли наявність ГСК-1Р
вказує на схильність до цього захворювання.
Зріла вірусна частинка ВІЛ в середньому досягає в діаметрі
від 100 до 120 нм. Геном вірусу являє собою двоспіральну РНК. До її складу
входить понад 9500 пар простих хімічних сполук. Крім того, серцевина вірусних
частинок (віріонів) містить три білки з молекулярною масою 24кД(Р24),
18кД(Р18), 1ЗкД(Р1З). До складу віріону входить ще два білки: Р18 (розташований
безпосередньо під зовнішньою оболонкою серцевини), та Р24, які формують футляр
для вірусної РНК і ферменту — зворотньої транскриптази. Зовні віріон покритий
ліпідною мембраною, яка складається з двох шарів пронизаних глікопротеїнами.
У наукових працях Фролова (1989), Сепіашвілі (1988), Ритік,
Коломієць, Коломієць (1988) детально описано фізико-хімічні властивості ВІЛу,
його терапія. Разом з цим встановлено, що ВІЛ дуже стійкий проти іонізуючої
радіації та ультрафіолетового опромінення. Нині відкриття засобів та методів
впливу на різні стадії розмноження в клітині вірусу імунодефіциту є основною проблемою
сучасної науки.
Складним у
боротьбі з цією епідемією є створення вакцин проти ВІЛ, оскільки патоген
належить до родини ретровірусів. Зазначені віруси протягом всього періоду їх
вивчення (починаючи з 1904 р.) були об'єктом суто теоретичних досліджень,
спрямованих на визначення механізмів вірусного канцерогенезу або лейкогенезу,
які відбуваються в організмі тварин.
Збуднику СНІДу в зараженому організмі властива
значна мінливість. Генетична речовина (рибонуклеїнова кислота), ідо становить
основу вірусу, зазнаючи змін, стає хімічно подібною до тих генетичних структур,
які управляють життєдіяльністю клітин організму й конкретно лейкоцитів крові. Структури,
досягаючи подібності, зливаються між собою і існують так необмежено довго. В
результаті у живій клітині організму, підпорядковуючись біохімічним законам, процесами
життєдіяльності починають керувати віруси, присутні в її ядрі. Потрапляючи в сприятливі
умови, вірус починає атакувати клітину і при цьому завжди перемагає. Це і є
початком хвороби організму.
Важлива роль у створенні сучасних препаратів проти СНІДу
належить генетичній інженерії. Передусім це препарати, створені з суміші
гормонів вилочкової залози (орган, де одержують інформацію уражені ВІЛ захисні
клітини Т-лімфоцити). Використовують біопрепарати інтерферон, інтерлейкін
(продукт лейкоцитів) та ін.
Одержати ідеальну високоефективну вакцину проти СНІДу дуже
важко через мінливість антигенного складу основних поверхневих глікопротеїдів
ВІЛу, високий рівень мутації вірусу насамперед в ділянці гена еnv, необхідності
створення захисту не тільки від вільних (інтактних) вірусних частинок, які
знаходяться у крові, лімфі або у міжклітинному просторі, а й проти інфікованих
клітин, оскільки ВІЛ може передаватися від клітини до клітини в імунні системи
або ЦНС, а також у зв'язку із здатністю вірусу «ховатися» в тканинах ЦНС, які захищаються від специфічних антитіл гематоенцефалітним бар'єром.
У генно-інженерних лабораторіях США та Франції одержано
результати про успішне використання вбитої вакцини для захисту мавп від
збудника СНІДу людини, а також про властивості рекомбінантних антигенів ВІЛ
індукувати відповідь з захисною активністю, спрямованою на різні варіанти
вірусу. Останнє стало поштовхом до активізації роботи по конструюванню живої
вакцини проти СНІДу на базі рекомбінантного вірусу вісповакцини. Суть роботи
полягає в тому, що у гені вірусу вісповакцини (який є вектором), використовуючи
рестріктази та лігази, вбудовують фрагмент геному збудника СНІДу, ту її ділянку
або гени, які відповідальні за синтез зумовлених білків ВІЛ, передусім
оболонкових глікопротеїдів. У результаті одержують такий гібрид вірусу, що
проникає в клітини та, розмножуючись у них, крім власних білків вірусу
вісповакцини, спричинює синтез глікопротеїдів ВІЛ. В організмах, у які введено
зазначений вірус на синтезуючі білки (в тому числі і на білки вірусу СНІД),
індукується утворення нейтралізуючих антитіл.
Перші
випробування такої рекомбінантної вакцини, створеної Загурі, професором
Паризького університету ім. подружжя Кюрі, були проведені на ньому та десяти
добровольцях із Заїру, в сироватках крові яких були відсутні антитіла до ВІЛу. Наступні
спостереження показали, що у сироватці крові вакцинованих з'являються антитіла,
які нейтралізують в системі іn vitro вірус СНІДу того ж субтипу, який
використовували для одержання вакцини, але не інший генетичний варіант збудника
хвороби.
Вакцинація зумовила стимуляцію відповіді клітини -мітоз
лімфоцитів та експресію Т-клітинних рецепторів для інтерлейкіну-2. Одержані
результати дають підставу сподіватися, що вакцина як профілактичний засіб
допоможе у боротьбі з цією страшною хворобою.
Методи генетичної інженерії широко використовують у боротьбі
з вірусними захворюваннями тварин і птиці, що яскраво підтверджує приклад
виведення птиці, стійкої проти лейкозу. Із вірусних захворювань птиці лейкоз
найбільш розповсюджений. До нього сприйнятливі всі види сільськогосподарської
птиці, але найбільше — кури. Зазначене захворювання реєструється у всіх країнах
з розвиненим птахівництвом, що пов'язано в основному з шляхами передавання
збудника (вірус із родини ретровірусів). Він передається не тільки контактним
шляхом, а й через яйця. Зважаючи на це, ветеринарно-санітарні заходи по
боротьбі з інфекцією відіграють не вирішальну, а лише допоміжну роль.
Лікування від хвороби не розроблено. У більшості країн кращим
методом боротьби з інфекцією є створення стійких проти хвороби ліній птиці. Але
в результаті традиційної селекції одержати птицю, повністю стійку проти зараження
і не здатну передавати збудник нащадкам, не вдається.
Вчені регіональної птахівничої лабораторії в Іст Лансінгу
(штат Мічіган, США), підійшли до вирішення цієї проблеми на біоінженерному
рівні.
Принцип цього підходу грунтується на природному механізмі дії
вірусів, що викликають лейкоз. Тільки замість патогенного вчені використали
дефектний (генетично змінений вірус), який здатний розмножуватися, але його ДНК
(гени), поєднуючись з ДНК клітин зародка, передаються нащадкам і блокують
клітину (займають місце) від проникнення і розмноження патогенного вірусу.
Дефектний вірус сконструювали шляхом поєднання відповідних генів ретровірусів.
Методика цієї
роботи така (Кононенко, 1988). Дефектний вірус ввели в жовтки добових яєць, що
інкубували, за допомогою голки. Отвір на місці проколу в шкаралупі заклеювали.
Використовували яйця, що не заражені вірусом. У виведеної із цих яєць птиці
досліджували клітини крові на наявність генів введеного вірусу. Півнів, що мали
ці гени, парували з курками, вільними від вірусу, а клітини крові їх нащадків
також досліджували. Так було одержано три покоління птиці, які стабільно зберігали
гени дефектного вірусу і були стійкі проти лейкозу.
Нині стоїть
завдання використовувати віруси як перенощики генів не тільки для створення
стійкої до захворювання птиці, а й для підвищення її яєчної і м'ясної
продуктивності з меншими затратами кормів і поліпшенням смакових якостей цієї
продукції.
4.
ПРОБЛЕМИ ВИКОРИСТАННЯ ГЕНЕТИЧНО МОДИФІКОВАНОЇ СИРОВИНИ
Учені багатьох
країн виражають серйозну стурбованість відносно гарантії безпеки використання
генетично модифікованої харчової сировини й продуктів його переробки.
Багато вчених США
вважають, що такого роду харчова сировина не повинне використатися для
харчування людей і годівлі тварин продовольчого призначення. На етапах
вирощування й переробки генетично модифіковане (ГМ) сировина не повинне змішуватися
зі звичайною харчовою сировиною через можливий негативний вплив і небезпеку для
здоров'я людини.
У цей час у
відношенні ГМ сировини виникло багато питань внаслідок відсутності
експериментально обґрунтованих відповідей і недостатньої вивченості наслідків
його постійного й тривалого застосування для масового харчування. Поки немає
науково обґрунтованих відповідей у відношенні його екологічної, біологічної,
харчової, кормової й медичної безпеки з обліком можливих віддалених негативних
ефектів для організмів різного рівня організації. Вони можуть проявлятися в
різний термін залежно від видових особливостей, організмів, їхнього віку й
фізіологічного стану, а також особливостей хімічного складу джерел харчування й
середовища перебування.
Деякі дослідження свідчать про те, що зміст білка, незамінних
амінокислот і вітамінів перебуває на однаковому рівні або навіть нижче в ГМ
продукції в порівнянні зі звичайної.
Генна технологія дозволяє одержувати сорти плодів і овочів,
що характеризуються більше високою стійкістю до микробіальних захворювань.
Однак поки не з'ясовані причини такого роду змін і не встановлені речовини, що
гнітять розвиток грибків, бактерій, вірусів. Немає відповідей і на питання,
чому колорадський жук не може харчуватися ГМ картоплею, які антиживильні
речовини представляють для нього небезпека і як вони можуть впливати на
мікрофлору кишечнику й організм людини?
На думку ряду вчених, фахівців і практиків, широке поширення
ГМ рослин може негативно відбитися на біологічній розмаїтості живого світу й
привести до ще більшої зміни середовища перебування.
Пилок ГМ-рослин розноситься потоками атмосферного повітря,
комахами й птахами в біосферний простір і попадає в екосистеми, що
довгостроково формувалися в природних умовах, що може викликати непередбачені
зміни й необоротні негативні процеси. У лабораторних умовах дослідники часто
проводять схрещування, які зовсім не характерні для природного середовища
перебування. Наприклад, для експериментів використають ген риби й томатів,
людину й риб, медуз і мишей і ін.
На думку багатьох учених різних країн, необхідно враховувати
не тільки що швидко проявляються, але й досить віддалені ефекти ГМ-продуктів
харчування.
Відомі приклади результатів досліджень, проведених у ряді
країн, свідчать про необхідність більше глибокого й тривалого вивчення
ГМ-організмів.
Ученими виявлено, що синтез білка ГМ зміненими організмами
може давати нові властивості, що характеризуються сильної аллергенністю.
Наприклад, після введення в сою генів бразильського горіха з метою підвищення
змісту в ній білка боби цієї культури стали викликати більше високу
аллергенність у людини. У Японії був отриманий ГМ триптофан і використаний для
лікування депресій. У результаті його споживання заболіло 5 тис. чоловік, і
1500 чоловік стали інвалідами.
Британський професор А.Пуштай назвав генетично модифіковані
продукти «їжею зомбі». Ця назва дана через те, що в процесі підгодівлі ними
пацюків виявлене зменшення обсягу мозку, руйнування печінки, деформація шлунка
й гноблення імунітету.
Щодо доцільності харчування людей генетично зміненими
продовольчими організмами поки немає переконливих експериментальних доказів, а
також економічних і екологічних пророблень. Генна технологія, як і раніше
застосовується «хімізація» продовольчих організмів, поки не має вагомих
науково-практичних доказів високої корисності й гарантії нешкідливості для
людства й середовища його перебування.
Небезпека генної
інженерії деякі вчені, у тому числі лауреат Нобелівської премії 1995 р.
Дж.Ротблат, зіставляють зі створенням нових видів зброї масової поразки. але
більше доступних, чим ядерне. Як відомо, мікроорганізми, гриби, рослини й
тварини мають різноманітні природні видові ознаки. За кожний властиві їм ознака
відповідає певні ген, що являє собою відрізок молекули дезоксирибонуклеїнової
кислоти (ДНК). Додавання гена іншого організму сприяє появі нової позитивної
або негативної якості в генетично модифікованих живих істотах. Нові генетично
змінені організми називають мутантами або трансгенними. До теперішнього часу
вуж відомі небезпечні зміни, що відбуваються в результаті дослідницьких
маніпуляцій з генами різних видів організмів. Наприклад, експерименти вчених
Мичиганского університету показали, що створення стійких до вірусів рослин за
допомогою генної інженерії викликає мутації й негативного характеру. Вони
сприяють появі нових мутованих вірусів, які для рослин ще більш небезпечні й
вирулентні. Не менш цікаві результати для практичних висновків отримані вченими
штату Орегона США. Як виявився, генетично модифікований мікроорганізм (Klebsiella
planticola) мав здатність швидко використати живильні речовини ґрунту.
Аналогічні властивості здобували й деякі інші бактерії після генетичних змін (Rhizobium
melitoli і ін.).
У різних країнах миру неоднозначно оцінюють генетично
модифіковані мікроорганізми й харчова сировина рослинного й тваринного
походження. Так, мораторій на ввіз ГМ харчової сировини й продуктів його
переробки уведений в Австрії, Великобританії, Греції, Люксембурзі, Франції й
деяких інших країнах. У ряді держав ЄС прийнятий закон про обов'язкове
маркування харчової продукції, що містить більше 1 % трансгенних компонентів.
Обов'язкове маркірування ГМ продукції уведене у Великобританії, Німеччині,
Люксембурзі, Нідерландах, Норвегії, Франції, Швейцарії, Швеції. Тоді як в
Австралії, Канаді, Новій Зеландії, США й деяких інших країнах генетично змінені
продукти харчування маркірують тільки за бажанням виробника.
У Російську Федерацію надходять генетично модифіковані
пшениця, кукурудза, соя й продукти їхньої переробки. Методи ідентифікації трансгенної
харчової продукції досить дороги; поки не доступні для широкого застосування й
недостатньо відпрацьовані й досконалі. Це істотно утрудняє об'єктивну оцінку
нешкідливості генетично модифікованих продуктів харчування вітчизняного й
закордонного виробництва. У той же час гарантія їхнього обов'язкового
маркування відсутній у ряді країн, що лідирують по обсягах їхнього виробництва
й розмаїтості видів. У Росії з 1 липня 2003 р. ГМ продукція повинна маркіруватися й мати реєстраційне посвідчення на підставі медико-біологічних,
гігієнічних досліджень і результатів перевірки на мутагенність, канцерогенність
і ряду інших небезпечних властивостей.
У сучасних екологічних умовах генна інженерія може принести
як більшу користь, так і величезна непоправна шкода. Є досить практичних
прикладів в області харчування, здоров'я й екології, щоб зробити об'єктивні
висновки як про небезпечний, так і перспективні напрямки в області генетичної
зміни живих організмів. Без серйозних наукових розробок і обґрунтованого
виявлення корисних напрямків продовольчого, медичного, екологічного характеру
не можна перетворювати все людство в піддослідних істот, а планету робити
дослідницьким полігоном. Сьогодні вже є велика кількість негативних результатів
внаслідок необґрунтованого масштабного застосування ксенобіотиків різної
природи.
Подальші
перетворювальні кроки людства повинні бути надзвичайно обережними з урахуванням
біологічних законів, необхідності захисту й збереження середовища перебування й
повноцінності природних організмів, у тому числі й продовольчому призначенні.
ВИСНОВОК
Введення системи контролю й всебічної експертизи харчової
продукції з генетично модифікованих джерел викликано в першу чергу турботою про
безпеку людей, - уважає заступник директора Медико-генетичного наукового центра
РАМН, д-р наук, проф. С.А. Шишкін. Убудовані в генетичний код мікроорганізмів,
рослин і тварин генно-інженерні конструкції теоретично можуть бути
небезпечними. Важко сказати, у яких саме формах це може виявитися. Приміром,
людина, що вживала продукти або ліки на основі такої сировини, може перестати
адекватно реагувати на певні ліки, тобто придбати лікарську стійкість. Тому всі
подібні продукти повинні проходити всебічну експертизу. Дуже важливо, що
проблема поставлена саме зараз, поки суспільство ще не зіштовхнулося на
практиці з теоретично можливими труднощами. Наші вчені давно стурбовані
можливими наслідками генної інженерії.
Тільки після
перевірки на мутагенність і канцерогенність, а також надання матеріалів досліджень
на тваринах і людях-добровольцях, підприємства-виробники й імпортери такої
продукції можуть розраховувати на одержання офіційного реєстраційного
посвідчення. Воно буде видаватися компетентними органами на 3 роки, а після
благополучної перереєстрації - на 5 років. Після того як новий порядок почне
діяти, споживачі зможуть жадати від продавця генетично модифікованої продукції
офіційне свідчення безпеки його товару.
Варто підтримувати декларацію Громадської організації
"лікарі й учені проти модифікованих за допомогою генної інженерії
продуктів харчування", у якій звернене увага громадськості на наступне:
·
НЕПРАВИЛЬНО
експлуатувати технологію, що може непередбачено викликати поява небезпечних для
здоров'я речовин, перш ніж не буде ретельно вивчена можливість такого ризику.
·
НЕПРАВИЛЬНО
експлуатувати технологію, що може зробити необоротний вплив на навколишнє
середовище, перш ніж не буде доведено, що дана технологія не заподіє серйозного
збитку навколишньому середовищу.
·
НЕПРАВИЛЬНО
піддавати людей і навколишнє середовище навіть найменшої небезпеки, зважаючи на
те, що в цей час наявні продукти харчування, модифіковані за допомогою генної
інженерії, не представляють цінності або вона незначна.
·
НЕПРАВИЛЬНО
сьогодні виправдувати експлуатацію потенційно небезпечної технології, приводячи
в обґрунтування науково недоведена думка, що ця технологія може дати корисні
продукти в майбутньому.
Однак це не означає, що дослідження в цій області й дослідній
перевірці їхніх результатів повинні бути припинені. Звісно ні. Особливої уваги
заслуговують наступні аспекти. Перший - медико-генетичної, оцінюючої зміни в
генотипі даної рослини або тварину й можливість їхній наступного впливу на
людину. Другий - технологічний, що встановлює, що отриманий цим методом продукт
не міняє свої технологічні властивості.
І третій - медико-біологічна оцінка впливу трансгенних
продуктів на імунний статус організму, систему ферментного захисту клітини.
Тільки після вивчення якісних показників продуктів генної інженерії, у тому
числі на декількох поколіннях лабораторних тварин, почнеться процес державної
реєстрації й дозволу до широкого використання при обов'язковому подальшому
моніторингу. Таке думка академіка РАМН В.А. Тутельяна.
Застосування продуктів харчування, отриманих за допомогою генної
інженерії, настільки серйозно, що навіть при наявності всіх розв'язних
документів, необхідна певна законодавча база, що дозволяє у випадках появи
негативних наслідків з юридичної точки зору вирішити проблему, що створилася.
Зважаючи на те,
що в науковому світі немає єдиної думки щодо безпеки ГМО, рішення є або не є
трансгенні продукти кожний повинен приймати самостійно. Однак вітчизняні
фахівці попереджають: у нашій країні із ГМО варто поводитися вкрай обережно,
оскільки ми ще не оправилися від наслідків Чорнобильської катастрофи, яка
нанесла здоров'ю українців непоправний збиток.
ЛІТЕРАТУРА
1.
Муромцев Г.С., Бутенко Р.Г., Тихоненко Т.И., Прокофьев М.И. Основы сельскохозяйственной
биотехнологии.- М.: Агропромиздат., 1990 .
2.
Муромцев Г.С., Ванюшин Б.Ф. Биотехнология на службе сельского хозяйства.- М.: Знание.,
1989.
3.
Коваленко В.П., Горбатенко І.Ю. Біотехнологія в тваринництві та генетиці.- К.:
Урожай., 1992.
4.
Коновалов В.С., Коваленко В.П., Горбатенко І.Ю. та ін. Генетика сільськогосподарських
тварин.- К.: Урожай., 1996.
5.
Маниатис Ф., Фрич Е., Самбрук Д. Молекулярное клонирование: лабораторное руководство.-
М.: Мир., 1985.
6.
Сассон А. Биотехнология: свершения и надеждьі.- М.: Мир., 1987.
7. Вердьішев Г.Д. Генетическая
инженерия и старение.- К.: Вища школа., 1988.
8. Ніколайчук В.І., Горбатенко І.Ю.
Генетична інженерія: Підручник. Ужгород. 1999.
|