Курсовая работа: Производство бета-каротина
Курсовая работа: Производство бета-каротина
Витамины (от
лат. vita - жизнь), группа органических соединений разнообразной химической
природы, необходимых для питания человека, животных и других организмов в
ничтожных количествах по сравнению с основными питательными веществами
(белками, жирами, углеводами и солями), но имеющих огромное значение для
нормального обмена веществ и жизнедеятельности.
Первоисточником
В. служат главным образом растения. Человек и животные получают В.
непосредственно с растительной пищей или косвенно - через продукты животного
происхождения. Важная роль в образовании В. принадлежит также микроорганизмам.
Например, микрофлора, обитающая в пищеварительном тракте жвачных животных,
обеспечивает их витаминами группы В. Витамины поступают в организм животных и
человека с пищей, через стенку желудочно-кишечного тракта, и образуют
многочисленные производные (например, эфирные, амидные, нуклеотидные и др.),
которые, как правило, соединяются со специфическими белками и образуют многие
ферменты, принимающие участие в обмене веществ. Наряду с ассимиляцией в
организме непрерывно совершается диссимиляция В., причём продукты их распада (а
иногда и малоизменённые молекулы В.) выделяются наружу. Недостаточность
снабжения организма В. ведёт к его ослаблению, резкий недостаток В. - к
нарушению обмена веществ и заболеваниям - авитаминозам, которые могут
окончиться гибелью организма. Авитаминозы могут возникать не только от
недостаточного поступления В., но и от нарушения процессов их усвоения и использования
в организме.
Основоположник учения о В. русский врач Н. И. Лунин установил (1880), что при
кормлении белых мышей только искусственным молоком, состоящим из казеина, жира,
молочного сахара и солей, животные погибают. Следовательно, в натуральном
молоке содержатся и другие вещества, незаменимые для питания. В 1912 польский
врач К. Функ, предложивший само название "В.", обобщил накопленные к
тому времени экспериментальные и клинические данные и пришёл к выводу, что
такие заболевания, как цинга, рахит, пеллагра, бери-бери, - болезни пищевой
недостаточности, или авитаминозы. С этого времени наука о В. (витаминология)
начала интенсивно развиваться, что объясняется значением В. не только для
борьбы со многими заболеваниями, но и для познания сущности ряда жизненных
явлений. Метод обнаружения В., примененный Луниным (содержание животных на
специальной диете - вызывание экспериментальных авитаминозов), был положен в
основу исследований. Было выяснено, что не все животные нуждаются в полном
комплексе В., отдельные виды животных могут самостоятельно синтезировать те или
иные В. В то же время многие плесневые и дрожжевые грибы и различные бактерии
развиваются на искусственных питательных средах только при добавлении к этим
средам вытяжек из растительных или животных тканей, содержащих витамины. Таким образом,
витамины необходимы для всех живых организмов. Изучение В. не ограничивается
обнаружением их в естественных продуктах с помощью биологических тестов и
другими методами. Из этих продуктов получают активные препараты В., изучают их
строение и, наконец, получают синтетически. Исследована химическая природа всех
известных В. Оказалось, что многие из них встречаются группами по 3-5 и более
родственных соединений, различающихся деталями строения и степенью
физиологической активности. Было синтезировано большое число искусственных
аналогов В. с целью выяснения роли функциональных групп. Это способствовало
пониманию действия В. Так, некоторые производные В. с замещенными
функциональными группами оказывают на организм противоположное действие, по
сравнению с В., вступая с ними в конкурентные отношения за связь со
специфическими белками при образовании ферментов или с субстратами воздействия
последних.
В. имеют
буквенные обозначения, химические названия или названия, характеризующие их по
физиологическому действию. В 1956 принята единая классификация В., которая
стала общеупотребительной.
Наличие
химически чистых В. дало возможность подойти к выяснению их роли в обмене
веществ организма. В. либо входят в состав ферментов, либо являются
компонентами ферментативных реакций. При отсутствии В. в организме нарушается
деятельность ферментных систем, в которых они участвуют, а следовательно, - и
обмен веществ. Известно несколько сот ферментов, в состав которых входят В., и
огромное количество катализируемых ими реакций. Многие В. - преимущественно
участники процессов распада пищевых веществ и освобождения заключённой в них
энергии (витамины B1, В2, PP и др.). Участвуют они и в процессах синтеза: B6 и
В12 - в синтезе аминокислот и белковом обмене, В3 (пантотеновая кислота) - в
синтезе жирных кислот и обмене жиров, Вс (фолиевая кислота) - в синтезе
пуриновых и пиримидиновых оснований и многих физиологически важных соединений -
ацетилхолина, глутатиона, стероидов и др. Менее изучено действие
жирорастворимых В., однако несомненно их участие в построении структур
организма, например в образовании костей (витамин D), развитии покровных тканей
(витамин А), нормальном развитии эмбриона (витамин Е и др.). Таким образом,
витамины имеют огромное физиологическое значение. Выяснение физиологической
роли В. позволило использовать их для витаминизации продуктов питания, в
лечебной практике и в животноводстве. Особенно широко стали применяться В.
после освоения их промышленного синтеза.
Витаминная
промышленность, вырабатывает синтетические витамины, коферменты в виде чистых
кристаллических веществ и готовых к применению форм (драже, таблетки, ампулы,
капсулы, гранулы, концентраты) и в небольших количествах витаминные препараты
из растительного и животного сырья. Витамины повышают пищевую ценность
продуктов питания, применяются в лечебной практике и для витаминизации кормов с
целью повышения продуктивности животноводства.
Производство
витаминов в нашей стране организовано в начале 30-х гг. Вначале выпускались
витаминные препараты из натурального сырья. Затем было освоено производство
синтетических витаминов С и K3. С 1949 по технологии, разработанной
советскими учёными, в промышленном масштабе стал осваиваться синтез других
витаминов, например тиамина (витамин B1). В 1950 производство витаминов в СССР
увеличилось по сравнению с 1940 в 5,6 раза. К 1955 в СССР были разработаны
схемы синтеза всех известных основных витаминов. Дальнейшее развитие витаминной
промышленности связано главным образом с разработкой и внедрением синтетических
методов производства витаминов. Эти методы по характеру технологических
процессов значительно сложнее, чем метод извлечения витаминов из натурального
сырья, но они позволяют получать продукцию в химически чистом виде, что имеет
большое значение для их лечебного применения и точных дозировок при
изготовлении кормовых концентратов. Кроме того, издержки на производство
синтетических витаминов ниже издержек на получение соответствующих витаминов из
натурального сырья. За 1959-65 в промышленном масштабе освоен синтез всех
известных витаминов и витаминных препаратов, введены в строй крупные витаминные
предприятия: Белгородский витаминный и Болоховский (Тульская область)
химические комбинаты, а также значительно увеличены мощности ранее
действовавших предприятий. В 1965 объём производства витаминной продукции в
СССР увеличился по сравнению с 1958 в 2,8 раза, а в 1970 по сравнению с 1965 в
2,6 раза. В 1970 выпуск синтетических витаминов и их готовых форм составил
более 99% всего объёма производства витаминной продукции.
К
специфическим особенностям синтеза витаминов относятся: многостадийность
процессов; значительная материалоёмкость, обусловливающая необходимость
размещения предприятий В. п. вблизи сырьевых баз; применение специальной
аппаратуры, предназначенной для работы с агрессивными средами; необходимость
выработки высокочистой продукции. Витаминные заводы - специализированные
предприятия. Преобладает предметная специализация - осуществление синтеза
витаминов на каждом предприятии по полной схеме их производства, включая и
выпуск всех полупродуктов. С конца 60-х гг. расширяется более эффективная -
технологическая специализация производства полупродуктов.
Научно-технические
проблемы получения витаминов и их применения разрабатываются в СССР в основном
во Всесоюзном научно-исследовательском витаминном институте, а также в
научно-исследовательских организациях АМН СССР, АН СССР и АН союзных республик,
министерств и ведомств. Вопросы совершенствования действующих производств
решаются центральными заводскими лабораториями.
Главные
направления развития витаминной промышленности в России:
- создание
новых высокоэффективных препаратов;
- совершенствование
технологии производства и разработка новых, улучшенных схем синтеза, основанных
на использовании дешёвых видов отечественного сырья;
- увеличение
выработки витаминов, коферментов и их готовых форм до уровня, обеспечивающего
полное удовлетворение потребностей народного хозяйства, расширение ассортимента
продукции;
- строительство
новых и реконструкция действующих производств;
- механизация
и автоматизация технологических процессов;
- совершенствование
и организация производства отдельных полупродуктов на предприятиях других
отраслей промышленности;
- повышение
качества продукции;
- углубление
технологической специализации;
- внедрение
автоматизированных систем управления отраслью промышленности и производством.
В наиболее
развитых странах, особенно в США, Японии, Великобритании, Германии, Франции,
Швейцарии, производство витаминов достигло больших размеров.
Как правило,
оно сосредоточено в руках химико-фармацевтических фирм.
Производство
витаминов из дрожжей
В настоящее
время чистые препараты витаминов получают главным образом синтетически, в
некоторых случаях отдельные стадии их образования выполняются методами
микробиологического синтеза. Распространенное ранее производство концентратов
витаминов из продуктов растительного или животного происхождения сейчас почти
полностью потеряло свое значение.
В то же
время, некоторые витамины получают с помощью экстракции и очистки культуральной
жидкости или биомассы микроорганизмов. Наряду с использованием непосредственно
дрожжевой биомассы как источника витаминов в виде дрожжевых гидролизатов и пивных
дрожжей, некоторые дрожжи используются для микробиологического производства
чистых витаминов.
|
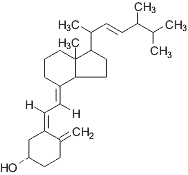
|
| Витамин D2,
кальциферол |
Использование
дрожжей для производства чистых витаминов началось в 1930-х годах с получения
витамина D. С использованием специальных рас Saccharomyces cerevisiae получают эргостерол,
который после облучения ультрафиолетом модифицируется в витамин D2
(кальциферол).
Существуют
штаммы сахаромицетов, обладающие способностью к гиперсинтезу витамина B2 (рибофлавина),
которые могут быть использованы для получения этого витамина.
Из
базидиомицетовых дрожжей, обладающих способностью к интенсивному синтезу каротиноидов,
получают препараты β-каротина, являющегося предшественником витамина A, и астаксантина.
Питьевые
дрожжи
Дрожжевой
осадок, остающийся после сбраживания пивного сусла, издавна используют для
получения различных полезных веществ, в частности дрожжевых гидролизатов и
автолизатов. Гидролизаты дрожжей получают, нагревая дрожжевую биомассу при 100°C в кислой среде. Большая часть белков при этом гидролизуется до аминокислот. Затем препарат
нейтрализуют и концентрируют в виде густой пасты или высушивают. При получении
дрожжевых автолизатов разрушение клеточных компонентов происходит под действием
ферментов самой дрожжевой клетки. Этот процесс протекает в обычных условиях в
или при небольшом нагревании дрожжевого осадка без питательных веществ до 50°C и обычно продолжается в течение 1-2 сут. За это время около половины всех белков в дрожжевых
клетках расщепляется до аминокислот.
Дрожжевые
гидролизаты широко применяются в качестве источника витаминов и аминокислот в
медицине, в микробиологии при составлении питательных сред. Дрожжевые
гидролизаты и автолизаты обладают способностью придавать пищевым продуктам
привкус мяса, или усиливать такой вкус, поэтому они широко используются в
пищевой промышленности для приготовления различных приправ, в качестве вкусовых
добавок в готовые продукты (например, в картофельные чипсы).
Большой
популярностью пользуются пивные (питьевые) дрожжи, приготовляемые на основе
частично гидролизованной дрожжевой биомассы. Они используются в качестве
источника витаминов (в первую очередь В1 и В2, а также РР, В3, В4, В6, Н),
незаменимых аминокислот и жирных кислот и широко применяются в медицине,
ветеринарии, косметологии, диетологии.
Красные
дрожжи
Многие дрожжи
синтезируют большое количество каротиноидов, придающих их колониям красную,
розовую, оранжевую или желтую окраску. Способность к образованию каротиноидов и
формирование окрашенных колоний встречается только среди базидиомицетовых
дрожжей, то есть относится к признакам аффинитета. Наиболее характерно
образование каротиноидов для родов Rhodosporidium, Cystofilobasidium, Sporidiobolus,
и их анаморф Rhodotorula, Cryptococcus, Sporobolomyces. К наиболее распространенным
каротиноидам относится β-каротин.
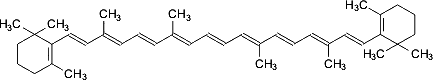
β-Каротин
Это широко
распространенное соединение, встречающиеся также во многих растениях и грибах.
β-Каротин является предшественником витамина A и его промышленное
получение представляет интерес для медицины и некоторых других облестей.
Разработаны и применяются биотехнологические процессы получения β-каротина
с использованием красных дрожжей, например Rhodotorula glutinis.
У
базидиомицетовых дрожжей встречаются и другие виды каротиноидов. Например, красные
дрожжи Phaffia rhodozyma образуют каротиноид астаксантин.
Астаксантин
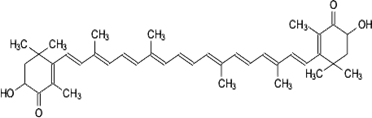
Астаксантин -
широко распространенный в природе каротиноидный пигмент ярко-красной окраски. В
отличие от β-каротина имеет два дополнительных атома кислорода на каждом
из колец. Впервые был выделен из омаров в 1938 году, сейчас обнаружен в тканях
многих растений и животных. Особенно в большом количестве содержится в тканях
креветок, крабов, лососевых рыб, придавая им красный цвет.
Астаксантин
является одним из наиболее активных антиоксидантов и используется в медицине
для лечения ряда заболеваний. Препараты астаксантина широко используются в
качестве кормовой добавки в рыбоводстве, особенно при выращивании лососей, и
аквариумоводстве.
Основным
источником для получения астаксантина служит водоросль Haematococcus
инцистированные клетки которой содержат до 4% каротиноида. Астаксантин был
обнаружен также в дрожжах Phaffia rhodozyma (телеоморфа Xanthophyllomyces
dendrorhous). Генетически модифицированные штаммы Phaffia содержат до 1-2%
астаксантина и могут также использоваться для промышленного получения этого
каротиноида.
Клетки
овальные или круглые, иногда удлиненные. Почкование истинное, многостороннее.
Может формироваться примитивный псевдомицелий, но истинного мицелия не образуют.
Диплоидизация происходит в результате слияния двух гаплоидных клеток (гологамия).
Вегетативно размножаются в основном диплоидные клетки. Аски образуются
преимущественно из вегетативных диплоидных клеток. Аски круглые или овальные,
при созревании спор не вскрываются. Аскоспоры круглые или слабоовальные,
бесцветные, гладкие, 1-4 в аске. Все виды активно сбраживают сахара. Дрожжи
этого рода с давних времен распространены в кустарном виноделии и широко
используются в разных отраслях бродильной промышленности, в связи с чем они
более всех других дрожжей изучены в разных аспектах. Их систематика, однако,
многократно пересматривалась. Центральный вид -
Saccharomyces cerevisiae известен в десятках синонимов, которые в
настоящее время рассматриваются как производственные расы, но не
самостоятельные виды.
Потребность
дрожжей в витаминах
Одна из
характеристик, используемых для таксономического описания дрожжей - потребность
в витаминах. Более 80% всех известных видов дрожжей не способны к росту на
среде, не содержащей витамины (ауксотрофны). Наибольшее число видов (около 65%)
нуждается в биотине и тиамине. Из других витаминов в таксономии дрожжей
используется определение потребности в рибофлавине, пантотеновой кислоте,
пиридоксине, инозите и никотиновой кислоте.
|
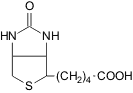
Биотин, витамин H
(B7)
|
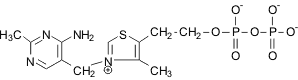
Тиаминпирофосфат,
витамин B1
|
|
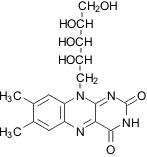
Рибофлавин, витамин B2
|
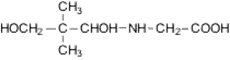
Пантотеновая
кислота, витамин B5
|
|
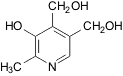 Пиридоксин,
витамин B6 Пиридоксин,
витамин B6
|
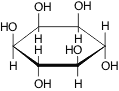
мио-Инозит, витамин B8
|
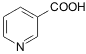
Никотиновая кислота,
Ниацин, витамин PP
|
Для
определения потребности исследуемого штамма в том или ином витамине его
выращивают на стандартной среде, содержащей определенный витамин, и сравнивают
с ростом на этой же среде, не содержащей витаминов. В случае, если добавление
витамина приводит к существенному увеличению роста, делают вывод о
ауксотрофности штамма по этому витамину. Тесты на способность к росту на
безвитаминной среде и определение потребности в конкретных витаминах входят в стандартное
описание вида дрожжей.
Зависимость
скорости роста ауксотрофных штаммов дрожжей от содержания определенных
витаминов была использована для разработки методов определения концентрации
витаминов в различных средах по измерению прироста дрожжевой биомассы.
Стандартные
среды для физиологических тестов
Разделение
дрожжей на виды базируется на многих характеристиках, среди которых важное
место занимают как морфологические, так и физиологические признаки -
способность к росту на различных органических соединениях в качестве
единственного источника углерода и энергии, способность к усвоению различных
источниках азота, потребность в различных витаминах и т.п. Все эти характеристики
сильно зависят от состава среды и условий культивирования, поэтому в
систематике дрожжей разработаны и применяются среды стандартного состава.
Полный набор таких сред выпускается в готовом виде фирмой Difco (Difco
Laboratories, в 1997 г. вошедшая в состав BD Diagnostic Systems). Среди этих
сред наиболее популярны: морфологический агар - для описания макро- и
микроморфологических характеристик дрожжевой культуры, азотная основа - для
определения способностей к росту на различных источниках углерода, углеродная
основа - для определения способности к усвоению различных источников азота,
базвитаминная среда - для определения потребностей в витаминах.
Состав этих
сред приведен в таблице:
| Ингредиенты (на 1 л воды) |
Морфологи-ческий агар |
Азотная основа |
Углеродная основа |
Среда без витаминов |
| Источники углерода и
азота, г |
| Глюкоза |
10 |
— |
10 |
10 |
| (NH4)2SO4 |
3.5 |
5 |
— |
5 |
| Аспарагин |
1.5 |
— |
— |
— |
| Макроэлементы, г |
| КH2РO4 |
0.85 |
0.85 |
0.85 |
0.85 |
| К2НРО4 |
0.15 |
0.15 |
0.15 |
0.15 |
| MgSO4 |
0.5 |
0.5 |
0.5 |
0.5 |
| NaCl |
0.1 |
0.1 |
0.1 |
0.1 |
| СаСl2 |
0.1 |
0.1 |
0.1 |
0.1 |
| Аминокислоты, мг |
| L-Гистидин НСl |
10 |
10 |
1 |
10 |
| DL-Метионин |
20 |
20 |
2 |
20 |
| DL-Триптофан |
30 |
20 |
2 |
20 |
| Витамины. мкг |
| Пантотенат кальция |
2000 |
2000 |
2000 |
— |
| Фолиевая кислота |
2 |
2 |
2 |
— |
| Инозит |
10000 |
10000 |
10000 |
— |
| Никотиновая кислота |
400 |
400 |
400 |
— |
| Парааминобензойная
кислота |
200 |
200 |
200 |
— |
| Пиридоксин НСl |
400 |
400 |
400 |
— |
| Рибофлавин |
200 |
200 |
200 |
— |
| Тиамин НСl |
400 |
400 |
400 |
— |
| Биотин |
20 |
20 |
20 |
— |
| Микроэлементы, мкг |
| Н3РО3 |
500 |
500 |
500 |
500 |
| CuSO4 |
40 |
40 |
40 |
40 |
| KJ |
100 |
100 |
100 |
100 |
| FeCl3 |
200 |
200 |
200 |
200 |
| MnSO4 |
400 |
400 |
400 |
400 |
| Na2MoO4 |
200 |
200 |
200 |
200 |
| ZnSO4 |
400 |
400 |
400 |
400 |
| Промытый агар, г |
18 |
— |
— |
— |
| Количество сухой
готовой среды фирмы «Difco» на 1 л, г |
35 |
6.7 |
11.7 |
16.7 |
ПРОИЗВОДСТВО КРИСТАЛЛИЧЕСКОГО β-КАРОТИНА ИЗ
МОРКОВИ
Исходным сырьем для получения кристаллического
β-каротина является морковь, содержащая среди каротиноидов 85—90%
β-каротина. Наоборот, в тыкве содержание β-каротина составляет лишь
60—70%. Производство кристаллического каротина включает следующие стадии: 1) экстракция
каротина из сухого коагулята белков органическим растворителем; 2) омыление концентрата; 3)
экстракция каротина из омыленной массы и 4) кристаллизация каротина.
Экстракция
каротина. Большинство исследователей сходятся на применении в качестве
органического растворителя для экстракции
р-каротина хлорированных углеводородов (в основном дихлорэтан). Существует
мнение о целесообразности предварительной экстракции белкового коагулята
спиртом для удаления стеринов, фосфатидов, свободных жирных кислот и других
веществ. Однако дополнительная экстракция
спиртом сильно осложнит технологию производства, поэтому необходимость этого процесса нуждается в
технико-экономическом обосновании.
Экстракцию осуществляют дихлорэтаном в экстракторах непрерывного действия (при
крупном производстве) или в аппаратах типа Сокслета при небольших масштабах
производства. Дихлорэтана в реактор
загружают 400% к массе сухого коагулята. Экстракцию ведут в течение
1—1,5 ч. Содержание каротина в шроте не должно превышать 5% к введенному каротину с белковым коагулятом. Затем
в испарителе 2 в присутствии СО2
отгоняют дихлорэтан (температура не должна быть выше 50° С).
Омыление концентрата. Омыление производят 10%-ным
раствором едкого кали, которого добавляют около 10% к массе концентрата. Процесс проводят в реакторе 3 с обратным
холодильником в течение 20 мин при 50° С.
При омылении образуется осадок, содержащий до 80% каротина и жидкое мыло. Осадок отфильтровывают на
нутч-фильтре 4 и промывают спиртом от мыла и красящих веществ.
Б. Савинов и А. Свищук указывают на образование
нерасслаивающихся эмульсий при омылении липоидных экстрактов в хлорированных углеводородах. Это явление ими было
успешно устранено совмещением стадии омыления со стадией экстракции.
Экстракция каротина из омыленной массы. Каротин
экстрагируют дихлорэтаном в количестве, необходимом для растворения
каротина при комнатной
температуре, исходя из того, что в 100 мл дихлорэтана (ДХЭ) растворяется при
температуре 25° С 1,16 г каротина.
Экстракцию
ведут при комнатной температуре в реакционном аппарате 5, снабженном обратным холодильником и мешалкой. Затем массу фильтруют на нутч-фильтре 6, промывают осадок чистым
ДХЭ. Экстракт с промывным ДХЭ
сгущают в вакуум-перегонном аппарате 7 до получения пересыщенного
раствора.
Первая кристаллизация. Пересыщенный раствор спускают в
кристаллизатор 8, где в течение 8 ч идет процесс кристаллизации вначале при
комнатной температуре, а
затем через 4 ч при охлаждении, к концу процесса температуру доводят до 5° С.
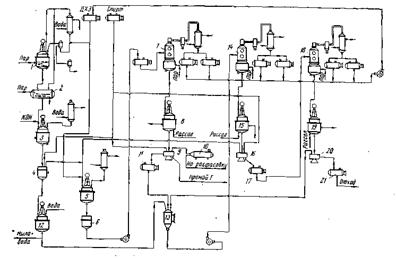
Для
увеличения выхода каротина на первой кристаллизации в пересыщенный раствор вводят этиловый спирт
в отношении 1:2. Затем отфуговывают в
центрифуге 9 выделившиеся кристаллы, промывают их спиртом и высушивают
в вакуум-сушилке 10. Маточный раствор I поступает в сборник 11.
Вторая кристаллизация. Маточный раствор 1
перерабатывают совместно с промывными и мыльной массой. Для этого мыльную массу
экстрагируют два раза ДХЭ в нутч-фильтре 4, а экстракт промывают водой в смесителе 12.
Экстракт
и маточник I направляют в сборник 13, откуда они поступают в вакуум-аппарат 14 для упаривания в
концентрат П. Последний поступает в
кристаллизатор 15, где кристаллизуется 24 ч. Фуговку производят при температуре 5° С в центрифуге 16. Кристаллы
каротина II промывают спиртом и направляют на переработку
совместно с экстрактом омыленной массы (до первой кристаллизации). Маточный раствор II поступает в сборник 17.
Третья кристаллизация. Маточный раствор II совместно с
промывными второй
кристаллизации упаривают в вакуум-аппарате 18, кристаллизуют 72 ч в
кристаллизаторе 19, фугуют в центрифуге 20. Кристаллы промывают спиртом. Получают кристаллы каротина III, направляемые на
переработку в маточный
раствор I и в виде отхода маточный раствор II — в сборник
Нормы качества готовой продукции. Кристаллический
каротин должен быть
однородным, мелкокристаллическим сухим порошком без слежав19, фугуют в
центрифуге 20. Кристаллы промывают спиртом.
Получают кристаллы каротина III, направляемые на переработку в маточный раствор I и в виде отхода маточный раствор II — в сборник
Нормы качества готовой продукции. Кристаллический
каротин должен быть
однородным, мелкокристаллическим сухим порошком без слежав шихся комков
лилово-красноватого цвета с металлическим блеском. Точка плавления каротина должна быть не ниже 160° С. Содержание
β-каротина в кристаллах не менее 90%.
Вопросы усовершенствования технологии производства
каротина из моркови. Интересные исследования в этой области были
проведены Б. Савиновым и его учениками. Исходя из факта локализации каротина
на хромопластах, им было предложено заменить процесс прессования мезги моркови
процессом вымывания пластид из клеток интенсивным перемешиванием мезги
с водой в суспензионном экстракторе. Им же был разработан метод получения
масляных концентратов каротина из влажного белкового коагулята путем применения
центробежного смесителя. Разработан метод получения каротина из моркови и тыквы
методом термической
коагуляции белков в клетке, изучены вопросы экстракции каротина в многочленной
батарее. К сожалению, эти методы не нашли широкого применения в связи с
развитием химического синтеза витаминов.
ХИМИЧЕСКИЙ
СИНТЕЗ β–КАРОТИНА
Метилгептенон (6-метилгептен-5-он-2).
Получают его конденсацией диметилвинилкарбинола и ацетоуксусного
эфира при температуре 160—165° С по следующей химической схеме:
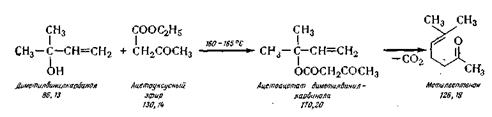
В реактор 29 из нержавеющей стали,
снабженный колонкой с дефлегматором и конденсатором, из мерника загружают
вазелиновое масло (высококипящий разбавитель) и при температуре 210° С (в
масле) загружают диметилвинилкарбинол и ацетоуксусный эфир
так, чтобы температура реакционной массы была не ниже 160—165° С. Затем
нагревание продолжают при температуре 160—180° С 3 ч до прекращения выделения газа (СО2).
В сборник после конденсатора собирают отгон
(спирт с примесью ацетона). Кубовый остаток разгоняют при остаточном давлении
5—6 мм рт. ст. в вакуум-перегонном
аппарате 30. Готовый продукт поступает в приемник. Выход 60%.
Метилгептенон — бесцветная жидкость,
температура кипения 52—53°С при остаточном давлении 5 мм рт. ст. C8H14О,
молекулярная масса 126,19; п2о = 1,4404; d20=0,8616, хорошо перегоняется с водяным паром; Хтах
= 243 нм (в спирте), lgs =2,54.
Дегидролиналоол (3,7-диметилоктаен-6-ин-1-ол-3).
Дегидролиналоол синтезируют по следующей химической реакции:
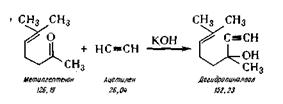
В реактор из эмалированной стали 31, снабженный
мешалкой, барботером для подвода ацетилена загружают толуол из мерника 32 и
порошкообразное едкое кали, нагревают до 80° С и из баллона 33 пропускают ацетилен
при перемешивании в течение 2 ч. После прекращения нагревания уменьшают ток
ацетилена, охлаждают рассолом до —12—10° С и постепенно в течение 3 ч приливают
метилгептенон из мерника 34. Затем добавляют воды и после перемешивания
разделяют слои в делительной воронке 35. Толуольный раствор переводят в реактор
36, в котором нейтрализуют углекислотой. В перегонном
аппарате 37 отгоняют толуол, а затем при остаточном давлении 12—14 мм
рт. ст. собирают фракцию, кипящую при температуре 89—91С. Выход 76—80%.
Дегидроналоол — бесцветная жидкость,
температура кипения 78—80°С при остаточном давлении 8 мм рт. ст.; Cl0H12O, молекулярная масса
152,23; плотность ==1,4632. Хорошо растворим в органических растворителях,
плохо — в воде.
Псевдоионон. Псевдоионон получают
из дегидролиналоола путем аци-лирования его, изомеризации ацетата, омыления его и
конденсации с аце тоном в присутствии едкого натра. Синтез протекает по
следующей схеме
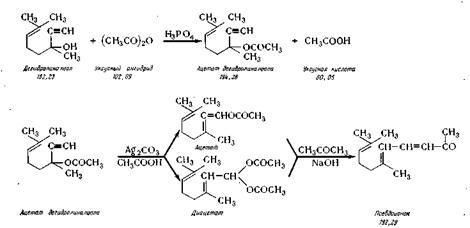
В реактор из нержавеющей стали 38 загружают
из мерника 39 дегидролиналоол, из мерника 40уксусный ангидрид и из
мерника 41 каталитическое количество фосфорной кислоты,
перемешивают (температура не выше 50° С) и выдерживают 14—15 ч при
температуре 18° С. Затем вводят в реактор из баллона 42 азот,
нагревают реакционную массу до 90° С и добавляют каталитическое количество карбоната
серебра, продолжая перемешивание 1,5 ч при температуре 90° С. Далее реакционную
массу охлаждают до 20° С и передают под давлением в реактор 43, в который из
мерника 44 загружают 20%-ный водный раствор хлористого натрия. После перемешивания
разделяют слои в делительной воронке 45. В ней же промывают верхний слой раствором хлористого натрия до нейтральной реакции.
Затем верхний слой переводят в реактор 46 и вводят в него из мерника 47 ацетон и из мерника 48,8%-ный водный
раствор едкого натра, нагревают до
40° С и перемешивают 2,5—3 ч. Реакционную массу при температуре 20° С
нейтрализуют уксусной кислотой из мерника 49. В делительной воронке 50 разделяют
слои: нижний слой поступает в сборник 51, откуда
далее направляют на регенерацию. Верхний слой промывают в колонке 52 раствором хлористого натрия. Промытый
слой (технический псевдоионон)
передают в сборник 53 и далее в вакуум-перегонный аппарат 54, снабженный
колонкой, дефлегматором и конденсатором. Перегонку ведут при остаточном
давлении 6—7 мм рт. ст., отбирают фракцию, кипящую при 131—135°С в сборник 55. Выход
54—55%.
Псевдоионон — желтоватая маслянистая жидкость, хорошо растворима в органических растворителях, плохо — в воде,
температура кипения при остаточном давлении 5 мм рт. ст.— 120° С; С13Н10О, молекулярная масса 192,29; n2D°=l,5300, df = 0,8954; Xmax = 291 нм, Е= 1205;
содержание не ниже 95%.
СИНТЕЗ β-ИОНОНА
β-Ионон получают процессом циклизации
псевдоионона под влиянием смеси концентрированной серной кислоты и ледяной
уксусной кислоты
в среде толуола по химической схеме:
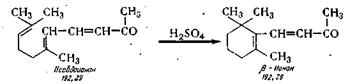
В реактор 1 из сборника 2 загружают
псевдоионон и из сборника 3 толуол и перемешиванием
получают толуольный раствор псевдоионона (плотность 890—900 кг/м3), подаваемый
насосом 4 в мерник 5. В реактор из эмалированной стали 6 сливают
концентрированную серную кислоту из мерника
7, которую в реакторе 6 охлаждают до 0°, а затем медленно загружают из мерника
8 ледяную уксусную так, чтобы температура не поднималась выше 15° С.
Смесь кислот насосом 8 подают в мерник 9. В аппарат для циклизации 10 из нержавеющей стали, снабженный мешалкой и рубашкой, подают из мерника 9 смесь кислот, а из
мерника 5 толуольный раствор псевдоионона. Реакция протекает при
температуре минус 7—10° С в течение 1 ч. Для
нейтрализации реакционной массы применяют 18—20%-ный раствор углекислого
натрия. В реактор // загружают углекислый натрий, из мерника 12 воду и при перемешивании насыщенный раствор насосом 13 подают в мерник 14. Из аппарата циклизации 10 нейтрализованная
реакционная масса поступает в делительную воронку 15, где промывается раствором карбоната натрия и далее поступает в сборник 16
и в перегонный аппарат 17. В нем отгоняют толуол в сборники 18 и 19 при
остаточном давлении 20 мм рт. ст. Остаток перегоняют при остаточном
давлении 1 мм рт. ст. в перегонном аппарате 20 и собирают в приемнике. Выход
75%.
β-Ионон — желтоватая маслянистая жидкость, температура
кипения 118—120°С при остаточном давлении 5 мм рт. ст. и 132° С при остаточном давлении 12 мм рт. ст., С13Н2оО,
молекулярная масса 192,29; по =1,5210; хорошо растворим в органических
растворителях, плохо в воде; Xmах= 296 нм, E=557.
СИНТЕЗ АЛЬДЕГИДА С14 [4(2',6',6'-ТРИМЕТИЛЦИКЛОГЕКСЕН-
Г-ИЛ)-2-МЕТИЛБУТЕН-З-АЛЬ-1]
Синтез альдегида С14 осуществляют
по реакции Дарзана путем конденсации (3-ионона с метиловым
или этиловым эфиром монохлоруксусной кислоты в присутствии метилата
натрия. Реакции протекают по следующей схеме:
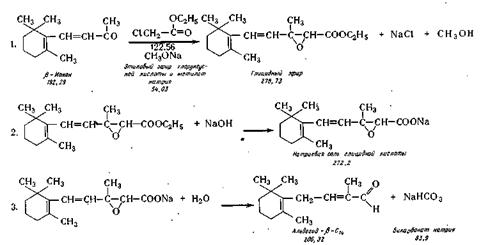
Реакция конденсации. В реактор
21, снабженный охлаждающей рубашкой и мешалкой, загружают (3-ионон из сборника
22 и в течение 2—3 ч при ливают из мерника 23 этиловый эфир
хлоруксусной кислоты, а из сборника 24 сухой метилат натрия. Температуру при этом
поддерживают минус 5—7° С. В результате
реакции конденсации получается глицидный эфир, который из раствора не
выделяют.
Омыление. Глицидный эфир
омыляют раствором едкого натра в водном метаноле, который добавляют из смесителя 25 в тот
же реактор в течение 1,5—2 ч при
температуре 18—20°С. В результате омыления получают натриевую соль глицидного
эфира.
Декарбоксилирование. В
реактор 21 добавляют воду и дихлорэтан, перемешивают, а затем направляют реакционную
массу в делительную воронку 26. Нижний
дихлорэтановый слой отделяют в воронке и в смесителе 27 промывают водным раствором поваренной соли,
приготовленном в смесителе 28. Нижний
слой спускают в смеситель 29, затем добавляют в этот смеситель сульфат натрия и перемешивают. Сухой
экстракт переводят в вакуум-перегонный аппарат 30, отгоняют дихлорэтан,
а затем под глубоким вакуумом (0,1 мм рт. ст. при температуре около 100° С) отгоняют альдегид
С14. При необходимости альдегид подвергают ректификации при остаточном
давлении 0,3—0,5 мм рт. ст.
Альдегид С14 — светло-желтая маслянистая жидкость с
температурой кипения 103—106° С при остаточном давлении 0,2 мм рт. ст., хорошо растворим
в органических растворителях, плохо—в воде. При хранении неустойчив. Формула С14Н220,
молекулярная масса 206,14.
ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПРОИЗВОДСТВА
СИНТЕТИЧЕСКОГО
р-КАРОТИНА
Технология производства базируется на
однокомпонентном методе синтеза, разработанном Ингоффеном и усовершенствованном Излером с их соавторами. Этот метод нашел свое
дальнейшее развитие в исследованиях Н. Преображенского, Г. Самохвалова и
Л. Вакуловой. Метод заключается в
конденсации двух молекул альдегида С19 с молекулой ацетилена по
реакции Гриньяра. Технология включает следующие стадии синтеза: синтез (3-С16-альдегида из β-С14-альдегида;
синтез β-С)9-альдегида из (3-С16-альдегида; синтез
15,15-дегидро-(3-каротина изС19-альдегида и ацетилена; синтез транс-β-каротипа из
15,15-дегидро-β-каротина.
СИНТЕЗ β-С14-АЛЬДЕГИДА-[9-МЕТИЛ-6-(1,1,5-
ТРИМЕТИЛЦИКЛОГЕКСЕН-5 ИЛ)-ГЕКСАДИЕН-8, 10-АЛЬ-12]
Химические реакции получения альдегида С16 заключаются
в ацеталировании альдегида-С14, конденсации полученного ацеталя с
виниловым эфиром в присутствии хлористого цинка и омыления
алкоксиацеталя альдегида С16. Химизм реакций
синтеза альдегида С16 основан на склонности виниловых
эфиров присоединяться к ацеталям а, (3-непредельных карбонильных
соединений, причем одна алкоксигруппа [OR]
перемещается от ацеталя к двойной связи винилового эфира.
Остаток ацеталя присоединяется к β-углеродному атому винилового эфира.
Конденсация и перегруппировка протекает по схеме:
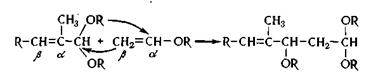
По этой схеме протекает следующий синтез.
Схема реакций синтеза С16-альдегида.
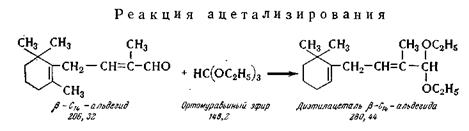
Для успешного протекания реакций
ацетализирования и конденсации важно, чтобы влажность реагентов была
минимальной (в %): абсолютного спирта — 0,15; этилвинилового эфира — 0,2; ортомуравьиного
эфира — 0,09; альдегида-С14 —
0,04. Хлористый цинк предварительно должен быть сплавлен и высушен в вакуум-эксикаторе над концентрированной серной кислотой.
Ацетализирование. В реактор 1 из нержавеющей
стали, снабженный мешалкой, обратным холодильником и
барботером для азота, загружают через мерник 2 альдегид-С14,
из мерника 3 ортомуравьиный эфир (температура кипения 144—145° С,
плотность 897 кг/м3), из мерника 4 — раствор
паратолуолсульфокислоты в абсолютном этаноле. Реакцию
ведут в присутствии азота, вводимого в реактор из баллона 5. Перемешивают
в течение 20—24 ч при комнатной температуре. Затем в реакционную массу
вводят из мерника 6 лигроин и нейтрализуют 2,5%-ным раствором бикарбоната
натрия, загружаемым из мерника 7. После этого отделяют органический
слой в делительной воронке 8 и после просушки поташом направляют
в сборник 9, а из него в перегонный аппарат 10, где при температуре
около 50°С и остаточном давлении 3—5 мм рт. ст. отгоняют растворитель. Технический продукт
содержит около 95% ацеталя. Выход ацеталя из
(3-С14-альдегида составляет около 75 %. На выход ацеталя из
альдегида-С 16 значительно
влияет чистота альдегида-С14. Диэтилацеталь
β-С14-альдегида С18Н3202 представляет
собой маслянистую жидкость желтого цвета с температурой кипения 87—96°С при
остаточном давлении 0,2 мм рт. ст.; df =0,9279; n™ =1,4773.
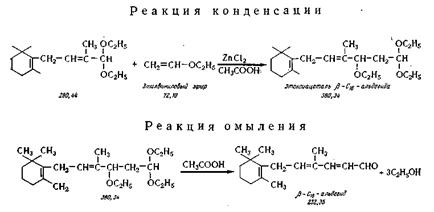
Конденсация с этилвиниловым эфиром. В реактор 11, снабженный холодильником, загружают из
мерника 12 диэтилацеталь-β-С14-альдегида, затем из мерника 13 медленно добавляют при температуре 35 —40°С этилвиниловый
эфир (температура кипения 35°С, остаточная влажность не выше 0,2%), а из мерника 14 — 10%-ный раствор сплавленного хлористого
цинка в ледяной уксусной кислоте. Реакцию проводят в присутствии азота,
вводимого из баллона 15, при температуре 35—40°С в течение 1 ч. В результате реакции образуется этоксиацеталь
β-С 16-альдегида (см. химическую схему), представляющий
собой (перегонка при остаточном давлении 0,02 мм рт. ст.) вязкое светло-желтое масло, d0 = 0,9315. Выход 66—70%.
Омыление этоксиацеталя. В
процессе омыления ацетальной группы происходит также отщепление
молекулы спирта. В реактор 11 из мерника 16 добавляют
смесь ледяной уксусной кислоты, ацетата натрия, воды и гидрохинона (небольшое
количество). Реакционную массу медленно нагревают до 90—95° С и
перемешивают 3 ч. Затем раствор (темно-вишневого цвета) переводят в
реактор-охладитель 17. Охлаждают до 0°, выкристаллизовывают
технический β-С 1б-альдегид и отфуговывают его в центрифуге 18.
Перекристаллизация технического альдегида С1б.
Процессы ведут в этаноле в реакторе 19 по двухступенчатой
схеме. После обработки активированным углем раствор фильтруют через
нутч-фильтр 20. Кристаллизуют в кристаллизаторе 21, отфуговывают кристаллы в
центрифуге 22. Маточный раствор I
поступает в сборник 23. Сгущение его производят в вакуум-аппарате
24 и далее кристаллизуют в кристаллизаторе 25. Кристаллы второй
кристаллизации отфуговывают в центрифуге 26, а маточный раствор II направляют в сборник 27. Он
является отходом производства. Кристаллы второй кристаллизации поступают на
перекристаллизацию в реактор 19 совместно с техническим продуктом.
Альдегид-β-С16 (С1бН240)
представляет собой светло-желтые кристаллы с температурой плавления
77—78° С, хорошо растворим в органических растворителях, плохо в
воде; Хгаах—276—280 нм (в спирте).
СИНТЕЗ β-С19-АЛЬДЕГИДА [9,13-ДИМЕТИЛ-7-(1,1,5-
ТРИМЕТИЛЦИКЛОГЕК-СЕН-5-ИЛ)-ОКТАТРИЕН-8,10,12- АЛЬ-14]
Химические реакции получения альдегида-С19 заключаются
в ацетали-зировании альдегида С16, конденсации полученного ацеталя
с виниловым эфиром в присутствии хлористого цинка и омыления
алкоксиацеталя альдегида С19 по следующей химической схеме.
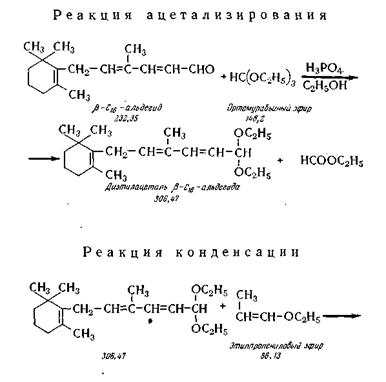
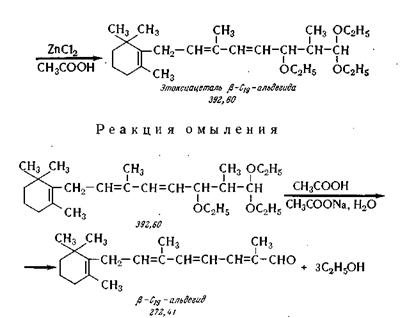
Для успешного протекания указанных реакций
необходимы те же условия обезвоживания химических реагентов, как
и в синтезе β-С16-альдегида.
Ацетализирование. Процессы
проводят так же, как и для синтеза β -С16-альдегида
и в аналогичной аппаратуре. К ней относятся реактор 28 и сборники: для альдегида-С16
29, ортомуравьиного эфира 3, катализатора 4, лигроина 6, нейтрализующего раствора бикарбоната натрия 7. Азот в реактор подается из баллона 30. Разделение слоев
осуществляют в делительной воронке 31 и после просушки органического
слоя поташом направляют его в сборник 32 и
далее в перегонный аппарат 33, где отгоняют растворитель и не вошедший
в реактор ортомуравьиный эфир (при температуре 50—55° С и остаточном давлении 2—3 мм рт. ст.). Получают технический диэтилацеталь (3-С,6-альдегида с
содержанием основного вещества 95—97%, n° = 1,5026—1,5070;
маслянистая жидкость, температура кипения около 145° С при остаточном давлении 0,05 мм рт. ст. Выход 75—80% (в пересчете на альдегид – С16).
Конденсация с этилпропениловым эфиром. Процесс
осуществляют в реакторе 34, в который загружают диэтилацеталь альдегида-С16
из мерника 35, а из мерника 14 раствор (10%) сплавленного
хлористого цинка в ледяной уксусной
кислоте. Масса принимает темно-вишневый цвет. Затем при температуре 25—30°С из мерника 36 медленно
добавляют этилпропени-ловый эфир
(температура кипения 69—71° С, остаточная влага не выше 0,15%). Масса постепенно окрашивается в желтый цвет.
Реакция протекает в' присутствии азота, вводимого из баллона 37, при
перемешивании.
Омыление этоксиацеталя. В
реактор 34 из мерника 16 добавляют смесь ледяной уксусной кислоты,
ацетата натрия, воды и гидрохинона. Реакционную массу медленно
нагревают до 90—95°С и перемешивают 3 ч. Затем раствор
темно-вишневого цвета направляют в реактор-охладитель 38, охлаждают
до минус 5—7° С и кристаллизуют. Кристаллы технического продукта
отфуговывают в центрифуге 39. Получают желтые кристаллы с содержанием
основного вещества около 95%. Маточный раствор направляют в сборник 40; он является
отходом.
Перекристаллизация технического альдегида С19.
Процессы ведут в этаноле по схеме перекристаллизации альдегида
С16 в следующей аппаратуре:
для первого продукта — реактор-растворитель 41,
нутч-фильтр 42, кристаллизатор 43, центрифуга 44. для маточного раствора I — сборник 45;
для второго продукта — вакуум-аппарат 46, кристаллизатор
47, центрифуга
48, сборник маточного раствора II-—отхода производства — 49.
Выход альдегида на диэтилацеталь составляет
55—57% (от теоретического). Альдегид β-С19
представляет собой ярко-желтые ромбические кристаллы с температурой
плавления 63—65°С; хорошо растворим в органических растворителях,
плохо — в воде; Хтах=325 нм (в спирте).
СИНТЕЗ 15, 15'-ДЕГИДРО-β-КАРОТИНА
Вещество получают конденсацией альдегида С19
с ацетиленовым комплексом Иоцича с последующей дегидратацией образующегося
диола С40. Реакцию конденсации начинают с приготовления реактива Гриньяра, который с ацетиленом в среде сухого эфира дает
комплекс Иоцича по схеме:
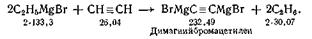
Ацетилен пропускают при температуре 18—20° С
до полного исчезновения магний бромэтила, что контролируется
реакцией с кетоном Михлера (наличие вызывает изумрудно-зеленое окрашивание).
Дегидратацию диола С4о осуществляют в среде сухого
серного эфира спиртовым раствором хлористого водорода в
присутствии азота. Реакции протекают по следующей схема:
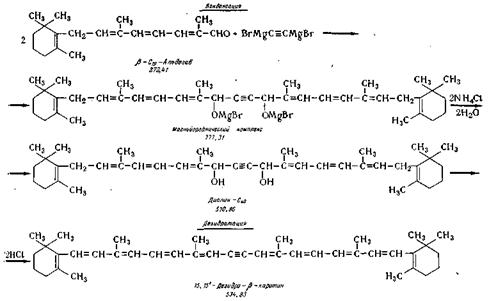
Конденсация. В стальной эмалированный
реактор 50, снабженный мешалкой и обратным холодильником,
предварительно тщательно высушенный, загружают через люк
магниевую стружку из сборника 51, сухой серный эфир (влажность не выше
0,1 %) из мерника 52 и медленно из мерника 53 приливают
в течение 1 ч раствор сухого бромистого этила в сухом эфире. Затем в течение 1 ч
нагревают реакционную массу до кипения и перемешивают до полного растворения
магния. Затем охлаждают массу до 15—18° С и
в течение 5—6 ч пропускают из баллона 54 предварительно осушенный через вымораживатель 55 ацетилен до получения
отрицательной пробы с жетоном Михлера. Затем реакционную массу
охлаждают до 10—12и С и из мерника 56 медленно добавляют раствор
альдегида-С19 в сухом эфире так,
чтобы температура не превышала 12—13° С. Раствор окрашивается в ярко-оранжевый цвет. Реакция при перемешивании
протекает в присутствии азота в течение 1,5—2 ч с повышением в конце процесса
температуры до 20—25° С. Полноту
реакции конденсации определяют по исчезновению альдегида-С19
(реактив Легаля). После этого реакционную массу сливают в реактор-охладитель 57 с ледяной водой, куда из мерника 58 залит
хлористый аммоний. Массу сливают в делительную воронку 59. Органический
слой промывают водой, просушивают сульфатом натрия из сборника 60 и направляют
через сборник 61 в вакуум-аппарат 62. Растворитель удаляют в вакууме в токе азота при температуре не выше
30° С и получают β-С4о-диолин в виде твердого желтого
осадка.
Дегидратация. Процесс осуществляют при
помощи хлористого водорода. Для этого из мерника 63 сливают в
вакуум-аппарат 62 хлористый метилен, растворяют диолин-С4о
и переводят раствор в реактор 64, снабженный мешалкой и рассольным
охлаждением. Массу охлаждают до минус 15—18°С, а затем из мерника 65 постепенно добавляют
8%-ный раствор сухого НС1 в абсолютном
спирте с таким расчетом, чтобы температура реакционной массы не
превышала к концу процесса +3, +5° С. Затем в делительной воронке 66 отделяют органический слой, промывают
его насыщенным раствором бикарбоната
из мерника 67 и направляют в сборник 68 и далее в вакуум-аппарат 69, где под вакуумом в токе азота при
температуре 30—35°С отгоняют
хлористый метилен. Кристаллизующуюся массу направляют в кристаллизатор 70, где при температуре - 2, - 3°С в
течение 8—10 ч в присутствии азота
выпадают кристаллы 15,15'-дегидро-β-каротина. Последние отфуговывают в центрифуге 71, промывают этиловым
спиртом. Выход около 50%. Маточный
раствор поступает в сборник 72 и является отходом производства. Вопрос о выделении вещества из маточного
раствора еще недостаточно изучен. 15,15'-дегидро-β-каротин представляет
собой кристаллы красного цвета с
металлическим блеском; температура плавления 153—154°С; хорошо растворим
в органических неполярных растворителях, плохо — в воде; Хтах = 454
и 430 нм; Е =1568 и 1873. Выход 48—50%.
СИНТЕЗ ТРАНС-β-КАРОТИНА
Синтез осуществляют путем гидрогенизации
15,15'-дегидро-β-каротина в растворе толуола на частично отравленном палладиевом
катализаторе с целью превращения
ацетиленовой связи до этиленовой и получения 15,15'-цис-β-каротина. Изомеризация в среде петролейного эфира
превращает последний в транс-β-каротин.
Для успешного проведения реакции гидрирования необходимо применять тщательно
очищенный толуол с применением палладиевого катализатора на меле.
Реакции протекают по следующей схеме:
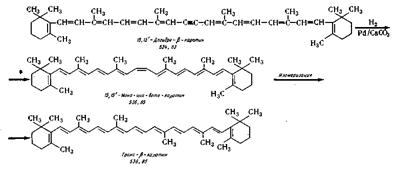
15,15'-моно-цис-β-каротин. В реактор 73 из
эмалированной стали загружают через люк 15,15'-дегидро-β-каротин, а из
мерника 74 толуол и при нагревании до
35—40°С и перемешивании растворяют кристаллы. Затем добавляют палладиевый
катализатор, нанесенный на мел. Аппарат дважды продувают азотом из баллона 75, а затем водородом из баллона 76, после
чего при температуре 20°С и избыточном давлении до 0,5 кгс/смг при перемешивании осуществляют процесс
гидрогенизации. Реакцию контролируют
по количеству поглощенного водорода. Далее реакционную массу фильтруют через нутч-фильтр 77 и сборник 78, откуда
фильтрат направляют в перегонный
аппарат 79 для отгонки толуола при вакууме (остаточное давление 8—10 мм рт. ст.) в токе азота.
Кубовый остаток сливают в кристаллизатор 80, где при минус 5—8° С
выкристаллизовывают 15,15'-моно-цис-β-каротин. Кристаллы выделяют при
помощи центрифуги 81; маточный
раствор поступает в сборник 82 и является отходом производства. Катализатор с нутч-фильтра 77 направляют на
регенерацию. Выход цис-Р-каротина
составляет 90—95% [70], темно-вишневые кристаллы; температура плавления 148—150°С; Хмах=338 (цис-пяк), 450,
480 нм (в гексане).
Транс-β-Каротин. В эмалированный реактор 83, снабженный мешалкой и обратным холодильником, загружают
цис-β-каротин, из мерника 84 петролейный
эфир (80—90° С), нагревают массу до кипения и продолжают перемешивать в течение 10—12 ч (изомеризация). Затем
сливают в кристаллизатор 85, охлаждают до 0 — минус 2°С и кристаллизуют
в течение 6 ч. Кристаллы выделяют в
центрифуге 86, а маточный раствор I
направляют в сборник 87 и после сгущения в вакуум-аппарате 88,
кристаллизации в кристаллизаторе 89, выделения кристаллов в центрифуге 90 получают
дополнительное количество кристаллов транс-β-каротина II, которые поступают для перекристаллизации
в кристаллизатор 85. Маточный раствор II
является отходом
производства.
Перекристаллизация технического транс-β-каротина. Перекристаллизацию
ведут из петролейного эфира по двухступенчатой схеме: для первой ступени
— реактор-растворитель 91, нутч-фильтр 92, кристаллизатор 93, центрифуга
94, сборник маточного раствора I 95; для
второй ступени — вакуум-аппарат 96, кристаллизатор 97, центрифуга 98,
сборник маточного раствора II 99. .Кристаллы β-каротина II поступают на
перекристаллизацию совместно с техническим
β-каротином в реактор-растворитель 91.
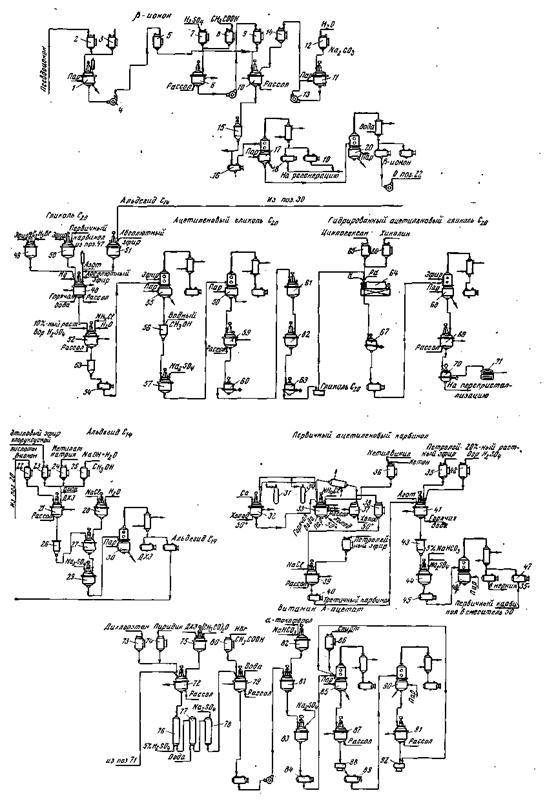
Схема синтеза
–каротина (объяснения в тексте).
Лекарственные
формы витаминов.
Индивидуальные
потребности в витаминах отличаются и по этой причине производители выпускают
витамины в разной форме. Таблетки - общепринятая, привычная и удобная для
применения форда выпуска. Таблетки можно дольше хранить, чем порошки или
жидкости.
Капсулы также удобны для хранения и являются общепринятыми формами выпуска
жирорастворимых витаминов A, D и Е.
Порошки -
поскольку в них отсутствуют наполнители, связующие и другие не имеющие
отношение к витаминам вещества, могут быть предпочтительной формой применения
при наличии у кого-то аллергических реакций. И кроме того, порошки могут
"вмещать" большие дозировки витаминов. Одна чайная ложка порошка
витамина С может содержать до 4.000 мг витамина.
Жидкости -
хороши тем, что легко смешиваются с напитками и удобны для тех, кто не может
глотать капсулы и таблетки.
Вдыхание
витаминов через нос - обеспечивает весьма быстрое усвоение витаминов С и группы
В. Пластыри и имплантанты, содержащие витамины, удобны тем, что могут
обеспечить продолжительное и дозированное применение, и в скором времени,
возможно, будут более широко применяться.
Сухая или
водорастворимая форма?
Жирорастворимые
витамины A, D, Е и К могут быть произведены в «сухом», то есть в
водорастворимом виде. Такие формы выпуска этих витаминов рекомендуются тем, кто
страдает расстройством желудка после приема масел или имеет некоторые кожные
расстройства, проявляющиеся, например, в виде сьшей или прыщей. Указанные формы
выпуска показаны и тем, кто соблюдает диету с исключением из рациона
большинства жиров. Поскольку для нормальной ассимиляции, то есть усвоения,
жирорастворимым витаминам нужен жир, я советую вам использовать
"сухую" форму витаминов A, D, Е, К обязательно в том случае, если вы
находитесь на диете с низким содержанием жира. Синтетическое или натуральное,
неорганическое или органическое?
Приобретение
и прием синтетических витаминов не сказывается на вашем бюджете, но может неблагоприятно
отозваться на вашем желудке, в то время как натуральные витамины, принимаемые
даже в больших дозировках, ничего подобного не вызывают. Химическая структура
витаминов в том и другом случае может выглядеть одинаково, но не одним лишь
этим обусловлена эффективность натуральных витаминов, но и тем, что связано с
этими веществами в природе. Синтетический витамин С - это лишь аскорбиновая
кислота и ничего больше. Натуральный же витамин С, получаемый из плодов
шиповника, содержит еще и биофлавоноиды, то есть целый комплекс витамина С, что
делает его намного более эффективным.
Натуральный
витамин Е, который может включать в себя не только альфа-токоферол, но и другие
токоферолы, оказывается более эффективным, чем его синтетический аналог. Вот
что говорит по этому поводу известный аллерголог доктор Герон П. Рандольф:
«Синтетически полученное вещество может вызвать реакцию у людей, чувствительных
к химическим соединениям, в то время как то же вещество натурального
происхождения переносится хорошо, хотя химическая структура этих двух веществ
идентична». Тот, кто принимал и те, и другие витамины, мог на собственном
примере убедиться в том, что после приема натуральных веществ наблюдалось
меньше желудочно-кишечных расстройств. Что особенно важно: в отличие от синтетических
препаратов натуральные витамины не вызывают токсических реакций, даже когда они
принимаются в дозах, превышающих рекомендуемые.
Разница между
неорганическим и органическим - это не то же самое, что разница между
синтетическим и натуральным, хотя нередко кое-кто так и думает. Все витамины
являются органическими веществами и, как полагается таковым, содержат углерод. Минеральные
же вещества являются неорганическими. Они не содержат углерод, но существуют
органические соединения железа-глюконат, пептонат и цитрат железа. А вот
сульфат железа, например, является его неорганическим соединением.
Что такое
хелатирование?
Хелатирование
- это процесс, при помощи которого минеральные вещества превращаются в хорошо
усвояемую форму. Такие минеральные добавки, как костная мука и доломит, прежде
чем могут быть усвоены организмом, должны подвергнуться процессу хелатирования
в желудочно-кишечном тракте. Нередко бывает так, что естественный процесс
хелатирования в организме нарушается и поэтому большая часть принятых внутрь
минеральных веществ не усваивается. Если помнить еще и о том, что организм не
полностью использует все поступающие питательные вещества, тогда важность
приема хелатированных минералов станет очевидной. Как правило, организмом
усваивается только от 2 до 10 процентов поступающего с пищей неорганического
железа и к тому же половина оставшегося позже также выводится. Усвояемость
хелатированных минеральных веществ в три-десять раз больше, чем
нехелатированных, поэтому это оправдывает некоторое увеличение их цены.
Пролонгированные
формы.
Шагом вперед
в производстве витаминов была разработка добавок в пролонгированной (time
release) форме. Пролонгирование - это процесс, при помощи которого витамины
заключаются в микрокапсулы, затем связываются в специальной основе, что
обеспечивает их постепенное непрерывное выделение, всасывание и усвоение в
течение 8-12 часов. Большинство витаминов - водорастворимые - и поэтому не
могут накапливаться в организме. Если они используются не в пролонгированной
форме, то быстро всасываются, попадают в кровоток и независимо от дозы в течение
2-3 часов выделяются с мочой. Добавки в пролонгированной форме могут обеспечить
оптимальную эффективность витаминов, уменьшить их потерю с мочой и поддерживать
стабильные уровни витаминов в крови круглосуточно.
|