Реферат: Производство азотных удобрений
Реферат: Производство азотных удобрений
ПРОИЗВОДСТВО
АЗОТНЫХ УДОБРЕНИЙ
1 Общая
характеристика
Азотные удобрения могут
содержать азот в форме свободного аммиака и аминов (аммиакаты), ионов NH4+
и NO3-, аминогруппы NH2, а также в их
сочетании. В соответствии с этим различают следующие виды азотных удобрений:
аммиачные, аммонийные, нитратные, амидные и аммонийно-нитратные.
Все азотные удобрения
водорастворимы, азот из них хорошо усваивается растенимями, особенно из аниона
NO3-, который отличается высокой подвижностью в почве. По
агрегатному состоянию азотные удобрения делятся на твердые (соли и карбамид) и
жидкие (аммиак, аммиачная вода и аммиакаты, представляющие собой растворы
твердых удобрений). В табл. 1.1 приведены характеристики важнейших азотных
удобрений и удельный вес их в общем балансе производства.
Таблица 1.1 - Ассортимент
и характеристика азотных удобрений
| Удобрение |
Формула действующего вещества |
Содержание азота, % |
Удельный вес, %, по годам |
| 1960 |
1980 |
|
Аммиачные
Аммиак жидкий Аммиачная вода
|
NH3
NH3
|
82
16,1 – 20,1
|
2,8 |
7,1 |
|
Аммонийные
Сульфат аммония
|
(NH4)2SO4
|
19,9 – 21,0 |
17,9 |
1,1 |
|
Нитратные
Нитрат натрия
Нитрат кальция
|
NaNO3
Ca(NO3)2
|
11,0 – 16,0
18,0 – 11,0
|
-
-
|
-
-
|
|
Амидные
Карбамид
|
CO(NH2)2
|
46,0 – 46,1 |
2,1 |
27,1 |
| Аммонийно-нитратные |
NH4NO3
|
32,1 – 31,0 |
73,3 |
40,1 |
|
Карбамидоформ-альдегидные
Карбаминоформ
|
NH2CONHCH2
|
33,0 – 42,0 |
- |
- |
|
Аммиакаты
Азотная часть комплексных минеральных удобрений
|
-
-
|
20,0 – 30,0
-
|
-
-
|
-
19,3
|
В приведенных данных
прослеживается тенденция снижения производства сульфата и нитрата аммония и
увеличения производства карбамида, жидких азотных удобрений и минеральных
удобрений, содержащих, наряду с другими элементами, азот (комплексных
минеральных удобрений).
Ниже рассматривается
технология производства наиболее распространенных азотных удобрений – нитрата
аммония и карбамида, на долю которых приходится свыше 60% общего выпуска
азотных удобрений.
1.2 Производство
нитрата аммония
1.2.1
Свойства нитрата аммония
Нитрат аммония
(аммонийная селитра) NH4NO3 – кристаллическое вещество с
температурой плавления 169,6ºС, хорошо растворимое в воде. Растворимость
при 20ºС равна 0,621 мас. долей, при 160ºС – 0,992 мас. долей. Нитрат
аммония сильно гигроскопичен и легко поглощает влагу из атмосферы, в
зависимости от температуры может существовать в пяти кристаллических
модификациях, различающихся плотностью и структурой кристаллов. Вследствие
высокой растворимости в воде, гигроскопичности и полиморфных превращений,
сопровождающихся выделением тепла, нитрат аммония легко слеживается. Для
уменьшения слеживаемости, которая затрудняет использование продукта, в
промышленности используют следующие меры:
-
перед
складированием полученный продукт охлаждают до температуры ниже 32ºС, так
как именно в интервале от 32,3ºС до -17ºС нитрат аммония находится в
стабильной ромбической модификации;
-
выпускают
товарный продукт в гранулированном виде, обрабатывая поверхность гранул
ПАВ, образующими на них гидрофобную пленку;
-
вводят в состав
продукта кондиционирующие добавки в виде нитрата магния и других солей,
которые связывают свободную воду и препятствуют переходу одной модификации в
другую.
Нитрат аммония в твердом
состоянии или в виде высококонцентрированного раствора (плава) при нагревании
выше 180 - 200 ºС разлагается:
NH4NO3
= N2O + 2H2O – DH, где DH = 36,8 кДж.
При быстром нагревании в
замкнутом пространстве до 400 - 100ºС или инициировании нитрат аммония
разлагается со взрывом по уравнению
NH4NO3
= N2 + 2H2O + 0,1O2 – 118 кДж.
Разложение ускоряется в
присутствии минеральных кислот и органических веществ. На этом основано
использование нитрата аммония в качестве компонента аммонийно-селитровых
взрывчатых веществ – аммонитов (смеси с органическими веществами), аммотолов
(смеси со взрывчатыми веществами) и аммоналов (смеси, содержащие аллюминий).
Нитрат аммония является
безбалластным азотным удобрением и содержит 34,8% азота, из них 17,4% - в
аммиачной (NH4+) и 17,4% - в нитратной (NO3-)
форме. Поэтому стоимость транспортировки содержащегося в нем азота значительно
ниже, чем при перевозке других балластных удобрений (например, сульфата
аммония).
1.2.2
Физико-химические основы процесса синтеза
Производство нитрата
аммония основано на реакции нейтрализации азотной кислоты газообразным аммиаком
с последующим упариванием полученного раствора нитрата аммония.
Нейтрализация. Нейтрализация азотной кислоты
аммиаком – это необратимый гетерогенный процесс хемосорбции, протекающий с
выделением тепла по уравнению
HNO3 + NH3
= NH4NO3 – DH.
Реакция идет в
диффузионной области, и ее скорость лимитируется диффузией аммиака из газа к
поверхности жидкости. Количество тепла, выделяющегося при нейтрализации,
складывается из теплового эффекта реакции и теплоты растворения образовавшегося
нитрата аммония в воде:
Qå = Q1 – (Q2 + Q3),
| где |
Q1
|
– |
тепловой эффект реакции нейтрализации 100% азотной кислоты
с образованием твердого нитрата аммония; |
|
|
Q2
|
– |
теплота разбавления азотной кислоты; |
|
|
Q3
|
– |
теплота растворения нитрата аммония. |
Таким образом, тепловой
эффект процесса зависит от концентрации азотной кислоты, взятой для нейтрализации.
Подогрев компонентов
(азотной кислоты и газообразного аммиака) улучшает перемешивание системы,
ускоряет процесс нейтрализации и повышает концентрацию раствора нитрата
аммония.
Упаривание раствора
нитрата аммония. В
результате нейтрализации образуется водный раствор нитрата аммония. При этом за
счет теплового эффекта реакции нейтрализации часть воды испаряется в виде
сокового пара. Интенсивность испарения зависит от величины теплового эффекта и
температуры процесса. Поэтому концентрация образующегося раствора определяется
как концентрацией азотной кислоты, так и температурой.
С ростом концентрации
азотной кислоты возрастает концентрация образующегося раствора нитрата аммония
и увеличивается масса выделяющегося сокового пара.
Для испарения воды и
концентрирования раствора нитрата аммония можно использовать как внешнее тепло,
подводимое к системе, так и теплоту нейтрализации, выделяющуюся в самом
процессе (рис. 1.1.).
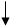 Qподв Qподв

  H2O(пар) NH4NO3
+ H2O NH4NO3 H2O(пар) NH4NO3
+ H2O NH4NO3
 DH реакц DH реакц
Рисунок 1.1 -
Использование тепла при упаривании раствора
Использование теплоты
нейтрализации для упаривания раствора позволяет:
-
снизить затрату
внешнего тепла;
-
обеспечить за
счет отвода тепла из системы оптимальный температурный режим процесса
нейтрализации и избежать опасных перегревов;
-
исключить
применение сложных охладительных устройств.
При использовании азотной
кислоты концентрацией 60 – 61 % и температуре процесса около 70ºС
оказывается возможным за счет использования теплоты нейтрализации выпарить
основную массу воды, вводимой с азотной кислотой, и получить
высококонцентрированный раствор и даже плав нитрата аммония.
В соответствии с
принципом использования тепла все существующие варианты технологического
процесса производства нитрата аммония делятся на две группы:
1 Без упаривания
раствора.
Концентрирование раствора осуществляется исключительно за счет теплоты
нейтрализации азотной кислоты концентрацией 61%. При этом образуется 96% плав
нитрата аммония:
Q = DH; Qподв
= 0.
2 С упариванием
раствора.
Концентрирование раствора осуществляется как за счет частичного использования
теплоты нейтрализации, так и за счет подводимого извне тепла:
Q = DH + Qподв.
При этом в зависимости от
концентрации азотной кислоты последующее упаривание раствора нитрата аммония
может производиться:
- при 18% кислоте в 1-й
ступени;
- при 10% кислоте в 2-й
ступени.
1.2.3
Технологические системы производства
Технологический процесс
производства нитрата аммония состоит из следующих основных стадий:
нейтрализации азотной кислоты газообразным аммиаком, выпаривание нитрата
аммония, кристаллизации и гранулирования плава, охлаждения, классификации и
опудривания готового продукта (рис.1.2.).
В настоящее время в связи
с освоением производства 18 – 60% азотной кислоты основная масса нитрата
аммония производится на установках АС-67, АС-72, АС-72М, мощностью 1360 и 1171
т/сутки с упариванием в одну ступень, а также на установках безупарочного типа
(рис.1.3. и 1.4.)
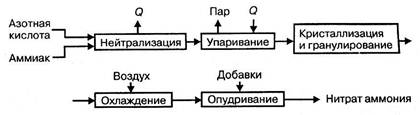
Рисунок 1.2 -
Принципиальная схема производства нитрата аммония
Газообразный аммиак из
подогревателя 1, обогреваемого конденсатом сокового пара, нагретый до 120 - 160ºС,
и азотная кислота из подогревателя 2, обогреваемого соковым паром, при
температуре 80 - 90ºС поступают в аппарат ИТН (с использованием теплоты
нейтрализации) 3. Для уменьшения потерь аммиака вместе с паром реакцию ведут в
избытке кислоты. Раствор нитрата аммония из аппарата ИТН нейтрализуют в
донейтрализаторе 4 аммиаком, куда одновременно добавляется кондиционирующая
добавка нитрата магния и поступает на упаривание в выпарной аппарат 1. Из него
образовавшийся плав нитрата аммония через гидрозатвор-донейтрализатор 6 и
сборник плава 7 направляется в напорный бак 8 и из него с помощью
виброакустических грануляторов 9 поступает в грануляционную башню 10. В нижнюю
часть башни засасывается атмосферный воздух, и подается воздух из аппарата для
охлаждения гранул «КС» 12. Образовавшиеся гранулы нитрата аммония из нижней
части башни поступают на транспортер 11 и в аппарат кипящего слоя 12 для
охлаждения гранул, в который через подогреватель 13 подается сухой воздух. Из
аппарата 12 готовый продукт направляется на упаковку. Воздух из верхней части
башни 10 поступает в скрубберы 14, орошаемые 20% раствором нитрата аммония, где
отмывается от пыли нитрата аммония и выбрасывается в атмосферу. В этих же
скрубберах очищаются от непрореагировавшего аммиака и азотной кислоты газы,
выходящие из выпарного аппарата и нейтрализатора. Аппарат ИТН, грануляционная
башня и комбинированный выпарной аппарат – основные аппараты в технологической
схеме АС-72М.
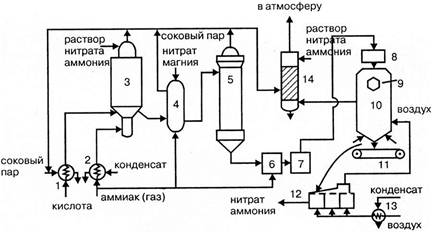
Рисунок 1.3 -
Технологическая схема производства АС-72М:
1 – подогреватель
аммиака; 2 – подогреватель кислоты; 3 – аппарат ИТН; 4 – донейтрализатор; 1 –
выпарной аппарат; 6 – гидрозатвор-донейтрализатор; 7 – сборник плава; 8 –
напорный бак; 9 – виброакустический гранулятор; 10 – грануляционная башня; 11 –
транспортер; 12 – охладитель гранул «КС»; 13 – подогреватель воздуха; 14 –
промывной скруббер
Аппарат ИТН имеет общую высоту 10 м и состоит из двух частей: нижней реакционной и верхней сепарационной. В реакционной части
находится перфорированный стакан в который подают азотную кислоту и аммиак. При
этом за счет хорошей теплоотдачи реакционной массы стенкам стакана, реакция
нейтрализации протекает при температуре, более низкой, чем температура кипения
кислоты. Образующийся раствор нитрата аммония закипает, и из него испаряется
вода. За счет подъемной силы пара парожидкостная эмульсия выбрасывается из
верхней части стакана и проходит через кольцевой зазор между корпусом и
стаканом, продолжая упариваться. Затем она поступает в верхнюю сепарационную
часть, где раствор, проходя ряд тарелок, отмывается от аммиака раствором
нитрата аммония и конденсатом сокового пара. Время пребывания реагентов в
реакционной зоне не превышает одной секунды, благодаря чему не происходит термического
разложения кислоты и нитрата аммония. За счет использования теплоты
нейтрализации в аппарате испаряется большая часть воды и образуется 90% раствор
нитрата аммония.
Комбинированный
выпарной аппарат
высотой 16 м состоит из двух частей. В нижней кожухотрубной части диаметром 3м
происходит упаривание раствора, проходящего через трубки, обогреваемые сначала
перегретым паром, нагретым до 180ºС воздухом. Верхняя часть аппарата
служит для очистки выходящей из аппарата паровоздушной смеси и частичного
упаривания поступающего в аппарат раствора нитрата аммония. Из выпарного
аппарата выходит плав нитрата аммония концентрацией 99,7% с температурой около
180ºС.
Грануляционная башня
имеет прямоугольное сечение 11х8 м2 и высоту около 61 м. Через
отверстие в нижней части в башню поступает наружный воздух и воздух из
охладителя гранул. Поступающий в верхнюю часть башни плав нитрата аммония
диспергируется с помощью трех виброакустических грануляторов, в которых струя
плава превращается в капли. При падении капель с высоты около 10 м они
затвердевают и превращаются в гранулы. Кристаллизация плава с влажностью 0,2%
начинается при 167ºС и заканчивается при 140 ºС. Объем воздуха,
подаваемого в башне, составляет в зависимости от времени года 300 – 100 м3/час.
В установках АС – 72М
применяется магнезиальная добавка против слеживаемости продукта (нитрат
магния). Поэтому операции обработки гранул ПАВ, предусмотренной в схемах АС –
67 и АС – 72, не требуется.
Принципиальными отличиями
технологической схемы производства нитрата аммония безупарочным методом (рис.
1.4.) являются: использование более концентрированной азотной кислоты;
проведение процесса нейтрализации при повышенном (0,4МПа) давлении; быстрый
контакт нагретых компонентов.
В этих условиях на стадии
нейтрализации образуется парожидкостная эмульсия, после разделения которой
получают плав концентрацией 98,1%, что позволяет исключить отдельную стадию
упаривания раствора.
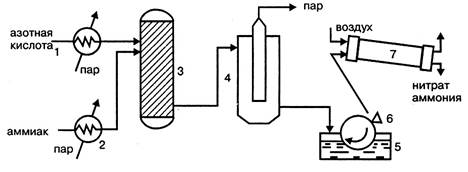
Рисунок 1.4 - Технологическая
схема безупарочного метода:
1 – подогреватель азотной
кислоты; 2 – подогреватель аммиака; 3 – реактор (нейтрализатор); 4 – сепаратор
эмульсии; 1 – барабанный кристаллизатор; 6 – нож; 7 – барабанная сушка.
Нагретые в нагревателях 1
и 2, обогреваемые паром, выходящим из сепаратора, эмульсии 4, азотная кислота и
аммиак поступают в нейтрализатор 3, где в результате реакции образуется
эмульсия из водного раствора нитрата аммония и водяного пара. Эмульсия
разделяется в сепараторе 4 и плав нитрата аммония подается в барабанный
кристаллизатор 1, в котором нитрат аммония кристаллизируется на поверхности
металлического барабана, охлаждаемого изнутри водой.
Образовавшийся на
поверхности барабана слой твердого нитрата аммония толщиной около 1 мм срезается ножом 6 и в виде чешуек поступает для просушивания в барабанную сушилку 7. Подобный
продукт в виде чешуек используется для технических целей.
1.3
Производство карбамида
1.3.1
Свойства карбамида
Карбамид (мочевина) –
диамид угольной, или амид карбаминовой кислот CO(NH2)2.
Генетическая связь производных угольной кислоты может быть выражена следующей
схемой:
ОН
ОН ОNН4 NН2
|
| | |
C=О
C=О C=О C=О
|
| | |
ОН NН2
NН2 NН2
угольная
карбаминовая карбамат карбамид
кислота
кислота аммония
Карбамид представляет
собой твердое кристаллическое вещество с температурой плавления 132,7ºС.
Хорошо растворим в воде, этаноле и жидком аммиаке, что используется для
получения аммиакатов. При нагревании выше 130 ºС подвергается термической
диссоциации с образованием биурета и выделением аммиака:
2CO(NH2)2
= H2N – CO – NH – СО – H2N
+ NH3.
Водные растворы карбамида
устойчивы до 80 ºС, при более высокой температуре разлагаются через
образование карбоната аммония на аммиак и оксид углерода (IV):
CO(NH2)2
+ 2H2O Û (NH4)2CO3 Û (NH4)2HCO3
+ Û
Û CO2 + H2O +
2NH3.
Это исключает возможность
длительного нагревания растворов карбамида при атмосферном давлении, например,
в процессе выпаривания.
Карбамид – безбалластное
высококонцентрированное МУ. Он легко усваивается растениями. Содержание азота в
нем в амидной форме составляет 46,6%. По сравнению с нитратом аммония карбамид
более богат азотом, меньше слеживается, не взрывоопасен в смесях с
органическими веществами и медленнее вымывается из почвы.
1.3.2
Физико-химические основы процесса синтеза
В основе получения
карбамида лежит взаимодействие аммиака с оксидом углерода (IV) с последующей
дистилляцией продуктов синтеза и переработкой полученных растворов. При синтезе
карбамида последовательно протекают две обратимых реакции:
образование карбамата
аммония:
2NH3 + CO2 Û CO(NH2)(ONH4) – 121,6 кДж
(1)
и дегидратации карбамата
аммония до карбамида:
CO(NH2)(ONH4)ÛCO(NH2)2
+ H2O–11,1 кДж (2)
Процесс синтеза
описывается суммарным уравнением:
2NH3
+ CO2 = CO(NH2)2 + H2O – 110,1кДж.
Он протекает в
гетерогенной системе, состоящей из газообразной фазы (аммиак, диоксид углерода,
пары воды) и жидкой фазы, включающей расплавленные и растворенные компоненты
(аммиак, карбамат аммония, карбонаты аммония, карбамид) и воду.
Скорости реакций 1 и 2
различны. Реакция 1 протекает значительно быстрее реакции 2, поэтому
лимитирующей процесс синтеза стадией, от которой и зависит выход продукта,
является стадия дегидратации карбамата аммония 2. Состояние равновесия и
скорость ее определяются температурой, давлением, соотношением аммиака и
диоксида углерода и содержанием воды в реакционной смеси.
Скорость реакции 2
возрастает с увеличением температуры и давления. Так как она протекает с
поглощением тепла, то повышение температуры одновременно способствует смещению
равновесия вправо и увеличивает степень конверсии карбамата аммония.
Повышение температуры
быстро смещает равновесие реакции 1 влево, что приводит к уменьшению
концентрации карбамата и, следовательно, к падению скорости реакции 2 конверсии
карбамата в карбамид.
Максимальная степень
превращения карбамата аммония в карбамид достигается при температуре около 220ºС.
При этой температуре продолжительность процесса составляет около 60 минут. При
понижении температуры для достижения более высокой степени превращения
карбамата в карбамид время процесса существенно увеличивается.
Скорость образования
карбамата аммония возрастает пропорционально квадрату давления и при давлении 1
МПа протекает практически мгновенно.
Наибольшее влияние на
выход карбамида оказывает избыток аммиака в исходной смеси сверх
стехиометрического количества (NH3 : CO2 – 2 : 1).
Избыток аммиака смещает равновесие реакции 1, а также вследствие своего
дегидратирующего действия связывает реакционную воду, удаляя ее из сферы
реакции, и смещает вправо равновесие реакции 2. Образование карбамата и его
дегидратация до карбамида протекают в жидкой фазе, поэтому в реакторе должны
быть созданы условия ее существования. Этому способствует увеличение степени
заполнения реактора, что приводит к уменьшению объема газовой фазы, и нагрев
реакционной смеси до температуры выше эвтектической точки системы
«карбамат-карбамид», равной 98ºС.
Влияние различных
факторов на состояние равновесия системы «карбамат-карбамид» можно представить
в виде следующей схемы:
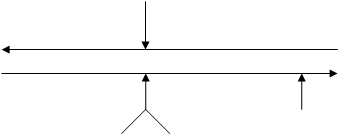 Т (за счет
экзотермичности реакции 1) Т (за счет
экзотермичности реакции 1)
сдвиг влево
сдвиг вправо
Р
(за счет
ускоре- (за счет подав- NH3/CO2
ния наступления
ления диссоци- (за счет связывания
равновесия ации
карбамата воды в реакции 2)
в реакции
2) в реакции 1)
Оптимальный режим
процесса синтеза карбамида должен обеспечить: быстрое и полное протекание
реакции 1, протекание реакции 2 не менее, чем на 71%.
Этим условиям отвечают
следующие параметры процесса: температура 180 - 200ºС, давление 20 МПа,
избыток аммиака 100% сверх стехиометрического количества, то есть мольное
отношение NH3 : CO2 – 4 : 1
1.3.3
Технологическая схема производства
В результате
взаимодействия аммиака и оксида углерода (IV) образуется сложная система,
состоящая из целевого продукта карбамида, полупродукта карбамата аммония, воды,
карбонатов аммония и избытка аммиака. Для выделения из нее твердого карбамида и
утилизации не вступивших в реакцию остальных компонентов и карбамата полученный
раствор подвергают дистилляции. В процессе дистилляции отгоняется избыток
аммиака и воды и происходит разложение карбонатов аммония (аммонийных солей).
В зависимости от того,
возвращаются эти продукты в процесс или после отделения карбамида используются
в других производствах (например, для получения нитрата аммония),
технологические схемы производства карбамида делятся на две группы:
-
без возвращения
продуктов дистилляции в цикл (разомкнутая схема, без рецикла);
-
с возвращением
продуктов дистилляции в цикл (замкнутая схема, с рециклом).
В первом случае весь
выделившийся при дистилляции аммиак поглощают азотной кислотой для получения
нитрата аммония, при этом производство карбамида комбинируется с производством
нитрата аммония.
Во втором случае продукты
дистилляции частично (частичный рецикл) или полностью (полный рецикл)
возвращаются в цикл на синтез карбамида. Существуют для варианта полного
рецикла: газовый рецикл, при котором продукты дистилляции возвращаются в газообразном
виде, и жидкостный рецикл, при котором они возвращаются в виде раствора
аммонийных солей.
На рисунке 1.3.
представлена принципиальная схема производства карбамида с полным жидкостным
рециклом.
Аммиак
Вода
       Синтез Дистилляия
Упаривание Карбамид Синтез Дистилляия
Упаривание Карбамид
Диоксид
Раствор
углерода
аммонийных
солей
Рисунок 1.3 -
Принципиальная схема с полным рециклом
Наиболее экономична
технологическая схема с полным жидкостным рециклом, так как в ней не требуется
сжатия возвращаемых в цикл горячих газов (аммиака и диоксида углерода), что
может вызвать засорение трубопроводов образующимся твердым карбамидом и их
коррозию.
На рис. 1.4 приведена
технологическая схема производства карбамида с полным жидкостным рециклом и
двухступенчатой дистилляцией плава мощностью 90 тыс. тонн в год.
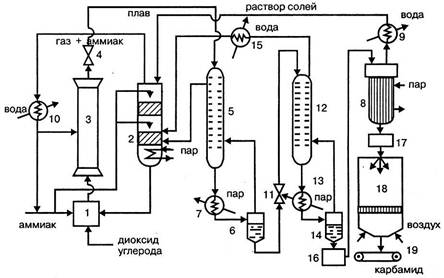
Рисунок 1.4 -
Технологическая схема производства карбамида:
1 – смеситель аммиака,
диоксида углерода и раствора аммонийных солей, 2 – промывная колонна; 3 –
колонна синтеза; 4, 11 – редукторы; 1 – ректификационная колонна I ступени; 6 –
сепаратор; 7, 13 – подогреватели; 8 – выпарные аппараты I и II ступеней; 9, 10,
11 – холодильники-конденсаторы; 12 – ректификационная колонна II ступени; 14 –
сепаратор II ступени; сборник раствора карбамида; 17 – сборник плава; 18 –
грануляционная башня; 19 – транспортер
Оксид углерода (IV),
очищенный от примесей и сернистых соединений, сжатый до 20 МПа, и жидкий аммиак
под давлением 11 МПа поступают в смеситель 1 при температуре 80 – 100ºС.
Сюда же подается раствор аммонийных солей из промывной колонны 2. В смесителе
обеспечивается мольное отношение NH3:CO2:H2O=4,1:1:0,1.
Из смесителя смесь, разогревшаяся за сет частичного образования карбамата до
171ºС, направляется в нижнюю часть колонны синтеза 3, где заканчивается
образование карбамата аммония, и он превращается на 61% в карбамид. Для
обеспечения оптимального теплового режима в колонну дополнительно вводят жидкий
аммиак. Из верхней части колонны плав после дросселирования в редукторе 4
подается на двухступенчатую дистилляцию. Агрегат дистилляции каждой ступени
состоит из трех аппаратов: ректификационной колонны, подогревателя и
сепаратора. Сначала плав поступает в ректификационную колонну 1 первой ступени
1, где давление снижается до 2 МПа. В колонну 1 из сепаратора первой ступени 6
подается противотоком газ. В колонне первой ступени проходит выделение
карбамида из реакционной смеси, разложение карбамата аммония и образование из
аммиака диоксида углерода и воды водного раствора аммонийных солей. Плав из
колонны 1, пройдя подогреватель 7, поступает при температуре 160 ºС в
сепаратор первой ступени 6, в котором разделяются жидкая и газообразная фазы.
Газы возвращаются в колонну 1 и оттуда в нижнюю часть промывной колонны 2.
Верхняя часть промывной колонны орошается жидким аммиаком и аммиачной водой,
поступающей в виде конденсата из выпарного аппарата 8 через
холодильник-конденсатор 9. В промывной колонне из газа вымывается диоксид
углерода и образуется водный раствор аммонийных солей, а газообразный аммиак
отводят из верхней части колонны и после сжижения в холодильнике-конденсаторе
10 возвращают в процесс. Водный раствор аммонийных солей перекачивается в
смеситель 1 и оттуда в колонну синтеза 3. Раствор карбамида из сепаратора
первой ступени 6 дросселируется до давления 0,3 МПа в редукторе II и подается в
ректификационную колонну второй ступени 12, откуда поступает в подогреватель 13
и сепаратор 14. В колонне второй ступени происходят дальнейшее разложение
карбамата до аммиака и диоксида углерода и образование водного раствора
карбоната и бикарбоната аммония. Из нижней части сепаратора 14 выходит 70%
раствор карбамида, а из верхней – парогазовая смесь, содержащая аммиак, диоксид
углерода и пары воды, которая поступает в нижнюю часть ректификационной колонны
12. Газовая смесь из колонны 12 охлаждается в холодильнике-конденсаторе 11 и в
виде раствора аммонийных солей подается в нижнюю часть промывной колонны 2.
Раствор карбамида из сепаратора второй ступени 14 собирается в сборнике 16 и
подается на упаривание последовательно в вакуум-аппараты первой и второй
ступеней при температуре 140ºС и давлении 0,003 МПа. Полученный плав
карбамида концентрацией около 0,998 мас. дол. поступает через сборник плава 17
в грануляционную башню 18 и распыляется в ней. Образовавшиеся гранулы при
температуре около 70ºС транспортером 19 подают на операции классификации,
охлаждения и упаковки. Выход карбамида в расчете на диоксид углерода составляет
около 91%.
В последние годы в
производстве карбамида был внедрен стриппинг-процесс, в котором
разложение карбамата аммония в плаве ведут при давлении, близком к давлению
синтеза, путем продувки плава сжатым диоксидом углерода. В этих условиях
карбамат аммония диссоциирует за счет снижения парциального давления аммиака и
сдвига равновесия реакции 1 влево. На принципе стриппинг-процесса в настоящее
время работают установки большой единичной мощности 1000 – 1100 т/сут.
Технологическая схема подобного процесса представлена на рисунке 1.1.
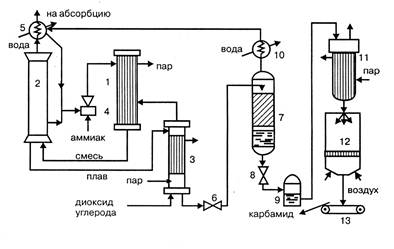
Рисунок 1.1 -
Технологическая схема стриппинг-процесса
1 – конденсатор высокого
давления; 2 – колонна синтеза; 3 – отдувочная колонна; 4 – инжектор; 1 –
скруббер; 6 – редуктор; 7 – ректификационная колонна; 8 – редуктор; 9 – сборник
раствора; 10 – холодильник- конденсатор; 11 – выпарной аппарат; 12 – гранулятор;
13 – транспортер
Из конденсатора высокого
давления 1 в нижнюю часть колонны синтеза 2 поступают водный раствор карбамата
аммония, аммонийных солей, аммиак и диоксид углерода. Образовавшийся плав
направляется в отдувочную колонну 3, обогреваемую паром, в которую противотоком
поступает под давлением 11 МПа диоксид углерода. Из колонны 3 парогазовая
смесь, содержащая свежий диоксид углерода, поступает в конденсатор высокого
давления 1, куда через инжектор 4 вводится жидкий аммиак. Он одновременно служит
рабочим телом в инжекторе, подающем в конденсатор раствор аммонийных солей из
скруббера 1 и часть плава из колонны синтеза. В конденсаторе образуется
карбамат, а тепловой эффект реакции используют для выработки пара.
Непрореагировавшие в колонне синтеза газы и пары воды поступают в скруббер
высокого давления 1, в котором конденсируются и через инжектор 4 направляются в
конденсатор высокого давления 1. Водный раствор карбамида, выходящий из
отдувочной колонны 3, содержит до 1% карбамата аммония. Для его разложения
раствор дросселируют в редукторе 6 до давления 0,3 – 0,6 МПа и направляют в
верхнюю часть ректификационной колонны 7. В ней жидкая фаза в виде 70% раствора
карбамида стекает вниз и после снижения давления до 0,1 МПа в редукторе 8
собирается в сборнике раствора 9. Водяные пары, выходящие из ректификационной
колонны 7, конденсируются в холодильнике-конденсаторе 10, растворяя
содержащиеся в них аммиак и диоксид углерода, и полученный раствор аммонийных
солей направляется в скруббер 2. Раствор карбамида из сборника 9 поступает в
выпарной аппарат 11 и после упаривания в грануляционную башню 12, откуда в виде
гранул направляется транспортером 13 на склад.
Стриппинг-процесс
производства карбамида позволяет использовать тепловой эффект реакции
образования карбамида, упростить технологическую схему, сократить количество
оборотной воды и, в целом, является поэтому более экономичным, чем обычный.
Дальнейшее
совершенствование производства карбамида заключается в создании интегральных
схем, объединяющих производство карбамида, аммиака и нитрата аммония, повышении
единичной мощности установок, внедрении технологических схем со
стриппинг-процессом.
В заключении в табл.1.2
приведены расходные коэффициенты в производстве нитрата аммония и карбамида.
Таблица 1.2 –
Расходные коэффициенты в
производстве азотных удобрений
| Сырье и энергия (на тонну готового продукта) |
Производство нитрата аммония в установке АС-72М |
Производство карбамида |
| Полный жидкостный цикл |
Стриппинг- процесс |
| Аммиак, т |
0,214 |
0,18 |
0,176 |
| Диоксид углерода, т |
- |
0,77 |
0,71 |
| Азотная кислота, т |
0,786 |
- |
- |
|
Вода, м3
|
0,1 |
100 |
87 |
| Электроэнергия, кВт·ч |
21,1 |
110 |
120 |
| Пар, т |
0,214 |
1,1 |
1,01 |
|