Доклад: Хлор
Доклад: Хлор
2. Хлор.
По распространенности в
природе хлор близок к фтору на его долю приходится 0,02 % от общего числа
атомов земной коры. Человеческий организм содержит 0,25 вес. % хлора.
Природный хлор состоит из смеси
двух изотопов — 35Сl (75,5 %) и 37Сl (24,5 %). Он был
впервые получен (действием МnО2 на соляную кислоту ) в 1774 г., но
установление его элементарной природы последовало лишь в 1810 г.
Подобно фтору, основная
масса хлора поступила на земную поверхность из горячих недр Земли. Даже в
настоящее время с вулканическими газами ежегодно выделяются миллионы тонн и НСl
и НF. Еще гораздо более значительным было такое выделение в минувшие эпохи.
Первичная форма нахождения
хлора на земной поверхности отвечает его чрезвычайному распылению. В результате
работы воды, на протяжении многих миллионов лет разрушавшей горные породы и
вымывавшей из них все растворимые составные части, соединения хлора
скапливались в морях. Усыхания последних привело к образованию во многих местах
земного шара мощных залежей NаС1, который и служит исходным сырьем для
получения соединений хлора.
Будучи наиболее практически
важным из всех галоидов, хлор в громадных количествах используется для беления
тканей и бумажной массы, обеззараживания питьевой воды (примерно 1,5 г на 1 м3)
и в других отраслях техники. Ежегодное мировое потребление хлора исчисляется
миллионами тонн.
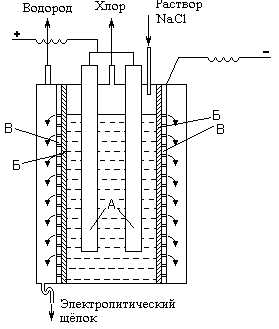
Рис. . Принципиальная схема электролизёра для
получения хлора.
Основным промышленным
методом получения хлора является электролиз концентрированного раствора NаС1.
Принципиальная схема электролизера показана на рис. VII-5 (А - аноды, Б - диафрагма, В - катод). При электролизе на аноде выделяется хлор (2С1- - 2е- = С12), а в при катодном
пространстве выделяется водород (2Н+ + 2е- = Н2) образуется NаОН.
При практическом
осуществлении электролиза раствора NaCl расход электроэнергии на получение 1 т
хлора составляет около 2700 кВт·ч. Полученный хлор под
давлением сгущается в желтую жидкость уже при обычных температурах. Хранят и
перевозят его в стальных баллонах, где он заключен под давлением около 6 атм.
Баллоны эти должны иметь окраску защитного цвета с зеленой поперечной полосой в
верхней части.
Для лабораторного получения
хлора обычно пользуются действием MnO2 или КМnO4 на
соляную кислоту:
МnО2 + 4 НСl = МnСl2 + Сl2 + 2 Н2О
2 КМnO4 + 16 НCl = 2 КCl + 2 МnСl2
+ 5 Сl2 + 8 Н2О
Вторая реакция протекает значительно энергичнее первой
(требующей подогревания).
Свободный хлор представляет
собой желто-зеленый газ, состоящий из двухатомных молекул. Под обычным
давлением он сжижается при -34 °С и затвердевает при -101 °С. Один объем воды растворяет около двух объемов хлора. Образующийся
желтоватый раствор часто называют «хлорной водой».
Критическая температура
хлора равна 144 °С, критическое давление 76 атм. При температуре
кипения жидкий хлор имеет плотность 1,6 г/см3, а теплота его
испарения составляет 20,5 кДж/моль. Твердый хлор имеет плотность 2,0 г/см3
и теплоту плавления 6,3 кДж/моль. Кристаллы его образованы отдельными
молекулами С12 (кратчайшее расстояние между которыми равно 334 пм).
Связь Сl-Сl характеризуется ядерным расстоянием 198 пм. Термическая диссоциация
молекулярного хлора по уравнению С12 + 242 кДж Û 2 С1 становится заметной примерно с 1000 °С.
Атом хлора имеет в основном
состоянии структуру внешнего электронного слоя 3s23р5 и
одновалентен. Возбуждение его до ближайшего трехковалентного уровня 3s23р44s1
требует затраты
857 кДж/моль.
Энергия присоединения
электрона к нейтральному атому хлора оценивается в 355 кДж/моль. Сродство к
электрону хлора (аналогично и других галоидов) может быть вычислено при помощи
рассмотрения реакций образования хлористых солей по отдельным стадиям.
Например, для NаС1 имеем:
1) Nа (т) = Nа (г) — 109 кДж (теплота возгонки)
2) 1/2 С12 (г) = С1 (г) — 121 кДж (теплота
диссоциации)
3) Na (г) = Nа+(г) + е- — 493 кДж (энергия ионизации)
4) С1(г) + е- = Сl-(г) + Х кДж (искомое сродство к электрону)
5) Nа+(г) + Сl-(г) = NаС1(т) +777 кДж (энергия кристаллической
решетки)
в сумме: Nа(т) + 1/2 С12(г) = NаСl(т) +
(Х+777-493-121-109) кДж
С другой стороны, непосредственно определенная на
опыте теплота образования NаС1 из элементов равна: Nа(т) + 1/2 С12(г)
= NаС1(т) + 410 кДж. Следовательно, по закону Гесса, Х + 777 - 493 - 121 - 109 = 410, откуда Х = 356 кДж.
Ион С1- — характеризуется эффективным радиусом 181 пм и
энергией гидратации 351 кДж/моль. Для ковалентного радиуса хлора принимается
половина ядерного расстояния молекулы С12, т. е. 99 пм.
Растворимость хлора в воде
меняется с температурой следующим образом:
| Температура, °С |
0 |
10 |
15 |
20 |
25 |
30 |
40 |
50 |
60 |
|
Растворимость V на 1V H2O
|
4,6 |
3,1 |
2,7 |
2,3 |
2,0 |
1,8 |
1,4 |
1,2 |
1,0 |
Описаны два кристаллогидрата хлора — С12·6Н2О и С12·8Н2О.
В действительности они могут иметь переменный состав, так как являются
клатратами.
Значительно хуже (примерно в
4 раза), чем в воде, растворяется хлор в насыщенном растворе NаС1, которым
поэтому и удобно пользоваться при собирании хлора над жидкостью. Наиболее
пригодным для работ с ним органическим растворителем является четыреххлористый
углерод (СС14), один объем которого растворяет при обычных условиях
около 50 объемов хлора.
Основным потребителями хлора
являются органическая технология (получение хлорированных полупродуктов
синтеза) и целлюлозно-бумажная промышленность (отбелка). Значительно меньше
потребляется хлор в неорганической технологии, санитарной технике и других
областях. Интересно недавно предложенное использование хлора для обработки
металлов: под его действием с достаточно нагретой (инфракрасным излучением)
поверхности все шероховатости удаляются в форме летучих хлоридов. Такой метод
химической шлифовки особенно применим к изделиям сложного профиля. Было
показано также, что струя хлора легко прорезает достаточно нагретые листы из
жаростойких сплавов.
Хлор обладает резким
запахом. Вдыхание его вызывает воспаление дыхательных путей. В качестве
средства первой помощи при острых отравлениях хлором применяется вдыхание паров
смеси спирта с эфиром. Полезно также вдыхание паров нашатырного спирта.
Предельно допустимой
концентрацией свободного хлора в воздухе производственных помещений считается
0,001 мг/л. Пребывание в атмосфере, содержащей 0,01% хлора и выше, быстро ведет
к тяжелому заболеванию. Признаком острого отравления является появление
мучительного кашля. Пострадавшему необходимо прежде всего обеспечить полный
покой; полезно также вдыхание кислорода.
По своей характерной
химической функции хлор подобен фтору — он также является одновалентным
неметаллом. Однако активность его меньше, чем у фтора. Поэтому последний
способен вытеснять хлор из соединений.
Тем не менее химическая
активность хлора очень велика —
|
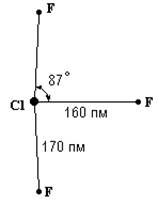
Рис. . Строение молекулы
ClF3.
|
он соединяется почти со всеми металлами (иногда лишь
в присутствии следов воды или при нагревании) и со всеми металлоидными
элементами, кроме С, N и O. Важно отметить, что при полном отсутствии влаги
хлор не действует на железо. Это и позволяет хранить его в стальных баллонах.
Взаимодействие хлора с
фтором при нагревании смеси сухих газов происходит лишь выше 270 °С. В этих условиях с выделением тепла (50 кДж/моль) образуется
бесцветный хлорфторид — С1F (т. пл. -156, т. кип. -100 °C). Газообразный С1F обладает сильным своеобразным
запахом (отличным от запахов хлора и фтора).
Взаимодействием хлорфторида
с фторидами Сs, Rb и К под высоким давлением были получены бесцветные
малостойкие соли типа МС1F2, содержащие в своем составе линейный
анион С1F2-. При нагревании они
экзотермически разлагаются около 250 °С.
Нагреванием ClF с избытком
фтора может быть получен бледно-зеленоватый трехфтористый хлор (хлортрифторид)
— СlF3 (т. пл. -76, т. кип. +12 °С). Соединение это также экзотермично (теплота образования из элементов
159 кДж/моль) и по запаху похоже на С1F. Молекула С1F3 полярна (m = 0,55) и имеет показанную на рис. плоскую структуру. Последняя
производится от тригональной бипирамиды, у которой два направления треугольного
основания закрываются свободными электронными парами атома хлора. Критическая
температура С1F3 равна 154 °С, плотность в
жидком состоянии 1,8 г/см3, теплота испарения 27,6 кДж/моль. Вблизи
точки кипения пар трехфтористого хлора несколько ассоциирован по схеме: 2 С1F3
Û (С1F3)2 + 12,5 кДж. Для димера
вероятна мостиковая структура (по типу F2С1F2С1F2).
Жидкий С1F3
смешивается с жидким НF в любых соотношениях, причем имеет место слабое
взаимодействие по схеме: НF + С1F3 Û НС1F4
+ 16,7 кДж. Образующийся ацидохлортетрафторид не выделен, но производящиеся от
него соли типа МС1F4, (где М — Сs, Rb, К) известны. По-видимому, они
могут быть получены не только прямым сочетанием МF и С1F3, но и
фторированием соответствующих хлоридов (3000 атм, 300 °С).
Нагреванием смеси С1F3
с избытком фтора под высоким давлением может быть получен бесцветный хлорпентафторид
— С1F5 (т. пл. -93, т. пл. -13 °С). Теплота его образования из элементов 251 кДж/моль.
Молекула С1F5, имеет строение квадратной пирамиды из атомов фтора,
вблизи основания которой располагается атом хлора. В отсутствие влаги этот газ
при обычных условиях устойчив, а водой разлагается. Он является энергичным
фторирующим агентом, но корродирует металлы слабее, чем С1F3.
Фториды хлора
характеризуются исключительной реакционной способностью. Например, в парах С1F3
стеклянная вата самовоспламеняется. Почти столь же энергично взаимодействуют с
ним и такие сами по себе чрезвычайно устойчивые вещества, как MgО, СаО, А12O3
и т. п. Так как С1F3 сжижается при обычных температурах уже под
небольшим давлением и легко отщепляет фтор, его удобно использовать для
транспортировки фтора. Помимо различных реакций фторирования, отмечалась
возможность применения этого вещества как окислителя реактивных топлив и
зажигательного средства в военной технике. По трифториду хлора имеется обзорная
статья.
Взаимодействие хлора с
водородом по реакции:
Н2 + С12 = 2 НС1 + 184 кДж
при обычных условиях протекает крайне медленно, но
нагревание смеси газов или ее сильное освещение (прямым солнечным светом,
горящим магнием и т. д.) сопровождается взрывом.
Детальное изучение этой
реакции позволило выяснить сущность ее отдельных стадий. Прежде всего за счет
энергии (hn) ультрафиолетовых лучей (или нагревания) молекула
хлора диссоциирует на атомы, которые затем реагируют с молекулами водорода,
образуя НСl и атом водорода. Последний в свою очередь реагирует с молекулой
хлора, образуя НС1 и атом хлора, и т. д.:
1) С12 + hn = С1 + С1
(первоначальное возбуждение)
2).............................С1 + Н2 =
НС1 + Н
3)...........................................................Н+
С12 = НС1 + С1 и т. д.
Таким образом, получается как бы цепь последовательных
реакций, причем за счет каждой первоначально возбужденной молекулы Сl2
образуется в среднем 100 тыс. молекул НС1. Реакции подобного типа называются
цепными. Они играют важную роль при протекании многих химических процессов.
Фотохимическая диссоциация
молекулы хлора на атомы вызывается светом с длиной волны 550 нм. Обеим стадиям
цепной реакции образования хлористого водорода соответствуют следующие
термохимические уравнения:
С1 + Н2 + 1 кДж = НС1 + Н и Н + С12
= НС1 + С1 + 188 кДж. Энергия активации первой из этих реакций составляет 25, а
второй 8 кДж/моль. Малыми значениями этих энергий и обусловлено быстрое
развитие цепи.
Очевидно, что цепь могла бы
оборваться, если бы протекала реакция: Н + С1 = НС1. Такая возможность не
исключена, однако вероятность осуществления этой реакции очень мала, так как
концентрация атомов ничтожна по сравнению с концентрацией молекул и поэтому
несравненно больше шансов имеет столкновение каждого из атомов с молекулой
другого элемента, чем обоих атомов друг с другом. С другой стороны,
произведенные на основе экспериментальных данных расчеты показывают, что даже
при столкновении обоих атомов соединение между ними происходит далеко не
всегда,
Рис 1-2 888888888
наоборот, процент успешных встреч очень мал. По этим
же причинам цепи редко обрываются в результате реакций: С1+ Сl = С12
и Н + Н = Н2. Так, последняя из них осуществляется в газовой фазе
лишь при одном столкновении из каждого миллиона.
“Огромное большинство
реакций при ближайшем рассмотрении являются цепными реакциями” (Н. Н. Семенов).
Это нередко вызывает отклонение их действительной молекулярности от отвечающей
простейшему суммарному уравнению. В частности наблюдаемая на опыте
бимолекулярность реакции образования волы из элементов обусловлена именно ее
цепным характером: начало цепи дает (с энергией активации 188 кДж/моль)
реакция Н2 + О2 = 2 ОН, после чего цепь разветвляется по
схемам: ОН + Н2 = Н2О + Н, Н + О2 = ОН + О, О
+ Н2 = ОН + Н и т. д. Как видно из этих схем, число активных
участников реакции (ОН, Н, О) последовательно возрастает, вследствие чего
процесс протекает с самоускорением. Это и характерно для разветвленных цепных
реакций, в отличие от неразветвленных, примером которых может служить синтез
хлористого водорода.
Большие количества НС1
получают в технике как побочный продукт хлорирования органических соединений по
схеме
RН + Cl2 = RС1 + НС1
где R — органический радикал. Однако для получения
чистой соляной кислоты основное значение имеет прямой синтез. Исходным сырьем
служат при этом хлор и водород, одновременно выделяющийся при электролизе
раствора NаС1. Спокойное протекание процесса обеспечивается смешиванием обоих
газов лишь в момент взаимодействия.
Еще один метод промышленного
получения НС1 основан на взаимодействии NаС1 и концентрированной Н2SO4
по реакциям
NаС1 + Н2SO4 = NаНSO4
+ НС1
NаС1 + NаНSO4 = Nа2SO4 + НС1
Первая из них протекает в значительной степени уже при
обычных условиях и практически нацело — при слабом нагревании; вторая
осуществляется лишь при более высоких температурах. Для проведения процесса
служат специальные механизированные печи большой производительности.
Максимальная температура
водородно-хлорного пламени составляет около 2200 °С. Для
технического синтеза НС1 служит установка, схематически показанная на рис. Ч11
—8. После первоначального поджигания смесь хлора с водородом продолжает гореть
спокойным пламенем, образуя хлористый водород. Последний проходит затем сквозь
две поглотительные башни с водой, в которых и образуется соляная кислота.
Используемый в системе принцип противотока, т. е. противоположных направлений
движения газа и жидкости, обеспечивает полноту поглощения НС1 и позволяет
проводить весь процесс непрерывно.
Основной частью показанной
на рис. Ч11—9 механизированной печи для получения НСl является муфель А, со
всех сторон обогреваемый горячими газами, идущими из топки Б. Внутри муфеля
медленно вращается мешалка, гребенки которой устроены таким образом, что
реагирующая масса передвигается ими от центра муфеля (куда подаются исходные
вещества) к его краям. Выделяющийся хлористый водород после его обеспыливания и
охлаждения улавливается водой, а образующийся Nа2SO4
сбрасывается в бункер Г (откуда грузится на вагонетки). Печь работает
непрерывно и перерабатывает за сутки несколько тонн NаС1.
С теоретической стороны
интересен метод получения хлористого водорода путем пропускания смеси хлора с
водяным паром сквозь слой раскаленного угля. Реакция в этих условиях идет по
уравнению:
2 Сl2 + 2 Н2О + С = СO2
+ 4 HCl + 280 кДж
Так как она сильно экзотермична, уголь поддерживается
в раскаленном состоянии за счет ее тепла. Практически этот метод не применяется
(так как получающийся влажный хлористый водород сильно разъедает детали
установки).
Хлористый водород
(гидрохлорид) представляет собой бесцветный газ. В отсутствие влаги он при
обычных температурах не действует на большинство металлов и их оксиды.
Газообразный кислород окисляет его только при нагревании.
Молекула НСl характеризуется
ядерным расстоянием d(HCl) = 128 пм, энергией связи 431 кДж. Хлористый водород
плавится при -114 °С и кипит при -85 °С. Распад НС1 на элементы становится заметным примерно
при 1500 °С.
Под давлением около 70 атм
хлористый водород сжижается уже при обычных температурах и, подобно хлору,
может транспортироваться к местам потребления а стальных баллонах. Жидкий
хлористый водород обладает малой диэлектрической проницаемостью (4,6 при
обычных температурах) и является плохим растворителем подавляющего большинства
неорганических соединений. Растворимы в нем, например, хлориды олова и фосфора.
Интересно, что РF3 растворим и жидком НС1, но не взаимодействует с
ним, тогда как АsF3 и SbF3 испытывают полный сольволиз по
схеме
ЭF3 + 3 НС1 = 3 НF + ЭС13
С темно-красным окрашиванием растворяется иод. Жидкий
НС1 смешивается с жидкими СО2 и Н2S.
Предельно допустимой
концентрацией хлористого водорода в воздухе производственных помещений
считается 0,005 мг/л. Наличие уже 0,05 мг/л быстро вызывает раздражение в носу
и гортани, колотье в груди, хрипоту и ощущение удушья. При хроническом
отравлении малыми концентрациями НС1 особенно страдают зубы, эмаль которых
подвергается быстрому разрушению.
Реакция в газовой фазе по
уравнению
О2 + 4 НС1 = 2 Н2О + 2 С12
+ 117 кДж
обратима. Ниже 600 °С равновесие ее
смещено вправо, выше 600 °С — влево. На этой реакции был основан часто
применявшийся ранее метод технического получения хлора: пропусканием смеси НС1
с воздухом над нагретым до 450 °С катализатором (пропитанный
раствором СuС12 асбест) удавалось получать хлор с выходом около 70 %
от теоретического. В связи с характерной для последнего времени дефицитностью
хлора подобный метод может вновь приобрести промышленное значение.
На воздухе хлористый водород
дымит вследствие образования с парами воды капелек тумана. Растворимость его
весьма велика: при обычных условиях 1 объем воды способен поглотить около 450
объемов хлористого водорода.
Раствор НCl в воде
называется хлористоводородной (иначе соляной) кислотой. Она относится к числу
наиболее сильных кислот. Реактивная соляная кислота обычно имеет плотность 1,19
г/см3 и содержит около 37 % хлористого водорода. Состав ее близок к
формуле HCl·3,5H2O.
Растворимость НС1 в воде
меняется с температурой следующим образом:
| Температура, °С |
0 |
10 |
15 |
20 |
25 |
30 |
40 |
50 |
60 |
|
Растворимость в V на 1 V Н2О
|
507 |
474 |
459 |
442 |
426 |
412 |
386 |
362 |
339 |
Растворение сопровождается выделением тепла (до 75
кДж/моль НСl). Давление хлористого водорода над крепкой соляной кислотой при 20
°С приводится ниже:
| Концентрация НСl, % |
24 |
26 |
28 |
30 |
32 |
34 |
36 |
38 |
| P, мм рт. ст. |
1,0 |
2,2 |
4,9 |
10,6 |
23,5 |
50,5 |
105 |
210 |
При смешивании концентрированной НС1 со снегом
происходит резкое понижение температуры. Содержащий 25 вес.% НС1 водный раствор
замерзает лишь при — 86 °С.
Органические жидкости
поглощают хлористый водород гораздо хуже воды. Например, при обычных условиях
эфир растворяет НС1 примерно в 3,5 раза, а бензол — в 50 раз меньше, чем вода.
Хлористый водород образует с
водой азеотропную смесь, которая кипит под обычным давлением при 109 °С и содержит 20,2% НС1.
Охлаждением
концентрированных водных растворов хлористого водорода могут быть выделены
кристаллогидраты НСl с 6, 3, 2 и 1 молекулами Н2О, плавящиеся с
разложением соответственно при -70, -25, -18, -15 °С. Последний из них по структуре является хлоридом оксония (Н3О+С1-), в
кристаллогидрате НСl·2Н2О четко выявляются катионы Н5О2+ с очень короткой водородной связью [d(OO) = 241 пм]
между двумя молекулами воды, а структура тригидрата соответствует формуле Н5О2+Сl-·Н2О. С жидким
хлором хлористый водород дает молекулярные соединения состава С12·2НС1 и С12·НС1, плавящиеся
соответственно при -121 и -115 °С.
Техническая соляная кислота
выпускается крепостью не менее 31% НС1 (синтетическая) или 27 % HСl (из NаСl).
Приблизительное процентное содержание НС1 в водном растворе легко найти,
умножив на 2 число дробных долей его плотности. Например, при плотности 1,19 г/см3
процентное содержание получается равным 19·2 = 38 %.
Следовательно, и обратно, зная процентное содержание НС1 в соляной кислоте той
или иной крепости, можно приближенно оценить ее плотность. Путем приготовления
1,184 н. раствора НС1 удобно создавать среду с рН = 0 (при 25 °С). Как видно из приводимых ниже приблизительных данных, в крепких
водных растворах (с моляльностью больше двух) коэффициент активности (f)
хлористого водорода значительно превышает единицу:
| m |
1 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
| f |
0,8 |
1 |
2 |
3 |
6 |
10 |
17 |
27 |
Соляная кислота очень сильно
разъедает многие металлы. Транспортируют ее в стеклянных бутылях или
гуммированных (т. е. покрытых слоем резины) металлических емкостях.
Гуммирование может быть заменено введением в кислоту специальных добавок —
ингибиторов.
Соляная кислота содержится в
желудочном соке (около 0,3 %) и играет важную роль, так как способствует
перевариванию пищи и убивает различные болезнетворные бактерии (холеры, тифа и
др.). Если последние попадают в желудок вместе с большим количеством воды, то
вследствие разбавления раствора НСl они выживают и вызывают заболевание
организма. Поэтому во время эпидемий особенно опасна сырая вода. При повышении
концентрации НС1 в желудке ощущается изжога, которую устраняют, принимая внутрь
небольшое количество NаНСО3 или МgО. Наоборот, при недостаточной
кислотности желудочного сока соляная кислота прописывается для приема внутрь
(по 5-15 капель 8,3 %-ной НСl на 1/2 стакана воды до или во
время еды).
Подобно другим сильным
кислотам, НС1 энергично взаимодействует со многими металлами, оксидами металлов
и т. д. Соли ее называются хлористыми или хлоридами. Большинство их хорошо
растворимо в воде. Из производных наиболее обычных металлов труднорастворимы
хлориды серебра и свинца. Ежегодное мировое потребление соляной кислоты
исчисляется миллионами тонн. Широкое практическое применение находят также
многие ее соли.
Длительное взаимодействие
безводных СsС1 и НС1 при -78 °С ведет к образованию нестойкого
СsС1·НС1 (давление пара > 400 мм рт. ст. при 30 °С). Хлориды других элементарных катионов подобных соединений не
образуют, но было получено аналогичное производное катиона [N(СН3)4]+ и показано, что ион НСl2- аналогичен иону HF2-. В отличие от НF, образование такого иона [d(СlСl) =
314 пм] для HCl не характерно.
Непосредственное
взаимодействие хлора с кислородом не приводит к образованию кислородных
соединений хлора. Они могут быть получены лишь косвенными методами. Для
рассмотрения путей их образования целесообразно исходить из обратимой реакции
между хлором и водой:
С12 + Н2О + 25 кДж Û НС1 + НОС1
При обычных условиях в насыщенном растворе
гидролизовано около трети всего растворенного хлора.
Взаимодействие хлора с
перекисью водорода первоначально протекает по уравнению:
С12 + Н2О2 = 2 НОС1
Однако избытком Н2О2
хлорноватистая кислота восстанавливается:
НОС1 + Н2О2 = НС1 + Н2О
+ О2
Из образующихся при
гидролизе хлора двух кислот — соляной и хлорноватистой (HOС1) — первая является
очень сильной, а вторая — очень слабой (слабее угольной). Это резкое различие
в силе обеих кислот можно использовать для их разделения.
Если в растворе взболтать
порошок мела (СаСО3) и затем пропускать в него хлор, то
образующаяся соляная кислота реагирует с мелом по уравнению:
CaCO3 + 2 НС1 = СаС12 + СО2 + Н2О
а хлорноватистая накапливается в растворе. Подвергая
реакционную смесь перегонке получают в приемнике разбавленный раствор НОС1.
Будучи соединением
малоустойчивым, НОС1 медленно разлагается даже в таком разбавленном растворе.
Соли хлорноватистой кислоты называются гипохлоритами. И сама HС1O, и ее соли
являются очень сильными окислителями.
Наиболее концентрированные
растворы НОС1 образуются при взаимодействии жидкого С12О с
охлажденной водой (обе жидкости ограниченно растворимы друг в друге). Для
получения растворов крепостью до 5 М удобно обрабатывать хлором (без избытка)
взвесь оксида ртути в четыреххлористом углероде. Образующаяся в растворе С12О
извлекается затем холодной водой. Возможно также получение раствора
хлорноватистой кислоты по реакции:
2 С12 + Вi2О3 + Н2О
= 2 ВiОСl¯ + 2 НОС1
Молекула НОС1 имеет угловое
строение с параметрами d(НО) = 97, d(ОС1) = 169 пм, ÐНОС1 = 103°.
Хлорноватистая кислота
обладает характерным запахом. Ее разбавленные растворы почти бесцветны, а более
крепкие имеют желтый цвет. Константа кислотной диссоциации НОС1 при обычных
условиях равна 4·10-8. Диссоциация ее по основному типу (т. е. НОСl Û НО’+ С1•) экспериментально
не обнаружена. Однако имеются косвенные указания на ее возможность. Например, с
органическими соединениями НОС1 способна реагировать по схемам (R —
органический радикал)
RН + НОС1 = RОН + НС1 и RН + НОСl = Н2О +
RС1
т. е. и как окислитель, и как хлорирующее вещество.
Принципиальная возможность
амфотерной диссоциации НОСl вытекает из общетеоретических соображений. Однако в
присутствии С1’ непосредственно обнаружить С1• нельзя
(из-за реакции по схеме С1• + С1’ = С12·аq).
Так как при переходе от НОН
к НОС1 отрицательный характер кислорода ослабевает, относительная вероятность
внедрения в него протона уменьшается. Поэтому выражаемое схемой
ОН3+ + НОС1 Û Н2О + Н2ОС1+
(или, учитывая неопределенную гидратированность обоих
ионов, Н• + НОСl Û Н2О + Сl•)
равновесие должно быть сильно смещено влево, но по мере повышения концентрации
Н• должно несколько смещаться вправо. Экспериментально доказать
возможность основной диссоциации НОС1 можно было бы, вероятно, подвергнув
электролизу свежеприготовленный раствор С12О в холодной 30 %-ной
серной кислоте: возникающий за счет приведенного выше равновесия положительный
ион хлора должен был бы перемещаться к катоду.
Практический метод
получения гипохлоритов основан на использовании приводимой выше обратимой
реакции взаимодействия хлора с водой. Поскольку оба вещества правой части
равенства — НСl и НОCl — дают в растворе ионы Н•, а оба исходных
продукта — С12 и Н2О — таких ионов не образуют (точнее,
почти не образуют), равновесие можно сместить вправо, связывая ионы Н•.
Добиться этого проще всего
добавлением к реакционной смеси какой-нибудь щелочи. Так как по мере своего
образования ионы Н• будут связываться ионами ОН’ в недиссоциированные молекулы воды, равновесие
практически нацело сместится вправо. Применяя, например, КОН, имеем
С12 + Н2О Û НОС1 + НС1
НОС1 + НС1 + 2 КОН = КОС1 + КС1 + 2 Н2О
или в общем: С12 + 2 КОН = КОС1 + КС1 + Н2О
В результате взаимодействия хлора с раствором щелочи
получается, следовательно, смесь солей хлорноватистой и соляной кислот. Этот
процесс имеет большое техническое значение, так как образующийся раствор
гипохлорита обладает сильными окислительными свойствами и широко применяется
для беления тканей (хлопковых и льняных) и бумаги.
Ввиду слабости
хлорноватистой кислоты под действием углекислого газа воздуха происходит
частичное ее выделение из раствора гипохлорита:
NаОС1 + CO2 + Н2О Û NаНСО3 + НОС1
Беление основано на окислении хлорноватистой кислотой
различных загрязняющих ткань веществ. Так как наличие NаС1 отбелке не вредит,
применяют непосредственно раствор, получающийся в результате реакции хлора со
щелочью.
Раствор этот часто называют
“жавелевой водой”. На текстильных и бумажных фабриках ее иногда получают
электролизом раствора NаС1 без диафрагмы. При этом первоначально образуются
NаОН и С12, которые, взаимодействуя друг с другом, и дают “жавелевую
воду”. После беления ею необходимо очень тщательно промывать ткани, так как
избыток NаОС1 постепенно разъедает их.
Кристаллический
натрийгипохлорит может быть получен отгонкой воды из его раствора под
уменьшенным давлением, Выделяется он в виде кристаллогидрата NаОСl·5Н2О (т. пл. 45 °С), который легко
переходит в NаОС1·Н2О. Последняя соль малоустойчива, а при
нагревании до 70 °С разлагается со взрывом. Значительно устойчивее LiОС1·Н2О, который при обычных условиях выдерживает длительное
хранение.
Опыт показывает, что
окислительная активность гипохлоритов максимальна при таких значениях рН
(близких к 7), когда в растворе одновременно имеются соизмеримые концентрации и
ионов ОС1-, и молекул НОС1. Вероятно, это связано с равновесием
по схеме:
ОСl- + НОСl Û ОС1Н + ОСl-
Хотя оно и должно быть сильно смещено влево, его
существование все же обеспечивает постоянную возможность временного
возникновения неустойчивых молекул изохлорноватистой кислоты, структура которых
позволяет предполагать наличие у них повышенной тенденции к отщеплению активного
атома кислорода.
При взаимодействии хлора с
более дешёвой щелочью — Са(ОН)2 (“гашёной известью”) — образуется
хлорная известь. Реакция может быть приближенно выражена уравнением
С12 + Са(ОН)2 = Сl-Са-ОCl + H2O
согласно которому хлорная известь является смешанной
солью соляной и хлорноватистой кислот. Она представляет собой белый порошок,
обладающий сильными окислительными свойствами, и используется главным образом
для дезинфекции.
Формула Са(С1)ОС1 отражает
основной состав хлорной (иначе — белильной) извести лишь схематично. Получаемый
хлорированием Са(ОН)2 продукт представляет собой смесь различных
двойных и тройных соединений, образованных молекулами Са(ОСl)2,
Са(ОН)2, СаС12 и кристаллизационной воды.
На воздухе хлорная известь
постепенно разлагается, в основном по схеме:
2 Са(С1)ОСl + СО2 = СаС12 + СаСО3
+ С12O
При действии на нее соляной кислоты выделяется хлор:
Са(С1)ОС1 + 2 НС1 = СаС12 + Н2О
+ С12
Этим иногда пользуются для его получения — хлорную
известь смешивают с гипсом и из образовавшейся массы формуют кубики, которыми
заряжают аппарат для получения газов. Качество хлорной извести оценивают обычно
количеством хлора, образующимся при действии на нее соляной кислоты. Хорошие
продажные сорта приближенно отвечают составу 3Са(С1)ОСl·Ca(ОН)2·nН2О и содержат
около 35 вес.% «активного» (т. е. выделяющегося при действии соляной кислоты)
хлора.
Для получения более
высокопроцентной хлорной извести, состоящей главным образом из Са(ОС1)2,
хлорированию подвергают не сухой Са(ОН)2, а взвесь его в небольшом
количестве воды. При 30 °С реакция идет в основном по уравнению
2 Са(ОН)2 + 2 С12 = Са(ОС1)2
+ СаС12 + 2 Н2О
причем большая часть образующегося Са(ОС1)2
выделяется в виде мелкокристаллического осадка. Получаемый после
отфильтровывания и высушивания технический продукт содержит 45-70 % активного хлора. При взаимодействии с водой он растворяется почти
полностью, тогда как обычная хлорная известь дает объемистый осадок Са(ОН)2.
Свободная хлорноватистая
кислота испытывает в растворе три различных типа превращений, которые протекают
независимо друг от друга. и поэтому называются параллельными реакциями:
1) НОС1 = НС1 + О
2) 2 НОС1 = Н2О + С12О
3) 3 НОС1 = 2 НС1 + НСlO3
Все эти процессы способны протекать одновременно, но
их относительные скорости сильно зависят от имеющихся условий. Изменяя
последние, можно добиться того, что превращение пойдет практически нацело по
какому-нибудь одному направлению.
Под действием прямого
солнечного света разложение хлорноватистой кислоты идет по первому из них.
Так же протекает оно в присутствии веществ, способных легко присоединять кислород,
и некоторых катализаторов (например, солей кобальта).
При нагревании крепкого
раствора хлорной извести в присутствии солей кобальта распад ее идет по
уравнению:
2 Са(С1)ОСl = 2 СаС12 + O2 + 92
кДж
Реакцией этой иногда пользуются для лабораторного
получения кислорода.
При распаде по второму типу
получается газообразный продукт — оксид хлора (С12О). Эта реакция
идет в присутствии водоотнимающих веществ (например, СаС12). Оксид
хлора представляет собой взрывчатый желто-бурый газ с запахом, похожим на запах
хлора. При действии С12О на воду образуется НОС1, т. е. окись хлора
является ангидридом хлорноватистой кислоты.
Молекула С12О
полярна (m = 0,78) и характеризуется треугольной структурой
[d(СlO) = -170 пм, Ða = 111°. Энергия связи О-С1 оценивается в 205 кДж/моль. Оксид хлора (дихлормоноксид) легко
сгущается в красно-коричневую жидкость (т. пл. -121, т. кип.
+2 °С), которая может длительно сохраняться при -78 °С, но более или менее быстро разлагается при обычных условиях
(в основном по схеме 4 С12О = 2 С1О2 + 3 С12).
Получать его удобно, действуя при охлаждении хлором на свежеосажденный сухую
оксид ртути. Реакция идет по уравнению:
2 НgО + 2 Cl2 = С1НgОНgС1 + С12O
+ 79 кДж
Взрыв жидкого оксида хлора иногда происходит уже при
переливании ее из одного сосуда в другой, а газообразной — при нагревании или
соприкосновении со многими способными окисляться веществами. Он протекает по
уравнению
2 С12О = 2 С12 + О2 +
150 кДж
Энергия активации этой реакции составляет 105 кДж/моль.
Оксид хлора хорошо растворим
в СС14. Еще лучше он растворяется в воде за счет взаимодействия по
реакции
Сl2O + Н2О Û 2 НОС1
равновесие которой сильно смещено вправо (К = [С12О]/[НОС1]2
= 1·10-3 при 0 °С). Охлаждением
крепких водных растворов С12О может быть получен кристаллогидрат
хлорноватистой кислоты состава НОСl·2H2O
(т. пл. -36 °С).
Распад НОС1 по третьему типу
особенно легко идет при нагревании. Поэтому действие хлора на горячий раствор
щелочи выражается суммарным уравнением
3 С12 + 6 КОН = КС1О3 + 5 КС1 +
3 Н2О
Продуктами реакции являются КС1 и калийная соль
хлорноватой кислоты (НС1О3). Так как соль эта малорастворима в
холодной воде, при охлаждении раствора она осаждается.
Свободная НС1О3
может существовать только в растворе. Она является сильной кислотой
(диссоциированной приблизительно так же, как НС1 и НNО3) и
энергичным окислителем. Соответствующий ей ангидрид неизвестен.
В противоположность
свободной НС1О3, для ее солей (хлоратов) окислительные свойства в
растворах не характерны. Большинство из них бесцветно (как и сама НС1О3)
и хорошо растворимо в воде. Все они сильно ядовиты.
Переход гипохлорита в хлорат
осуществляется, вероятно, с участием изохлорноватистой кислоты по схемам:
НСlO + СlO- = НСl + СlO2- и НСlO +
СlO2 = НСl + СlO3-
Анион СlO3- имеет структуру треугольной пирамиды с хлором в
вершине [d(ClO) = 145 пм, ÐОСlO = 106°].
Из солей хлорноватой кислоты
практически наиболее важен КС1О3 (т. пл. 368 °С), который может быть получен электролизом горячего раствора КС1.
Хлорат калия применяется в спичечном производстве, при изготовлении сигнальных
ракет и т. д. Легкорастворимый в воде NаС1O3 (т. пл. 262 °С) является прекрасным средством для уничтожения сорных трав (на
железнодорожном полотне и т. д.).
Энергия активации
термического разложения чистого КС1О3 равна 226 кДж/моль (следует
учитывать, что процесс этот может протекать со взрывом). Расплавленный КСlO3
энергично поддерживает горение. Смеси его с легко окисляющимися веществами
(серой, фосфором, сахаром и др.) взрываются от удара.
Раствор хлорноватой кислоты
обычно получают действием серной кислоты на Ba(ClO3)2 (
т. пл. 414 °С). Отфильтровав осадок ВаSO4, можно путем
упаривания при низких температурах (в вакууме) сконцентрировать раствор
примерно до 40 % содержания НС1О3. Получается густая бесцветная жидкость
приблизительного состава НС1О3·7Н2О,
при нагревании выше 40 °С разлагающаяся. Такой раствор характеризуется столь
сильно выраженными окислительными свойствами, что при соприкосновении с ним
бумага, вата и т. п. воспламеняются. Более разбавленные растворы НС1О3
в обычных условиях довольно устойчивы. При сильном охлаждении они становятся
густыми и вязкими, но не закристаллизовываются.
При длительном совместном
нагревании фторидов и хлоритов некоторых двухвалентных металлов в присутствии
уксусной кислоты происходит взаимодействие по схеме
МF2 + M(С1O3)2 = 2
МС1O3F
с образованием соответствующей соли фторохлорноватой
кислоты (Н2С1О3F). Таким путем синтезировались хорошо
растворимые фторхлораты ряда лвухвалентных металлов (например, Сu(ClО3F·5H2O). Под действием на их растворы иона Са — осадок СаF2,
начинает медленно выделяться лишь при кипячении, т. е. ион С1О3F” оказывается довольно устойчивым по отношению к
гидролизу. Были получены также некоторые другие производные фторхлорноватой
кислоты.
Осторожным восстановлением
хлоратов может быть получен диоксид хлора (С1О2). Он представляет
собой взрывчатый желтый газ, обладающий сильно выраженными окислительными
свойствами.
В лабораторных условиях СlO2 удобно
получать по реакции 2 КСlO3 + H2С2О4
= К2СО3 + СО2 + Н2О
+ 2 СlO2
нагреванием до 60 °С увлажненной смеси
КСlO3 и щавелевой кислоты (Н2С2O4).
Другим удобным методом лабораторного получения СlO2 является
проводимая при 90 °С с тщательно осушенным хлором реакция по уравнению:
Сl2 + 2 АgСlO3 = 2 АgСl + 2 СlO2 + O2
При охлаждении ниже +10 °С диоксид
хлора сгущается в красно-коричневую жидкость и может быть таким путем отделен
от углекислого газа или кислорода.
Молекула С1О2
полярна (m = 1,78) и характеризуется треугольной структурой
[d(СlO) = 147 пм, Ða = 118°]. Энергия связи С1-О равна 251
кДж/моль.
В твердом состоянии диоксид
хлора (хлордиоксид) представляет собой желтовато-красные кристаллы (т. пл. -59 °С). Плотность ее пара отвечает простой формуле, но для
раствора в СС14 установлено наличие частичной димеризации по схеме 2
С1O2 Û С12O4 (константа равновесия
равна 0,18 при 25 °С). Запах ClO2 одновременно похож на запах
хлора и азотной кислоты. Он начинает ощущаться при 0,002 %-ном содержании С1О2
в воздухе. В темноте чистый диоксид хлора устойчив по на свету или при наличии
даже следов хлоридов постепенно разлагается. Будучи эндотермичным (теплота
образования — 105 кДж/моль) и малоустойчивым соединением, С1О2 может
взрываться при нагревании или соприкосновении со способными окисляться
веществами.
Диоксид хлора хорошо
растворим в воде (20 : 1 по объему при 4 °С) с желто-оранжевой
окраской жидкости. Разбавленные растворы (до 8 г/л) в темноте устойчивы но на
свету медленно разлагаются (с образованием НСlO3 и НС1). Известен
кристаллогидрат С1О2·6Н2О.
Используется С1О2
главным образом для отбелки или стерилизации различных материалов (бумажной
массы, муки и др.). Установлено, что с его помощью можно производить
обесфеноливание сточных вод химических заводов.
В связи с быстрым ростом
потребления С1О2 для технических целей, был предложен ряд методов
его промышленного получения. Примером может служить метод, основанный на
экзотермической реакции
2 NаClO3 + SO2 + Н2SO4
= 2 NаНSO4 + 2 ClО2
проводимой с приблизительно 4 М серной кислотой
(содержащей значительную примесь хлорид-иона).
Исходя из С1О2
довольно сложным путем было получено устойчивое -78 °С, но начинающее разлагаться уже при -45 °С темно-коричневое твердое вещество, состав которого отвечает формуле
С12О3. Является ли оно действительно оксидом
трехвалентного хлора (или представляет собой смесь других его оксидов), пока не
ясно.
При медленном пропускании
тока фтора под поверхность охлажденной до -50 °С диоксида хлора происходит ее фторирование с образованием
фторхлордиоксида (FClO2). Вещество это представляет собой бесцветный
газ (т. пл. -115, т. кип. -6 °С), довольно устойчивый по отношению к нагреванию, но весьма
гигроскопичный. Гидролиз его идет по схеме:
FСlO2 + Н2О = НF + НСlO3
Взаимодействие FСlO2 с НС1 (при -110 °С) протекает по уравнению:
2 FСlO2 + 2 НСl = 2 НF + Сl2 + 2
СlO2
т. е. СlСlO2 оказывается совершенно
неустойчивым. Вместе с тем были получены некоторые солеобразные производные СlO2+, например СlO2SbF6 (т. пл. 235 °С).
Взаимодействие С1О2
с раствором КОН медленно протекает по уравнению
2 С1О2 + 2 КОН = КС1О3 + КС1О2
+ Н2О
с образованием солей двух кислот — хлорноватой и
хлористой. Сама хлористая кислота (НС1О2) малоустойчива. По силе и
окислительной активности она промежуточна между НОС1 и НС1О3. Соли
ее (хлориты) используются при отбелке тканей.
Хлористую кислоту (К = 1·10-2) можно
получить по реакциям:
ВаО2 + 2 С1О2 = Ва(С1О2)2
+ О2 и
Ва(С1О2)2 + Н2SO4
= ВаSO4¯ +2 НС1O2
Она известна только в разбавленных растворах, при
хранении которых очень быстро разлагается, в основном, по схеме:
4 HСlO2 = 2 СlO2 + НСlO3
+ НCl + Н2О
Ион СlO2, имеет
треугольную структуру [d(СlO) = 155 пм, ÐОСlO = 111°]. Хлориты, как правило, бесцветны и хорошо растворимы в воде [за
исключением желтых АgСlO2 (1,7 г/л) и Рb(СlO2)2
(0,35 г/л при 0 °С)]. В отличие от гипохлоритов, они характеризуются
наличием сильно выраженных окислительных свойств только в кислой среде. С
другой стороны, под действием КМnO4 хлориты способны окисляться до
хлоратов. Имеются указания на возможность образования некоторых хлоритов при
непосредственном взаимодействии соответствующего металла (например, Ni) с
раствором СlO2. В твердом состоянии многие соли НСlO2
легко взрываются при нагревании или ударе.
Наиболее практически важным
хлоритом является NаСlO2. Эту соль удобно получать по реакции:
2 СlO2 + РbО + 2 NаОН = РbО2¯ + 2 NаСlO2 + Н2О
Выше 100 °С разлагается в
основном по схеме:
3 NаСlO2 = 2 NаСlO3 + NаС1
При нагревании КС1О3
плавится, а около 400 °С начинает разлагаться, причем распад может идти по
двум основным направлениям:
1) 4 КС1О3 = 4 КС1 + 6 О2 + 180
кДж
2) 4 КС1О3 = КС1 + 3 КС1О4 + 171
кДж
Реакция протекает преимущественно по первому типу при
наличии катализатора (МnО2 и т. п.), по второму — в его отсутствие.
Образующийся при распаде по второму типу хлорат калия) очень малорастворим в
воде и поэтому легко отделяется от хорошо растворимого хлористого калия.
Действием на калийперхлорат
концентрированной серной кислоты может быть получена свободная хлорная кислота
(НС1О4), представляющая собой бесцветную, сильно дымящую на воздухе
жидкость:
КС1О4 + Н2SO4 Û КНSO4 + НС1O4
Так как под уменьшенным давлением НС1O4
перегоняется без разложения, ее легко выделить из реакционной смеси.
Безводная НСlO4
малоустойчива и иногда взрывается просто при хранении, но ее водные растворы
вполне устойчивы. Как окислитель HClO4 гораздо менее активна, чем
НС1O3, и в разбавленных растворах практически не обнаруживает
окислительных свойств. Напротив, кислотные свойства выражены у нее
исключительно резко: по-видимому, она является одной из самых сильных кислот.
|
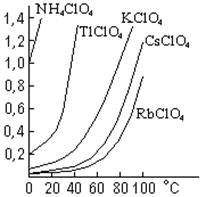
Рис. . Растворимость
некоторых перхлоратов (моль/л H2O).
|
Соли НСlO4, за
немногими исключениями (рис. ) легко растворимы в воде. Многие из них хорошо
растворяются также в органических растворителях (спирте и т. п.). Подобно самой
кислоте, большинство перхлоратов бесцветно.
Калийперхлорат применяется
для приготовления некоторых взрывчатых веществ. При 610 °С он плавится и одновременно начинает разлагаться, в основном по
уравнению:
KСlO4 = КСl + 2 O2
Получают КСlO4 обычно электролизом раствора
КСlO3. Реакция идет по схеме:
КСlO3 + Н2О = Н2
(катод) + КСlO4 (анод).
При перегонке разбавленных
растворов НСlO4 сначала отгоняется вода, затем разбавленная кислота
и, наконец, при 203 °С начинает перегоняться азеотропная смесь, содержащая
72 % HСlO4 (близкая к составу НСlO4·2Н2О и замерзающая лишь при -18 °C). Так как кипение последней сопровождается частичным разложением,
перегонку HClO4 лучше проводить под уменьшенным давлением (при 20 мм
рт. ст. азеотропная смесь перегоняется около 111 °С).
Концентрированная (72%) кислота дымит на воздухе и весьма гигроскопична, но
устойчива при хранении и не разлагается под действием света. Промышленностью
обычно выпускается 30-70 %-ная НСlO4.
Молекула HСlO4
имеет форму пирамиды с тремя атомами кислорода в основании [d(СlO) = 141 пм],
гидроксильной группой в вершине [d(С10) = 164 пм] и углом О-Сl=O, равным 106°. Безводная хлорная кислота (т. пл. — 101, т. кип.
+16'С при 18 мм рт. ст.) представляет собой весьма подвижную жидкость, тогда
как ее крепкие водные растворы имеют маслянистую консистенцию. Их охлаждением
может быть получен плавящийся лишь при +50 °С кристаллогидрат
НСlO4·Н2О, который следует рассматривать как
перхлорат оксония — [Н3О]СlO4. Частичное образование
последнего по схеме
|
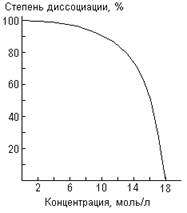
Рис. . Электролитическая
диссоциация HClO4.
|
3 НСlO4 Û [Н3О]СlO4
+ Сl2O7 + 12,5 кДж
(с константой равновесия К = 1·10-4) имеет
место и в безводной хлорной кислоте. Именно этой реакцией (в силу последующего
распада Сl2O7 по схеме 2 Сl2O7 = 4
СlO2 + 3 O2 + 117 кДж) обусловлена, вероятно,
неустойчивость безводной хлорной кислоты. Очень сильные взрывы может вызвать ее
соприкосновение со способными окисляться веществами. Хлорная кислота находит
применение при анализах, в частности для выделения более летучих кислот из их
солей.
В разбавленных водных
растворах НСlO4 не восстанавливается такими сильными
восстановителями, как НI, Н2S, SO2 и водород в момент
выделения. Даже концентрированная кислота становится очень активным окислителем
лишь при температуре кипения (когда она легко растворяет, в частности,
специальные стали).
Хотя НСlO4
является одной из самых сильных из кислот, наличие недиссоциированных молекул в
ее растворах установлено несколькими методами. Как видно из рис. , заметным оно
становится лишь в достаточно концентрированных растворах. Для константы
равновесия НСlO4 Û Н+ + СlO4– получено значение К =
38. По другим данным, хлорная кислота ионизирована в растворах еще
значительнее, чем то показано на рис. .
Входящий в состав
перхлоратов анион СlO4- представляет
собой тетраэдр с хлором в центре [d(СlO) = 144 пм].
Из безводных перхлоратов без
разложения плавится только LiСlO4 (т. пл. 236 °С) .
Вообще говоря, их
термическое разложение может идти по двум схемам: с образованием хлорида
металла и кислорода или оксида металла, хлора и кислорода. Для солей Сs, Rb, К
характерен первый путь, для солей Nа, Li, Ва, Sr, Сa преимущественно он же, а
для солей Мg и большинства других металлов основным становится второй путь
распада.
Растворимость некоторых
перхлоратов (г на 100 г растворителя при 25 °С) в воде, спирте и
ацетоне сопоставлена ниже:
|
|
LiClO4
|
NaClO4
|
KClO4
|
Mg(ClO4)2
|
Ca(ClO4)2
|
Ba(ClO4)2
|
|
H2O
|
60 |
210 |
2,1 |
100 |
189 |
198 |
|
C2H5OH
|
152 |
15 |
0,01 |
24 |
166 |
125 |
|
(CH3)2CO
|
137 |
52 |
0,16 |
43 |
150 |
125 |
Безводный перхлорат лития хорошо растворим и в эфире
(с образованием 6 М раствора), тогда как кристаллогидрат LiСlO4·3Н2О растворим весьма мало. Следует отметить, что растворы
перхлоратов в органических жидкостях, как правило, взрывоопасны.
Некоторые перхлораты
(особенно NН4СlO4) используются в реактивной технике.
Взаимодействием 72 %-ной
НСlO4 с фтором получен бесцветный фторперхлорат — FСlO4.
Это малоустойчивое соединение (т. пл. -167, т. кип. -10 °С) обладает резким запахом и весьма
реакционноспособно. И в газообразном, и в жидком состоянии оно может
разлагаться со взрывом.
Длительным взаимодействием
избытка СsСlO4 с ClSO3F при -45 °С был получен хлорперхлорат СlСlO4.
Вещество это описывается как устойчивая лишь при низких температурах
светло-желтая жидкость (т. пл. -117 °С). Наличие в молекуле хлорперхлората положительно поляризованного
атома хлора устанавливается протекающими при -78 °С реакциями по схемам
НCl + СlOСlO3 = Сl2 + НСlO4
и
АgСl + СlOСlO3 = Сl2 + АgСlO4
Взрывоопасность СlСlO4 меньше, чем FСlO4.
Если фторперхлорат является
продуктом замещения на фтор водорода хлорной кислоты, то в качестве продукта
аналогичного замещения ее гидроксила можно рассматривать фторхлортриоксид
(“перхлорилфторид”) — FСlO3. Последний образуется при действии фтора
на сухой КСlO3 и представляет собой бесцветный газ (т. пл. -148, т. кип. -47 °С) с характерным сладковатым
запахом. Удобнее получать его по схеме:
МСlO4 + НSО3F = МНSО4
+ FСlO3
действием на перхлорат смеси хлорсульфоновой кислоты и
SbF5 (которая играет роль катализатора). Теплота образования FСlO3,
из элементов равна — 21 кДж/моль, а для энергий связей даются значения 251
(FСl) и 238 (СlO) кДж/моль. Молекула FСlO3 имеет структуру несколько
искаженного тетраэдра с хлором около центра [d(СlO) = 140, d(FСl) = 161 А, ÐОС1O = 115°, ÐFСlO = 103°] и практически неполярна (m = 0,02).
Фторхлортриоксид термически
устойчив до 400 °С, не гидролизуется даже горячей водой (и холодными
щелочами), нерастворим в жидком фтористом водороде, умеренно токсичен и сам по
себе невзрывчат (но способен давать взрывчатые смеси с некоторыми органическими
веществами). Так как его критическая температура довольно высока (+95 °С), он может храниться и транспортироваться в сжиженном состоянии (при
25 °С давление пара составляет 12 атм). Окислительная
активность FСlO3 в обычных условиях невелика, но быстро возрастает
при нагревании. Поэтому реакции окисления им хорошо поддаются температурному
регулированию. Вещество это представляет значительный интерес для реактивной
техники. Существует также указание на то, что оно обладает наивысшим из всех
газов значением диэлектрической проницаемости.
При слабом нагревании под
уменьшенным давлением смеси безводной НС1О4 с фосфорным ангидридом
(Р2О5) отгоняется бесцветная маслянистая жидкость,
которая представляет собой хлорный ангидрид, образующийся по реакции
2 НСlO4 + Р2О5 = 2
НРО3 + Сl2O7
От сильного нагревания (и удара) Сl2O7
взрывается, однако он все же устойчивее, чем Сl2O и СlO2.
При взаимодействии его с водой медленно образуется хлорная кислота.
Хлорный ангидрид (т. пл. -93, т. кип. 83 °С) является сильно эндотермичным соединением (теплота
образования из элементов -251 кДж/моль). Строение его молекулы отвечает формуле
О2-Сl-O-СlO3.
Угол при кислородном атоме, соединяющем обе пирамиды СlO3 составляет
119° [при d(ОСl) = 171 пм], а угол O- Сl=О равен 115° [d(СlO) = 141 пм]. Молекула характеризуется отчетливо
выраженной полярностью (m = 0,72). С такими веществами, как сера, фосфор,
бумага, опилки и т. п., Сl2O7; при обычных температурах
не реагирует, но соприкосновение его с иодом сопровождается взрывом. Хлорный
ангидрид смешивается с четыреххлористым углеродом в любых соотношениях. При
термическом разложении Сl2O7 первичным актом является
разрыв одной из связей О-С1 (с образованием радикалов СlO3 и СlO4).
Энергия этой связи оценивается в 201 кДж/моль.
Из двух радикалов, первично
возникающих при термическом распаде хлорного ангидрида более или менее
устойчивому существованию способен, по-видимому, лишь ClO3. Триоксид
хлора (хлортриоксид) образуется при действии на СlO2 озона и
представляет собой темно-красное масло (т. замерз. +3 °С). Жидкость примерно на 99 % состоит из удвоенных молекул (Сl2O6),
тогда как в парообразном состоянии равновесие Сl2O6 + 8
кДж Û 2 СlO3 очень сильно смещено вправо.
Хотя выше уже приводились
названия кислородных кислот хлора и их солей, однако полезно сопоставить эти
названия:
Кислота Формула
Название солей
Хлорноватистая НОС1
гипохлориты
Хлористая НС1O2
хлориты
Хлорноватая НС1O3
хлораты
Хлорная НС1О4
перхлораты
Структурные формулы всех четырех кислот приводятся
ниже:
Н-O-С1 Н-O-С1=O Н-O-С1=O O
½½ ½½
O H-O-Cl=O
½½
O
Как видно из этих формул, валентность хлора в
рассматриваемых кислотах меняется по ряду: +1, +3, +5, +7.
Если сопоставить друг с
другом кислородные кислоты хлора по важнейшим для них химическим свойствам —
кислотности и окислительной активности, — получается следующая схема:
усиление кислотных свойств
——————————————®
НОС1 НС1О2 НС1О3 НС1О4
¬——————————————
увеличение окислительной активности
Кислотность изменяется, следовательно, противоположно
окислительной активности. Последняя, в общем, тем больше, чем кислота менее
устойчива. Действительно, хлорноватистая и хлористая кислоты более или менее устойчивы
только в разбавленных растворах, концентрацию хлорноватой можно довести уже до
40 %, тогда как хлорная известна в безводном состоянии. Первые три кислоты в
растворах постепенно разлагаются, а хлорная может сохраняться сколь угодно
долго. Соответствующие соли обычно значительно устойчивее свободных кислот, но
относительная их устойчивость примерно такова же.
Так как наиболее устойчивой
из всех кислородных кислот хлора является НСlO4, можно было бы
ожидать, что при взаимодействии хлора со щелочью должны сразу образовываться ее
соли. Однако сперва получаются менее устойчивые соединения, которые затем лишь
постепенно (быстрее — при нагревании) переходят в более устойчивые. На основе
изучения ряда подобных случаев уже Гей-Люссак (1842 г.) наметил так называемое
правило ступеней реакции: при химических процессах вначале обычно образуются не
наиболее устойчивые вещества, а самые близкие по неустойчивости к исходной
системе.
Во всех тех случаях, когда дальнейшие превращения
относительно менее устойчивых продуктов реакции осуществляются очень быстро
или, наоборот, очень медленно, мы практически их либо не замечаем, либо не
считаем промежуточными продуктами. Поэтому выражаемое правилом ступеней реакции
обобщение сразу бросается в глаза. Между тем при рассмотрении хода протекания
химических процессов оно часто оказывается весьма полезным.
|